肾嗜酸细胞腺瘤影像表现及病理特征分析*
陈 杰 刘 巍 王 艳,* 刘 烁 洪 悦
1.新疆维吾尔自治区人民医院放射影像中心(新疆 乌鲁木齐 830001)
2.武警新疆总队医院医学影像科(新疆 乌鲁木齐 830001)
肾嗜酸细胞腺瘤(renal oncocytoma,RO)是肾脏第二位常见肿瘤,近年来报道逐渐增多。RO的临床表现无特异性,影像鉴别较为困难。本研究回顾性分析29例经手术病理证实的RO患者的影像学资料及病理学资料,以提高对RO术前诊断的准确性。
1 资料与方法
1.1 临床资料收集我院自2010年4月至2019年6月经手术病理证实的RO患者29例,共31个病灶,其中1例患者共3个病灶,右肾2处病灶,左肾1处病灶。29例患者中,男性13例,女性16例;年龄27~77岁,平均年龄(55.25±13.31)岁;病灶位于左肾19个,右肾12个。其中术前行CT检查者24例,MRI检查者2例,CT+MRI检查者3例。
1.2 检查方法CT检查采用GE Light Speed 64层螺旋 VCT或Siemens Somatom FLASH双源CT机。扫描参数:管电压120kV,管电流500mA,球管旋转速度为0.5s/r,螺距1.375:1,准直64×0.6mm,探测器宽度40mm,显示野(FOV)36cm,矩阵512×512,层厚/层距5mm。增强方法:高压注射器经头静脉注射,使用非离子对比剂碘海醇100mL,浓度300mg/mL,速率3mL/s,皮质期及实质期分别为注射造影剂后30~35、100~120s。扫描范围腹部(包括双肾)。
MRI检查应用美国GE 1.5T HDXT MR成像仪,8通道腹部相阵控线圈。检查前对受检者进行呼吸训练以减少呼吸运动伪影,取仰卧位。常规轴位扫描T1WI及T2WI序列后行DCE-MRI。DCE-MRI:运用3D-LAVA技术,TR/TE 3.05ms/1.37ms,层厚/层间距4mm/0mm,FOV 320×320mm,矩阵320×256,经左肘前静脉快速注入(约2mL/s)钆喷替酸葡甲胺(Gd-DTPA)0.2mL/kg体重。从注射造影剂起10s后开始扫描,扫描范围腹部(包括双肾)。
1.3 影像学记录内容及判断标准由2名主治医师以上职称的放射诊断医师分析及记录病例的影像数据。记录内容包括:(1)肿瘤的一般情况;(2)肿瘤的平扫、皮质期、实质期及排泄期CT值。
计算瘤灶的强化CT值,包括各期的绝对强化CT值和相对强化CT值。
绝对强化CT值=各期增强CT值-平扫CT值。
相对强化CT值=绝对强化CT值/同侧肾皮质或者是腹主动脉绝对强化CT值。
为便于区分,定义A1、A2、A3分别为病灶增强三期(皮质期、实质期及排泄期)绝对强化CT值;定义B1、B2、B3分别为病灶相对于主动脉增强三期相对强化CT值;定义C1、C2、C3 分别为病灶相对于同侧肾皮质增强三期相对强化CT值。
1.4 病理检查对切除的肿瘤组织进行免疫组化检查并记录表达情况。
1.5 统计学方法采用SPSS 22.0软件,增强CT参数(A1~3、B1~3、C1~3)与免疫组化各指标之间的相关性采用Spearman分析,得出相关系数r值,P<0.05为差异有统计学意义。
2 结 果
2.1 肿瘤一般情况31个肿瘤最大直径约0.7~9.9cm。其中26个为类圆形,5个呈分叶状。28个肿瘤均突出肾轮廓外。囊变15个。假包膜11个,点状钙化3个,簇状钙化1个。典型病例影像图见图1-3。
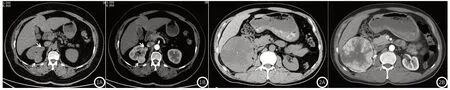
图1 患者,女,54岁。1A:平扫显示右肾上极两处类圆形结节影呈稍高密度;1B:皮质期显示病变呈中度不均匀强化。图2 患者,男,56岁。2A:平扫显示右肾巨大分叶状肿块影,见星状瘢痕及斑点状钙化灶;2B:皮质期显示病变实质呈明显强化。
2.2 CT平扫及增强表现CT平扫呈等、稍低、稍高密度。皮质期肿瘤呈明显均匀/不均匀强化,实质期17个持续强化,排泄期强化程度下降。皮质期5个呈均匀强化,其余病灶内均见低密度区,其中9个呈星状瘢痕,2个完全填充呈等密度,3个出现节段性增强反转。8个强化方式符合“快进快出”。9个增强后可见假包膜。(图3A、图1B~3B)
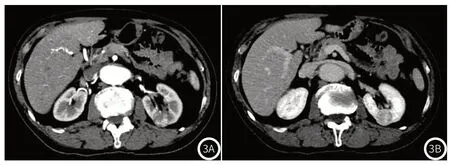
图3 患者,男,72岁。3A:皮质期示病变左份强化显著;边缘可见假包膜;3B:排泄期示病变左份强化明显减低,呈节段性增强反转。
2.3 MR影像表现肿瘤边界清或不清,病灶信号不均匀。T1WI以低信号为主,T2WI-FS呈高低混杂信号、等低信号,2个可见低信号假包膜,DWI呈等、稍高信号,增强扫描动脉期呈明显不均匀强化,延迟扫描后均有廓清。
2.4 病理结果31个瘤体病理均证实为RO。免疫组化染色结果为:CD10,13/31(41.9%);CD117,22/30(91.7%);CK20,7/17(42.1%);CK7,14/30(45.2%);EMA,19/20(95.0%);Ki-67,31/31(100%);Vimentin,6/27(22.2%);E-cadherin,2/2(100%);P53,3/11(27.3%);TFE3,2/7(28.6%);P504s,2/10(20%);CAIX,5/8(71.4%);AE1/AE3,11/12(91.7);PAX-8,3/6(50%);PAX-2,4/4(100%)。其中CD117、EMA、Ki-67阳性率较高,Ki-67均小于5%。
2.5 增强CT值与免疫组化指标表达的相关性A2、C2与CD117呈正性相关关系(P<0.05);A3、B3、C3与CD10呈正性相关关系(P<0.05),相关系数相对较高的为A3(r=0.578,P=0.001);C2与CK7呈正性相关关系(P=0.009)。A1、B1、B2、C1与免疫组化指标表达基本不相关,没有统计学意义,见表1。
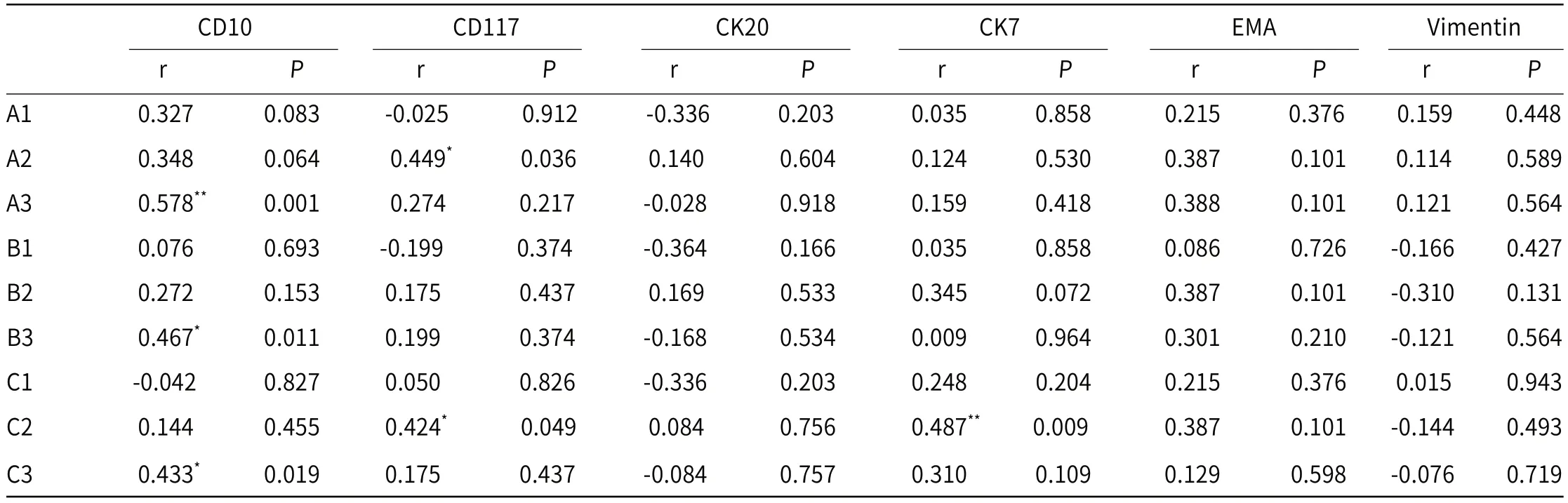
表1 三期绝对强化及相对强化CT值与免疫组化指标表达的相关性
3 讨 论
3.1 RO的影像学特征RO起源于肾皮质近曲小管上皮细胞[1],因此RO主要发生在肾皮质区。肿瘤平扫信号及密度多变,但<3.0cm者一般密度、信号较均匀,较大者常出现囊变、坏死。RO钙化相对少见,本研究中,钙化出现率为13.3%(4/30),低于文献报道[2]的31%~44%,对于肿瘤实质及中央瘢痕出现钙化的不同是否能很好地鉴别RO及肾癌说法不一[3],但均认为钙化可提示肿瘤低度恶性或者良性。
增强扫描,早期肿瘤多明显强化,强化峰值多位于皮质或实质期[3],排泄期强化程度减低。本研究中10个强化峰值位于皮质期,实质期呈“快进快出”或“快进慢出”。可以将此与典型肾癌强化方式相鉴别。但当肾癌强化方式不典型时,鉴别起来较为困难。
RO可见假包膜,较CT检查,MRI可以较好地显示低信号包膜。本研究中有11个病灶可见包膜,多见于相对较大的肿瘤。但部分肾癌亦可见假包膜,此征象鉴别价值有限。
中央瘢痕是RO较为特征性的表现之一。Eiss等[4]认为瘢痕形成是由于肿瘤生长慢且长期缺血所致。在T2WI-FS序列中央疤痕显示较为清晰,中央疤痕信号表现与其成分密切相关,如果疤痕组织以纤维化、硬化或钙化为主时呈低信号;如果疤痕组织含水分较多或发生粘液样变时呈高信号[5-6]。部分嫌色细胞癌也可以出现此征象,故仅通过中央瘢痕不能很好地提示RO,还要结合其他征象。
节段性增强反转是RO较为特征性的另一个表现。Kim等[7]报道98例肾肿瘤(直径<4cm)中,出现该征象的患者中RO为80%、肾癌为1%,故认为此征象可以用于鉴别较小的RO与肾癌。本研究中5个瘤体出现此征象,仅占RO(直径<4cm)的26%(5/19),明显低于报道。
3.2 RO影像学表现与免疫组化指标表达相关性本研究免疫组化指标中,CD117、EMA、Ki-67阳性率较高,Ki-67均<5%。通过相关性分析可知,A2、C2与CD117呈正性相关关系(P均<0.05);CD10与A3、B3、C3呈正性相关关系(P均<0.05),相关系数相对较高的为A3(r=0.578,P=0.001);C2与CK7呈正性相关关系(P=0.009)。
陈以明等[8]研究表明,CD117在嫌色细胞肾癌和RO均高表达,而透明细胞肾癌、乳头状肾癌均为阴性。在透明细胞肾癌和乳头状肾癌中CD10多高表达,嫌色细胞肾癌仅少数病例为弱表达[9]。CK7在嫌色细胞肾癌的阳性率明显高于RO,透明细胞肾癌中的表达基本为阴性[10]。因此,CD117、CD10、CK7在肾肿瘤的鉴别诊断中意义重大。本研究中部分增强CT值与RO中免疫组化指标存在一定的相关性,但还需进一步大样本及多病种对照研究。
综上所述,CT增强参数可能在一定程度上反映肿瘤免疫组化指标的表达情况。RO仅通过影像学定性诊断比较困难,但一些特征性的影像表现出现时应当高度怀疑RO,如肿瘤位于肾皮质,强化峰值多位于皮质或实质期并呈“快进慢出”强化方式,出现“星芒状”中央瘢痕及节段性增强反转。