DMEM 和F- 12K 对肝癌细胞系HepG- 2 的影响
郎程菠 杨 耿 吴振兴
(杭州医学院 基础医学与法医学院,浙江 杭州310053)
1 材料与方法
1.1 实验材料
人肝肿瘤细胞株HepG-2 来自浙江科学医学院;F-12K 培养基选用Procell;DMEM 培养基选用HyClone;FBS 胎牛血清、PBS、DMSO、双抗、胰酶购自碧云天。
1.2 实验方法
1.2.1 细胞传代
待细胞生长至培养皿的80%-90%时进行传代。弃上清,用1mlPBS 清洗两次,弃PBS,加1ml 胰酶后放置在培养箱中37℃消化1min,镜下观察细胞形态变圆后弃胰酶,加2ml 培养液用移液枪冲刷并收集细胞。将上述的2ml 混有细胞的培养液向两个空皿中各加入1ml,再将培养液补足至7ml,轻微振荡后置于培养箱中培养。
1.2.2 细胞换液
弃上清,用1mlPBS 清洗两次,弃PBS,将培养液补足至7ml,轻微振荡后置于培养箱中培养。

图1
1.3 实验过程
阶段一:
(1)将由DMEM 培养的HepG-2 细胞置于干净的细胞培养箱中培养;
(2)每隔48h 给HepG-2 细胞换液;
(3)待HepG-2 生长融合至80%-90%进行传代,分为两皿,一皿用7mlDMEM 培养(A),另一皿用2mlDMEM 和5ml F-12K混合培养(B);
(4)72h 后观察,完全用DMEM 培养的HepG-2(C)长势良好形态正常,DMDM 和F-12K 混合培养的HepG-2(D)未贴壁细胞占多数,于是对前者进行传代,仍用7ml DMEM 培养,后者进行换液,用7ml F-12K 培养;
(5)24h 后,传代下来的两皿HepG-2(E)都正常贴壁,而经过换液的HepG-2(F)基本全部凋亡,于是将用F-12K 培养的HepG-2 收集备用,两皿正常生长的HepG-2 继续培养。
阶段二:
(6)48h 后两皿HepG-2 到了可以传代的密度,于是进行了传代,平行传代成4 皿,其中两皿继续用7ml DMEM 培养,两皿用7ml F-12K 培养;
(7)48h 后,两皿DMEM 培养的HepG-2(G)状态良好,两皿F-12K 培养的HepG-2(H)有部分的凋亡;
(8)24h 后,两皿DMEM 培养的HepG-2 状态依旧良好,于是收集冻存,两皿F-12K 培养的HepG-2 长势较稀,于是将一皿换液,依旧用7ml F-12K 培养,另一皿换液成7ml DMEM 培养;
(9)24h 后,换过液的F-12K 培养的HepG-2(I)数量恒定,而改用DMEM 培养的HepG-2(J)有增殖趋势,长势更好;
(10)24h 后,F-12K 培养的HepG-2(K)有一定程度的增殖,细胞各方面状态都有所提升,DMEM 培养的HepG-2(L)增殖效果显著,密集程度大于前者,形态上已经不同于最初始培养的HepG-2。
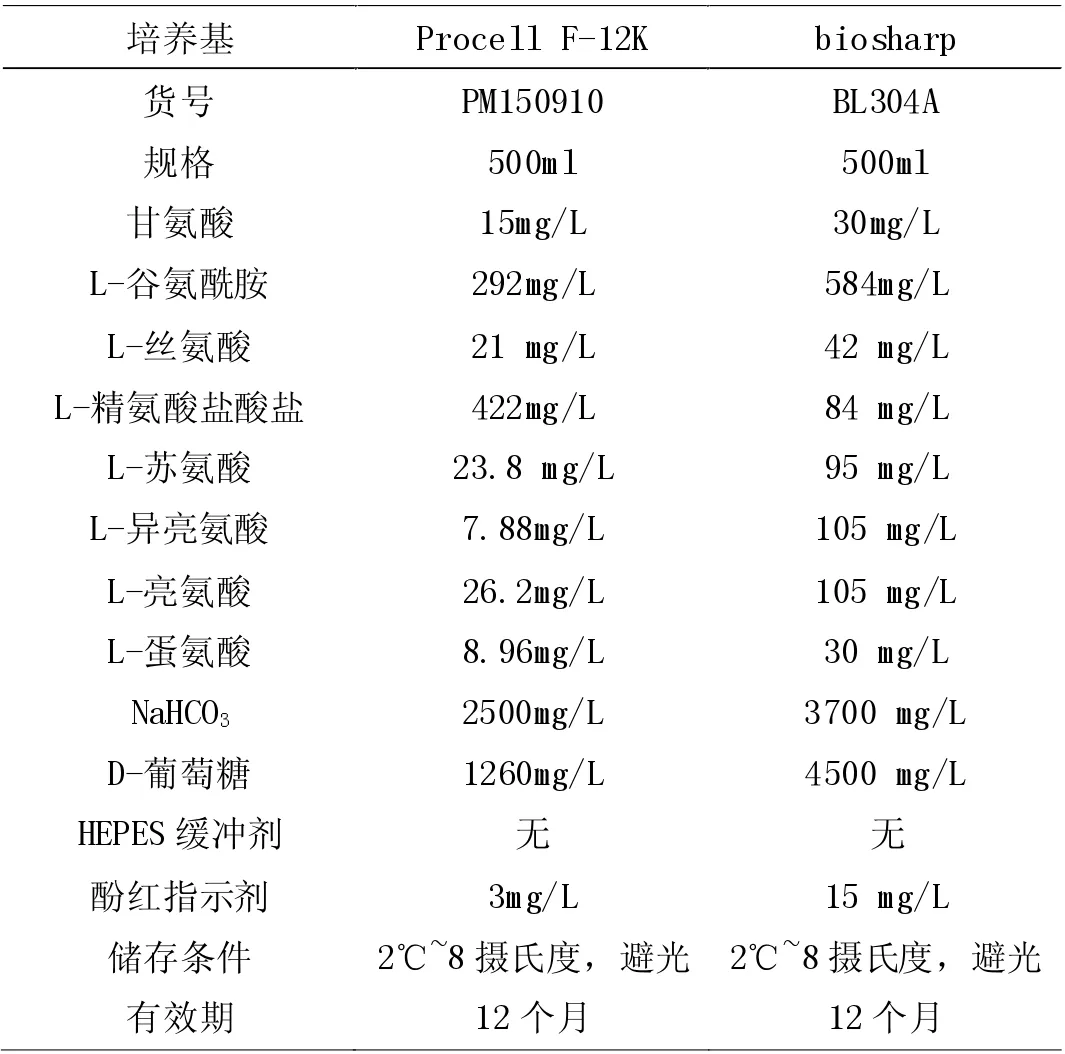
表1
2 实验结果
阶段一中,72h 后,完全用DMEM 培养的HepG-2 生长良好,几乎全部贴壁,呈不规则梭形;而F-12K 和DMEM 混合培养的HepG-2 贴壁情况较差,细胞呈圆形,经过24h 后,出现大量疑似凋亡细胞的悬浮颗粒,很难找到贴壁细胞。
阶段二中,完全用DMEM 培养的HepG-2 整个过程都长势好,颗粒饱满,增殖速度快;完全用F-12K 培养的HepG-2 在培养48h 后,有部分悬浮颗粒疑似凋亡细胞,随后对两皿细胞分别用DMEM 和F-12K 换液,继续培养24h 后,两皿细胞贴壁状态都良好,由F-12K 换成DMEM 培养的HepG-2 细胞更密集,长得更满。两皿细胞形态上棱角不分明,偏扁圆形,容易聚集生长,与原始的HepG-2 区别明显,猜测可能已经有变异。
3 讨论
培养基是细胞生长繁殖的重要因素,细胞在体外得以生长增殖需要足够的营养物质和氨基酸[1],而培养基中各氨基酸及其他营养物质的比例对于细胞社会性有不可忽视的影响[2-3]。Valdis Pirsko[4]等人设计实验,将三种乳腺癌细胞系(MCF7,SkBr3和MDA-MB-436)分别用三种细胞培养基(Eagle's Minimum Essential Medium,McCoy's 5a 和Leibovitz's L-15)培养四代并通过qPCR 测量癌细胞转录表达水平,最后结果发现,细胞培养基的差异在细胞生长的表型上有显著的影响。从本次实验结果来看,原先在DMEM 培养基中快速增殖的HepG-2 细胞,在更换了培养基环境之后增殖速度明显下降,并且细胞状态不如从前。从表1 中不难看出,DMEM 培养基中葡萄糖、甘氨酸、L-苏氨酸、L-丝氨酸氨基酸等含量远高于后者,然而后者的精氨酸盐酸盐含量较前者多。如果能证实F-12K 培养基的组分不利于或者能够抑制HepG-2 细胞的生长,那么临床上或许可以参考F-12K 培养基的营养比例给肝癌患者拟出类似的营养食谱,控制病情,从饮食上治疗,那对于对抗癌症又是一个新的思路。本次实验每隔24h 观察一次,细胞在培养皿中长满至80%~90%进行传代,没有固定的培养时间[5],目前只是初步地通过镜下来观察HepG-2 细胞在DMEM 和F-12K 中的生长状况,不同培养条件下的HepG-2 细胞均被收集,后期还可以用Western blotting检测不同培养条件下HepG-2 细胞中凋亡蛋白的表达情况,从分子水平上提供更有力的佐证。

