联氨氧化酶初步纯化及醌类化合物对其活性影响
李 竺 芯, 张 寿 通, 李 阳, 阎 松
(大连交通大学 环境与化学工程学院,辽宁 大连 116021)
0 引 言

目前已知的厌氧氨氧化菌主要包括5个属,即CandidatusBrocadia、CandidatusKuenenia、CandidatusScalindua、CandidatusJettenia和CandidatusAnammoxoglobus[6,8],均属于浮霉菌门(Planctomycetes).厌氧氨氧化反应过程中发挥核心作用的是厌氧氨氧化菌,由于这种菌生长世代长,致使其难以培养,目前仅能获得其富集培养物,人们对这种菌适宜分离与生长生态条件的研究还很有限[9-10].2007年,Shimamura等从富集有菌株KSU-1的生物反应器中分离纯化出一种具有联氨(N2H4)氧化活性但不具备NH2OH氧化能力的酶,将其正式命名为联氨氧化酶(hydrazine oxidizing enzyme,HZO)[11-14].联氨氧化酶是厌氧氨氧化菌的特征代谢酶,它可为厌氧氨氧化菌的多样性研究提供依据[15-16].厌氧氨氧化菌的代谢途径并没有准确的定论,这主要是由于对厌氧氨氧化菌的关键代谢酶缺乏深入研究,缺乏对联氨氧化酶纯化的研究,对联氨氧化酶相关性质的研究也很欠缺.若能根据提取纯化的厌氧氨氧化菌关键代谢酶来分析其活性和具体功能,将有助于对其代谢模式的确定[17].
本文对厌氧氨氧化菌进行实验室扩大培养,制备厌氧氨氧化菌的无细胞抽提液,采用超滤、DEAE阴离子层析等方法纯化厌氧氨氧化菌的特征代谢酶联氨氧化酶,检测酶活性.并研究适宜温度、pH下厌氧氨氧化菌联氨氧化酶的性质及外源醌类化合物是否会对厌氧氨氧化反应进行催化,参与到厌氧氨氧化过程.这对确保工艺的长期高效稳定运行具有重要意义.
1 粗酶液的提取测定
1.1 实验室扩培反应器
实验采用底面外直径35 cm、内直径30 cm、反应器总高度40 cm、内容积高度33 cm的圆柱形有机玻璃反应器,反应器内装有纤维质无纺布[18],反应器装置如图1所示.反应器由蠕动泵控制自动运行,根据厌氧氨氧化菌所需进水配水,加热器控制进水温度,对菌种进行反应器培养.
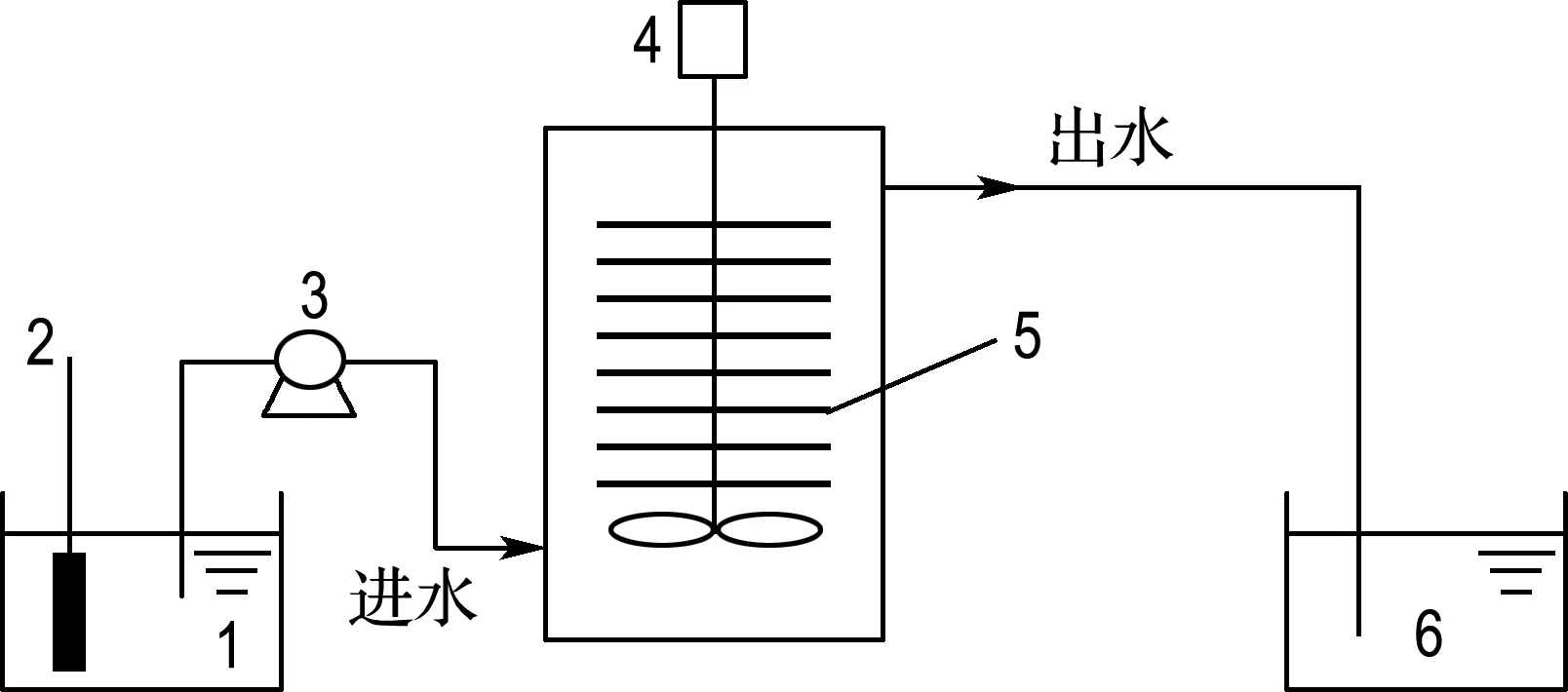
1 进水水箱; 2 加热器; 3 蠕动泵; 4 搅拌器; 5 无纺布填料; 6 出水水箱
1.2 实验用水


表1 模拟污水的主要成分

表2 微量元素溶液配方(1.25 mL/L)
1.3 粗酶液的提取
取菌样于离心管中,离心20 min后倒去上清液,留下沉淀,将沉淀加入配制好的配方(Tris缓冲液,0.1 mmol/L二硫苏糖醇,1%胆酸钠,0.5%脱氧胆酸钠)溶解混合,将混合液倒入烧杯中,放入磁力转子,于0 ℃下500 r/min的速度搅拌1.5 h,目的是将菌细胞破碎,形成菌悬;搅拌后再次离心20 min,离心后取得的上清液即为粗酶液,舍去沉淀.
1.4 细胞色素C标准曲线的绘制
分别加入细胞色素C(10 mmol/L)4、8、12、16、20、24 μL,用磷酸盐缓冲液补充至4 000 μL.此时细胞色素C浓度为10、20、30、40、50、60 μmol/L.加入保险粉至颜色变成粉红色,得到还原态细胞色素C.测得其吸光度,用得到的吸光度作标准曲线.
1.5 联氨氧化酶活性测定
酶活性强弱表征为550 nm波长下还原态细胞色素C的生成速率.酶促反应体系包含20 mmol/L 磷酸盐缓冲溶液、50 μmol/L细胞色素C(氧化态)、50 μmol/L肼和200 μL粗酶液,反应温度为(35±1)℃.联氨氧化酶活性的单位为μmol/(g·min).
1.6 蛋白浓度测定
BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司.在碱性条件下,蛋白将铜离子(Cu2+)还原为亚铜离子(Cu+),Cu+与BCA试剂形成紫蓝色的络合物,测定其在562 nm处的吸光度,并与标准曲线做对比,即可计算待测蛋白的浓度.
2 联氨氧化酶的初步纯化
2.1 层 析
(1)DEAE-Sepharose FF凝胶的处理:凝胶用纯净水反复冲洗直到形成较大颗粒胶体,用Tris缓冲液平衡.
(2)装柱:将层析柱固定于滴定架上,柱底垫圆形尼龙纱,出口接细塑料管并关闭出水.将浸泡于20 mmol/L、pH8.0 Tris缓冲液中的凝胶沿玻璃棒缓慢倒入柱中(注意不要有气泡),待凝胶自然沉降将上层盖子缓慢放入并拧紧.
(3)平衡:松开出水口螺旋夹,以20 mmol/L、pH8.0 Tris缓冲液平衡,控制流速为2.0 mL/min,待流出液的紫外吸光度稳定时,停止平衡.
(4)加样、洗脱与收集:采用恒流泵以2.0 mL/min 的流速加入样品,待液体进入柱床后,用初始缓冲液洗脱大约两个柱体积,再分别用0.1、0.2、0.3、0.4、0.5、1.0、2.0 mol/L的NaCl(平衡缓冲液配制)进行线性洗脱,控制流速为2.0 mL/min.紫外蛋白监测,收集洗脱蛋白.
2.2 透析冻干
将0.2 mol/L NaCl洗脱下来的蛋白质液体进行透析脱盐,然后进行冻干,冻干的步骤如下:首先按制冷键,预冷30 min左右;预冷后将干燥物品放置于干燥盘中,将有机玻璃罩罩上,按下快速充气阀上的不锈钢片,将接嘴管拔出,最后按真空泵键,显示999,直到1 000 Pa以下方可显示实际真空度.
2.3 超 滤
冻干后得到的酶蛋白用Tris缓冲液进行溶解,然后进行超滤过滤,超滤膜的截留相对分子质量分别为50 kDa和100 kDa.经此步骤可得到相对分子质量小于50 kDa、50~100 kDa和大于100 kDa 3部分酶蛋白,超滤后用20 mmol/L Tris缓冲液洗膜,测各部分酶蛋白活性,最后将具有最高比活性的溶液挑选出来,4 ℃保存,备用.
3 醌类化合物对联氨氧化酶的影响探究
3.1 萃取醌类化合物对联氨氧化酶活性的影响
以乙醇为溶剂,因此设置乙醇为对照组,通过萃取,将厌氧氨氧化菌联氨氧化酶粗酶液中的辅酶Q萃取出来,此时测量萃取后联氨氧化酶的酶活性,并通过分光光度计测量酶活性变化的OD值.再将辅酶Q重新加入联氨氧化酶粗酶液中,探究此时联氨氧化酶的酶活性和OD值,对萃取前后的酶活性变化进行比较.
3.2 其他醌类化合物对联氨氧化酶活性的影响
先分别加入0.03和0.06 mmol/L辅酶Q,测其联氨氧化酶活性及OD值.再探究2-羟基-1,4-萘醌对联氨氧化酶活性的影响,分别加入0.03、0.06、0.3和0.6 mmol/L的2-羟基-1,4-萘醌,测量并比较加入不同量的2-羟基-1,4-萘醌后联氨氧化酶活性及OD值的变化,并对加入量与加入辅酶Q的酶活性变化进行比较.最后探究蒽醌-2-磺酸钠盐对联氨氧化酶活性的影响,分别加入0.03、0.06、0.3和0.6 mmol/L的蒽醌-2-磺酸钠盐,同理测量并比较加入不同量的蒽醌-2-磺酸钠盐后联氨氧化酶活性及OD值的变化,并对加入量与加入辅酶Q及加入2-羟基-1,4-萘醌的酶活性变化进行比较.
4 结果与讨论
4.1 粗酶液的制备与酶活性探究相关结果
4.1.1 还原态细胞色素C标准曲线的绘制 还原态细胞色素C标准曲线的绘制如图2所示(波长550 nm).
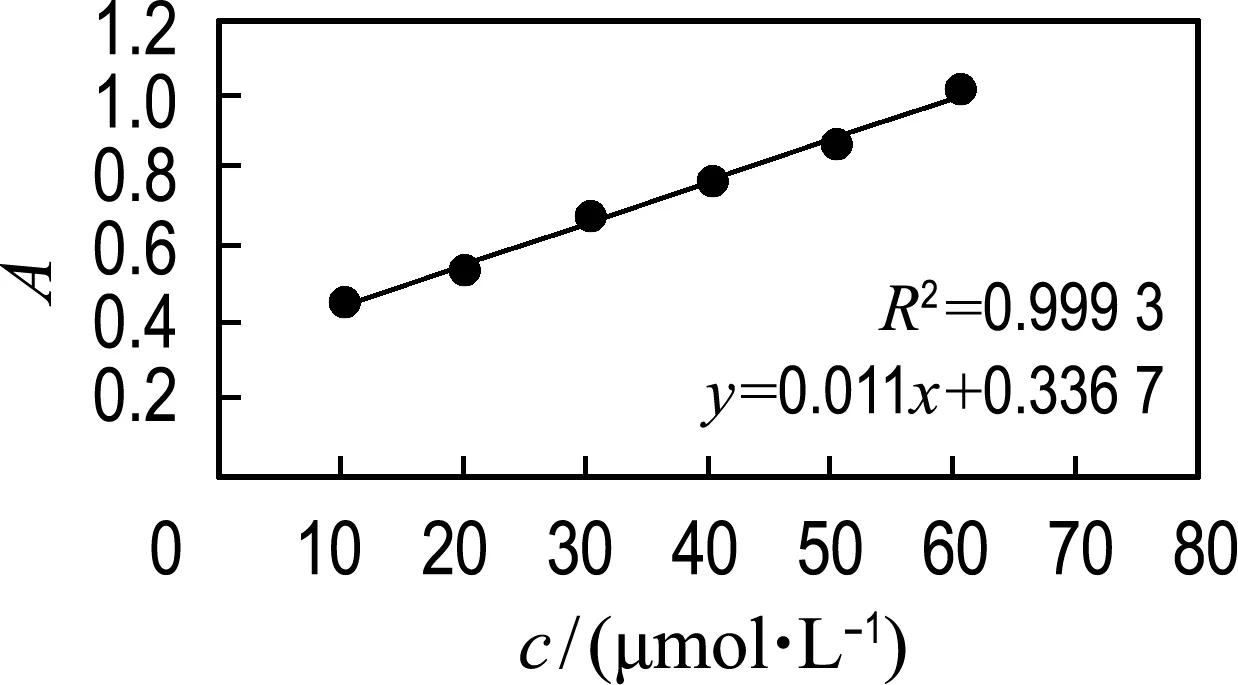
图2 细胞色素C标准曲线
4.1.2 BCA标准曲线的绘制 BCA标准曲线的绘制如图3所示(波长562 nm).
经测量得到粗酶液吸光度为0.477,通过图3中公式计算得到粗酶液蛋白含量为0.347 mg/mL.

图3 BCA标准曲线
4.1.3 联氨氧化酶活性的测定计算 对联氨氧化酶活性进行测定,其不同时间下对应的吸光度及计算所得的细胞色素C浓度如表3所示.
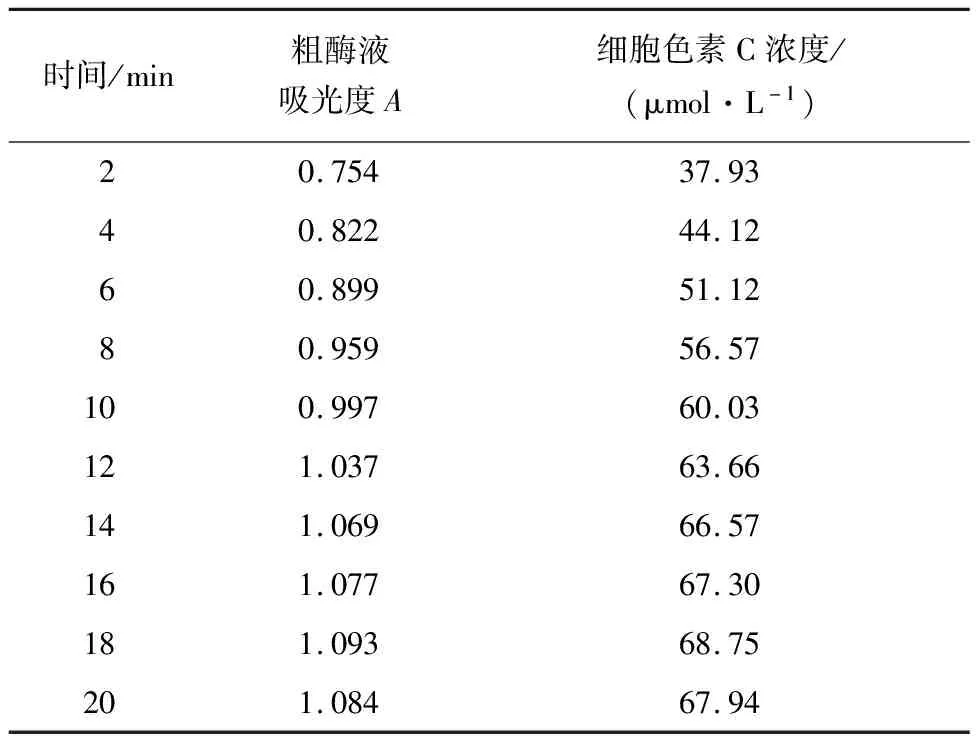
表3 联氨氧化酶活性的测定
联氨氧化酶活性a计算公式如下:
a=(c-c0)/(τ×ρ)
其中c为稳定后细胞色素C浓度,c0为初始细胞色素C浓度,τ为达到稳定间隔时间,ρ为粗酶液蛋白含量.
根据以上公式计算联氨氧化酶活性a=(68.75-37.93)/[(18-2)×0.347]μmol/(g·min)=5.55 μmol/(g·min),得出联氨氧化酶粗酶液的酶活性为5.55 μmol/(g·min).
4.1.4 温度对联氨氧化酶活性的影响 图4实验数据表明吸光度随着温度的升高先升高后降低,也就是说联氨氧化酶活性随着温度的升高先升高后降低,可以看到35 ℃时联氨氧化酶活性最高.
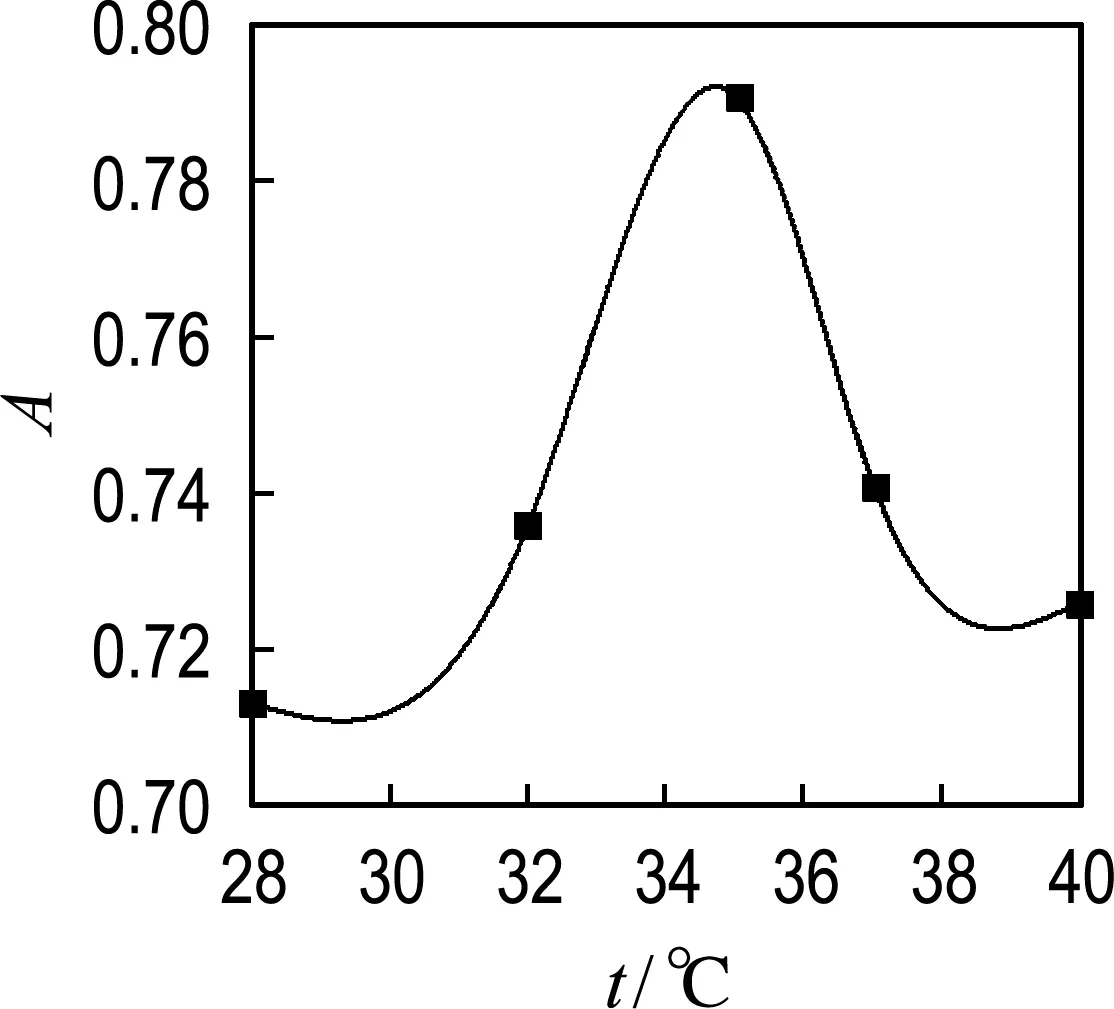
图4 温度对联氨氧化酶活性的影响
4.1.5 pH对联氨氧化酶活性的影响 图5实验数据表明不同反应时间下吸光度都是先升高后降低,也就是说联氨氧化酶活性随着pH的升高先升高后降低,分析可以得到不同反应时间下pH=7.5时联氨氧化酶活性最高.

图5 pH对联氨氧化酶活性的影响
4.2 联氨氧化酶的初步纯化结果
4.2.1 DEAE阴离子交换层析结果 由表4和图6结果,通过计算可得经DEAE阴离子交换层析后,联氨氧化酶集中在0.2 mol/L NaCl洗脱液中,其他浓度的NaCl洗脱液中虽然也有蛋白含量,但是蛋白含量都不高,而且从层析图谱可以看出其他洗脱液中所含蛋白应该不是联氨氧化酶蛋白,0.2 mol/L NaCl洗脱液中蛋白酶活性是粗酶液的2.3倍.

图6 层析谱图

表4 不同浓度NaCl洗脱的联氨氧化酶活性
4.2.2 超滤结果 通过表5可以看出DEAE阴离子交换层析和超滤的方法都能使联氨氧化酶得到纯化,DEAE阴离子交换层析将联氨氧化酶活性增加到原来的2.3倍,层析后取0.2 mol/L NaCl洗脱下来的蛋白再进行超滤后,将联氨氧化酶活性增加到原来的6.1倍.表6计算结果表明0.2 mol/L NaCl洗脱下来的联氨氧化酶活性集中在超滤50~100 kDa的液体中,纯化蛋白相对分子质量在50~100 kDa.
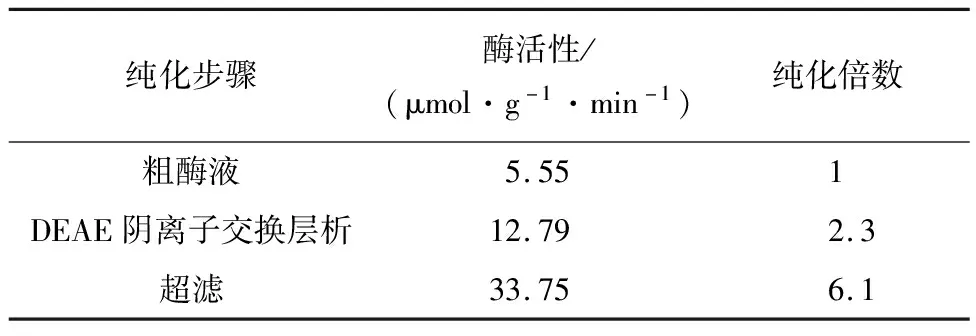
表5 联氨氧化酶初步纯化总结
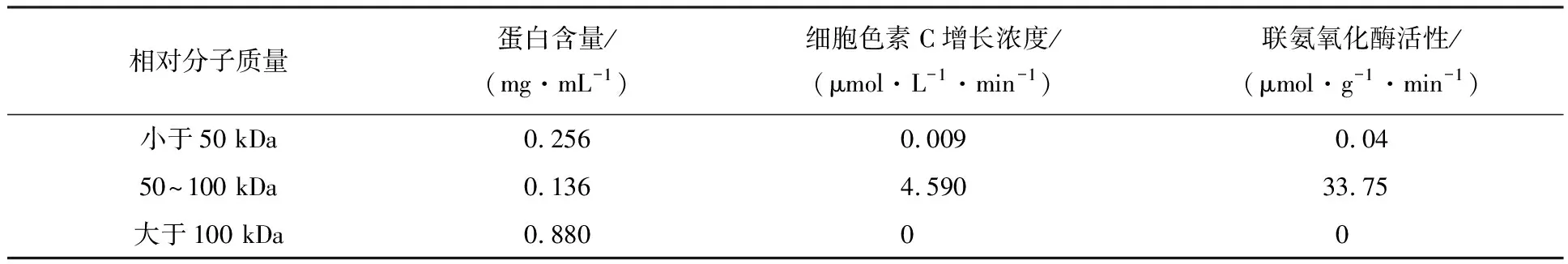
表6 超滤后细胞色素C吸光度测定
4.3 醌类化合物对联氨氧化酶活性的影响结果
由图7可知以乙醇为溶剂会使酶活性降低,由5.688 μmol/(g·min)降低到3.886 μmol/(g·min);萃取出辅酶Q,酶活性降低至原来的1/3,重新加入辅酶Q,对提高酶活性效果最好.
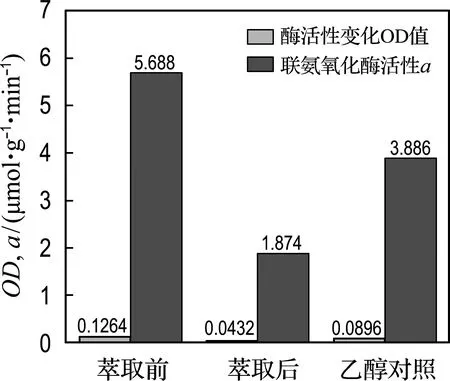
图7 萃取醌类化合物对联氨氧化酶活性的影响
由图8可知,与乙醇对照相比加0.06 mmol/L辅酶Q的酶活性是9.264 mol/(g·min),是乙醇对照的2.38倍;2-羟基-1,4-萘醌对酶活性提高效果稍差,与乙醇对照相比加0.6 mmol/L 2-羟基-1,4-萘醌酶活性是其1.74倍;蒽醌-2-磺酸钠盐对酶活性提高基本无影响,与乙醇对照相比加入0.6 mmol/L 蒽醌-2-磺酸钠盐的酶活性是其活性的0.96.

图8 加入醌类化合物联氨氧化酶活性测定对比图
5 结 论
(1)联氨氧化酶活性最适温度为35 ℃,最适pH为7.5.
(2)通过DEAE阴离子交换层析可知联氨氧化酶集中在0.2 mol/L NaCl洗脱液中,酶活性是粗酶液的2.3倍,因此层析法可以进一步纯化联氨氧化酶.
(3)超滤结果表明,纯化的联氨氧化酶蛋白相对分子质量在50~100 kDa,联氨氧化酶活性提高到原来的6.1倍.
(4)通过正庚烷萃取辅酶Q,粗酶液酶活性降低,投加辅酶Q对提高酶活性效果最好,2-羟基-1,4-萘醌对酶活性提高效果稍差,蒽醌-2-磺酸钠盐对酶活性基本无影响.

