肺高压伴发室上性心律失常危险因素分析
何梦钰,丁怡睿,金琳羚,孔 辉,解卫平
南京医科大学第一附属医院呼吸与危重症医学科,江苏 南京 210029
肺高压(pulmonary hypertension,PH)是一类严重威胁人类健康的肺血管疾病,其主要病理生理学特征是静息状态下肺动脉压力升高,同时合并不同程度右心功能衰竭。欧洲心脏病学会(ESC)/欧洲呼吸学会(ERS)指南将该疾病分为五大类,包括肺动脉高压(pulmonary arterial hypertension,PAH)、左心疾病所致肺高压、呼吸系统疾病和/或缺氧所致肺高压、肺动脉阻塞性疾病所致肺高压以及未知因素所致肺高压[1]。目前PH患者的5年生存率为38%~59%,右心功能衰竭是患者的主要死亡原因,心律失常也是导致PH患者预后不佳的另一重要因素[2]。在所有心律失常类型中,室上性心律失常(supraven⁃tricular arrhythmias,SVA)发生率为11.7%~33.0%,SVA 可直接导致PH 患者临床恶化,增加患者住院风险、病死率及猝死可能[3]。因此,加强临床医师对PH 伴发SVA 的认识十分必要。本研究回顾性分析2011年1月—2016年12月于本院住院的61例PH 患者,探究PH 伴发SVA 的危险因素,以提高临床医生对PH 伴发SVA 的认识。
1 对象和方法
1.1 对象
收集2011 年1 月—2016 年12 月在本院住院的PH 患者,包括特发性肺动脉高压(idiopathic pulmo⁃nary artery hypertension,IPAH)、慢性血栓栓塞性肺高压(chronic thromboembolic pulmonary hyperten⁃sion,CTEPH)、结缔组织病相关性肺动脉高压(con⁃nective tissue disease⁃PAH,CTD⁃PAH)患者,共纳入61 例患者并收集其临床资料,发现其中14 例伴发SVA。将伴发SVA患者纳入SVA组,未发生SVA患者纳入非SVA组。非SVA组纳入标准:静息状态下,经右心漂浮导管检测平均肺动脉压力(mean pulmo⁃nary artery pressure,mPAP)≥25 mmHg,同时肺小动脉楔压(pulmonary artery wedge pressure,PAWP)≤15 mmHg 及肺血管阻力(pulmonary vascular resistance,PVR)>3 Wood单位。急慢性左心功能不全、合并诱发左心功能不全的疾病(高血压、冠心病)、急性肺栓塞、肾功能不全、甲状腺功能异常等除外。
SVA组纳入标准:PH患者通过接受十二导联心电图检查(electrocardiogram,ECG)、动态心电图诊断SVA,包括持续性心房颤动、阵发性心房颤动、持续性心房扑动、阵发性心房扑动、室上性心动过速、房性心动过速。心电图仪参数设置:走纸速度25 mm/s,电压10 mm/mV。按照心电图诊断标准进行诊断。PH 诊断标准参考《中国肺高血压诊断和治疗指南(2018)》。本研究经院伦理委员会批准,并知情同意。
1.2 方法
在本院电子病历系统中以出院诊断为“肺高血压”“肺动脉高压”“肺高压”进行搜索。选取IPAH、CTEPH 和CTD⁃PAH 患者并记录其性别、年龄、基础ECG(即首次就诊时ECG结果)、右心漂浮导管检查测定的血流动力学参数[包括mPAP、右心房压(right atrial pressure,RAP)、右心室收缩压和舒张末压]、超声心动图检查测定的参数[包括左心室射血分数(left ventricular ejaculation fraction,LVEF)、左心房内径(left atrial diameter,LAD)、左心室舒张末期内径(left ventricular end diastolic dimension,LVDd)、估测肺动脉压力、右心房内径(right atrial di⁃ameter,RAD)、右心室舒张末期内径(right ventricu⁃lar end diastolic dimension,RVDd)]、N末端B型脑利钠肽原(N⁃terminal pro B⁃type natriuretic peptide,NT⁃proBNP)等指标。SVA组和非SVA组进行危险因素比较。将单因素分析差异有统计学意义的指标再进行多因素回归分析。对本研究纳入的61 例患者进行电话或门诊随访资料,统计患者生存时间,计算病死率,即PH患者因该病死亡者占总PH患者的比例。
1.3 统计学方法
本研究运用SPSS 16.0 统计学软件处理。计量资料用均数±标准差()表示,组间比较运用t检验或秩和检验;计数资料用例数或百分率表示,组间比较运用χ2检验;应用单因素分析评估PH 伴发SVA 的相关临床危险因素,将其中P<0.05 的变量纳入二分类多因素Logistic 回归分析(因变量:PH未发生SVA=0;PH 伴发SVA=1),确定PH 伴发SVA的高危因素;用Kaplan⁃Meier 法绘制生存曲线。P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料比较
本研究共纳入61例PH患者,其中,男10例,女51 例,年龄17~72 岁,平均(40.75 ± 14.96)岁,包括IPAH 患者32 例(52.46%),CTD⁃PAH 患者19 例(31.15%),CTEPH 患者10 例(16.39%)。SVA 组共14 例(占纳入患者22.95%),男2 例,女12 例,包括IPAH 患者6 例(42.86%),CTD⁃PAH 患者5 例(35.71%),CTEPH 患者3 例(21.43%)。非SVA 组47 例(占纳入患者77.05%),男8 例,女39 例,包括IPAH 患者26 例(55.32%),CTD⁃PAH 患者16 例(34.04%),CTEPH 患者5 例(10.64%)。SVA 组和非SVA组在性别、PH类别上差异无统计学意义。SVA组年龄27~72岁,平均年龄(49.21±4.99)岁,非SVA组年龄17~69岁,平均年龄(38.02±1.87)岁,两组在年龄分布上存在统计学差异(P=0.013,表1)。14例SVA 组患者有1 例合并右侧甲状腺结节,47 例非SVA组患者有1例合并甲状腺无功能腺瘤。
2.2 肺高压伴发SVA患者的临床特点
14 例SVA 组患者2 例基础ECG 显示房颤心律和房扑心律,5例基础ECG为窦性心律出现过房性心动过速。随访ECG发现1例患者出现新发房颤心律,6例患者出现新发房性心动过速,心房颤动占SVA类型的21.4%。
通过分析发现SVA 组患者NT⁃proBNP 值更高[(5 605 ± 2 908)pg/mL],而非SVA 组NT⁃proBNP为(1 763 ± 459)pg/mL,差异存在统计学意义(P=0.037)。在随访过程中通过检测二维超声心动图发现,SVA组患者RAD为(50.64±4.36)mm,非SVA组患者RAD 为(43.03±1.10)mm,差异存在统计学意义(P=0.017)。SVA 组患者LVEF 为(63.35 ±2.32)%,非SVA组患者LVEF为(67.65±0.83)%,差异存在统计学意义(P=0.032)。SVA 组与非SVA 组相比在mPAP、RAP、RSD、LAD、LVDd、RVDd上差异不存在统计学意义(表1)。
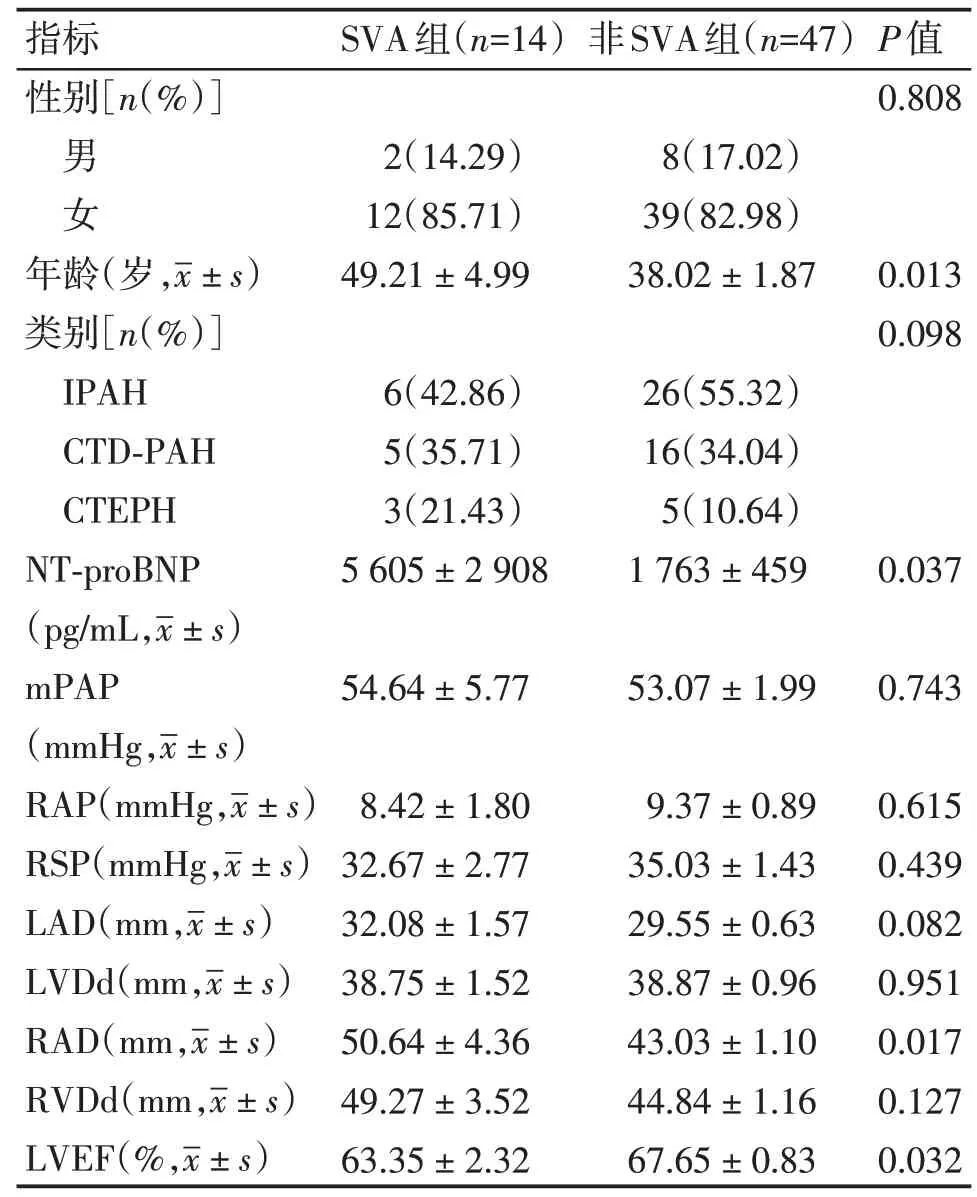
表1 SVA组和非SVA组患者临床资料比较Table 1 Comparison of baseline characteristics between patients with and without SVA
2.3 多因素Logistic回归分析
将以上单因素分析结果中有统计学差异的变量(年龄、NT⁃proBNP、RAD、LVEF)进行多因素Lo⁃gistic回归分析(表2)。结果发现,与非SVA组相比,PH 伴发SVA 组患者右心房内径更大(OR=0.853,95%CI:0.745~0.976,P=0.021)。年龄、NT⁃proBNP、LVEF与PH患者伴发SVA没有显著关联。
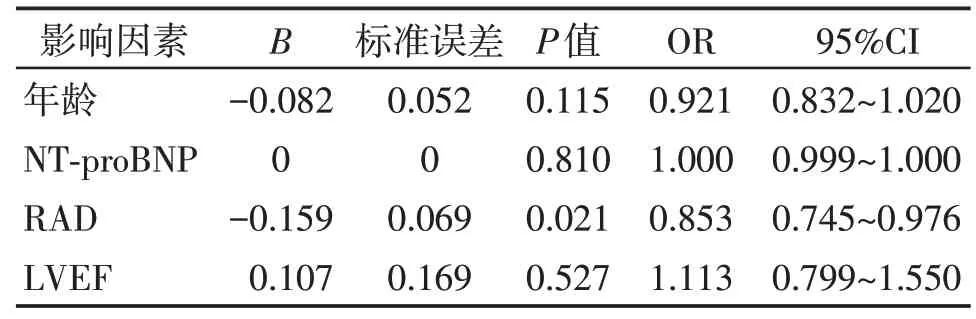
表2 PH伴发SVA危险因素Logistic回归分析Table 2 Logistic regression analysis of risk factors of PH with SVA
2.4 PH伴发SVA患者生存分析
截至随访结束,61 例PH 患者经住院监护及治疗后,17 例患者死亡,其中男2 例、女15 例,病死率27.87%。SVA组4例死亡,病死率28.57%,其中1例为基础ECG 窦性心律病程中新发房颤患者,2 例为基础ECG窦性心律病程中新发房性心动过速患者,1例为基础ECG为窦性心律出现过房性心动过速患者;非SVA 组13 例死亡,病死率27.66%。PH 伴发SVA组患者的中位生存时间为66个月,非SVA组患者的中位生存时间为84个月(图1)。
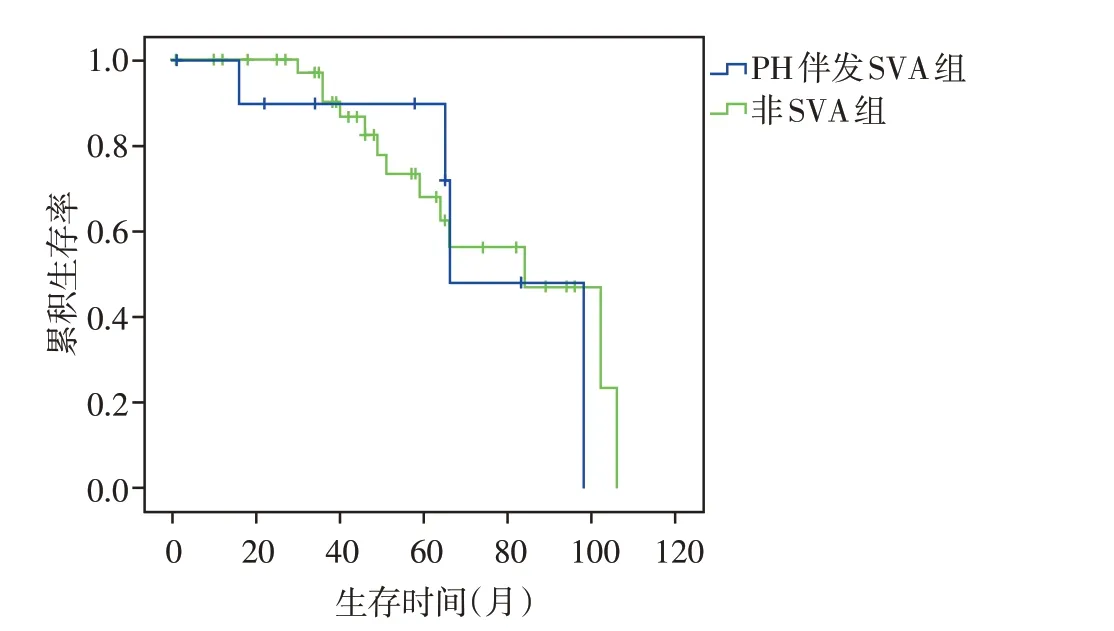
图1 PH 伴SVA 组及非SVA 组患者Kaplan⁃Meier 总体生存曲线Figure 1 Survival curves of PH patients with and without SVA
3 讨论
本研究发现SVA是PH患者病程中常见伴发的心律失常类型。单因素分析发现RAD、NT⁃proBNP、LVEF、年龄与PH伴发SVA相关。Logistic多因素回归分析发现RAD 与PH 伴发SVA 显著相关,RAD 越大PH患者发生SVA的可能性越大。
尽管目前已有研究关注于PH患者并发心律失常,但不同研究报道PH 伴发SVA 的患病率仍存较大差异。Tongers 等[4]进行一项回顾性队列研究,共纳入231 例PH 患者,在6 年的随访过程中,SVA 发生率为11.7%,其中心房颤动发生率最高,其次为房室结折返性心动过速。在一项前瞻性研究中,共纳入PAH患者及无法手术的CTEPH患者157例,发现房颤的5 年累积发病率达25.1%[5]。2018 年一项研究显示,PH 患者伴发SVA 的患病率为46.4%,其中40%为心房颤动[6]。本项研究发现,经过至少3年的随访,PH患者SVA患病率为23.0%,其中21.4%为心房颤动。
既往研究表明,左心房增大是房性心律失常发生的重要危险因素,心房增大引起组织细胞牵拉,心房结构重塑最终引起心房电重塑。目前,关于右心房重塑在SVA 病理生理过程中的作用还知之甚少。研究发现,右心房增大可预测房颤消融后心房扑动的发生[7];同时与致心律失常性右室心肌病中房性心律失常发生密切相关[8]。虽然右心房增大与右室收缩压具有较好的相关性,已被认为是评估PH患者预后的重要指标,但右心房大小与PH 患者发生心律失常的风险尚未证实[9-10]。本项研究发现右心房重塑与PH 患者伴发SVA 显著相关,RAD 越大PH 患者发生SVA 的可能性越大。心脏电生理研究发现,大多数引起阵发性房颤的异位搏动始于肺静脉,仅4.7%异位搏动始于肺静脉之外,源于右心房。但对于右心负荷过重的患者,始于肺静脉以外的异位搏动更具病理生理学意义[11]。研究显示,mPAP升高的慢性肺部疾病合并房颤患者中,26.7%的患者异位搏动始于右心房,原因可能是由于慢性肺病导致右心超负荷,右心房压力升高导致右心房肌纤维及传导系统牵拉,引起电重塑诱发异位搏动,最终引起房性心律失常[12]。
SVA的发生可直接导致PH患者预后不良,其病理生理过程可能与血流动力学恶化,心房无法支持心室充盈过程从而导致右心室功能障碍有关[13]。研究显示,SVA的伴发常导致PH患者临床恶化,出现如急性右心衰竭、明显的活动耐力下降、难治性腹腔积液等症状,且患者临床症状恶化程度似乎与心房传导功能、心室舒张功能相关。此外,当PH患者右心功能或临床症状有所改善后,往往可恢复正常窦性心律,进一步证实SVA 是引发或加重PH 右心衰竭的原因[4]。抗心律失常药物、电复律、超速起搏及射频消融都是SVA 的基础治疗方法,但目前针对PH 人群的有效治疗策略仍无确切结论。现有研究表明控制心脏节律、恢复窦性心律能有效改善PH患者临床症状[14]。Cannillo 等[15]对PH 伴发心律失常患者尝试控制心脏节律,11%的患者可恢复窦性心律,但在随访过程中复发率达80%。Olsson 等[16]通过抗心律失常药物、电复律及射频消融治疗伴发房扑或房颤的PH患者,其中21例房扑患者及16例房颤患者恢复了窦性心律,继而临床症状得到明显改善。本项研究发现,PH 伴发SVA 组病死率28.57%,中位生存时间为66 个月,非SVA 组病死率27.66%,中位生存期为84个月。由此可见,PH患者发生SVA常预示患者预后不佳,短期内恢复并稳定维持窦性心律能改善患者临床症状,SVA 的新发也提醒临床医师需要改变患者的靶向治疗方案或考虑肺移植治疗。
本项研究根据PH 患者ECG 及动态心电图结果,将纳入病例分为SVA组和非SVA组回顾性分析了PH 伴发SVA 的危险因素,但是考虑回顾性研究仅根据既往临床资料结果判断SVA 发生可能会造成一定偏倚,且非前瞻性随机对照研究,证据级别有限,故需更多高质量研究证实。
本研究发现RAD、NT⁃proBNP、LVEF、年龄是PH伴发SVA的相关危险因素,其中RAD与PH患者伴发SVA 显著相关,是PH 患者发生SVA 的独立预测因素。因此,对于具有高危因素的PH 患者要警惕SVA的发生,维持窦性心律,改善患者预后。

