硅藻土特性、提纯及在生物医药领域中的应用
张育新,戴兴健,张臣智,张欣芳,易志宇,杜智岚,周权
重庆大学 材料科学与工程学院,重庆 400044
引 言
生物技术的最新进展加速了新药的发现和开发,有60%以上的生物技术成果应用到制药行业,并不断在新药开发和传统医药的改造上取得长足的进展[1]。传统药物治疗中使用的许多药物,由于较差的物理化学性质导致其在生理pH下溶解度低、稳定性差、靶向性差的副作用和高毒性,造成了其在医药领域的局限性。使用纳米技术可大大改善各种疾病的治疗形式和诊断效率,能最大限度地发挥药物的药理作用,在药物制造方面也展现出其独特的优势[2-3]。在过去的几十年里,纳米技术从纳米颗粒和微载体到可植入设备的发展对药物递送、组织工程、生物传感、生物成像等生物医学研究的各个领域都产生了巨大的影响。与基于纳米技术合成方法的人工合成材料相比,许多生物体能产生自然优化的层次结构,效率更高,成本更低廉。因此,在生物纳米技术和微系统制造方面,寻求天然来源的物质作为环境友好的医药功能材料具有巨大的潜力。
硅藻土是亿万年前硅藻遗骸形成的生物成因硅质沉积岩,被誉为“孕育生命的海底草原”。全球硅藻土资源储量共计9.2亿t,远景储量35.73亿t,广泛分布在120多个国家[4-5]。据USGS报道,我国的硅藻土资源储量丰富,2018年硅藻土生产总量约占世界总量的15.56%,位居世界第三和亚洲首位,主要分布于东北地区、东部沿海、四川攀西以及云南省的东部和西南部。中国资源矿产报告显示,截至2017年,我国已探明硅藻土资源储量约为5.13亿t。我国硅藻土资源以中低品位为主,优质资源占总储量不足10%,仅有吉林长白马鞍山矿、西大坡矿和云南腾冲县观音塘矿的硅藻壳体含量在85%以上、非晶态SiO2的含量在80%以上。硅藻土虽然在我国属于优势非金属矿资源,但是优质硅藻土特别是一级硅藻土资源紧缺,亟需开拓其应用领域,提高硅藻土的附加价值[6]。
硅藻土有别于其他传统的三维多孔材料,硅藻土拥有独特的纳米至微米尺度的高重复性三维多孔结构,轻质、优异的机械强度,高比表面积、热稳定性和极低的密度等特性,作为一种廉价易得的生物硅矿物广泛应用于工业、农业、能源、建材、环境领域[7-11]。随着研究的深入,硅藻土多孔结构能保持治疗药物的无定形,这对提高亲脂药物的溶解性和渗透性至关重要。硅藻土极具耐酸耐热特性,优异的生物相容性,无毒副作用,其得天独厚的中空多孔微胶囊结构提供了更大的表面积,使其具有高的载药量,成为开发纳米药物载体的理想选择。硅藻土表面活性SiO2组分可以作为接枝点位进行多种生物医药功能化,可以有效克服传统药物的局限性,用于药物靶向递送、止血材料研发和组织工程等。硅藻土独特的结构也启发了新型纳米结构材料的设计和生产,利用其光子等特性应用于各种医学治疗,例如生物传感和微机器人,拓展了硅藻土在生物医学应用方面的研究。
1 硅藻土理化性能、提纯及表面改性
1.1 硅藻土理化特性
硅藻土作为古老单细胞硅藻的数百万年生物遗骸的产物,延续了硅藻壳体的天然纳米结构。硅藻土的微孔结构具备有序性,如图1所示,其外观形貌有圆盘状、直链状、羽状、针状等,每一种硅藻都有其独特的表面特征[12]。表面具有各种特定的特征,例如尖刺、孔、脊和刺[13]。硅藻土的孔径从微米到纳米尺度,小孔孔径为20~50 nm,大孔孔径为100~300 nm,孔隙率高达90%。目前已知存在2×105种硅藻,构成了105~106种三维硅藻土壳体[14]。一般而言,纯净硅藻土一般为白色,由于铁、锰及有机质的影响而呈灰色、黄色、褐色等。硅藻土的堆密度0.34~0.65 g/cm3,比表面积40~65 m2/g,孔半径20~200 nm,孔体积0.45~0.98 cm3/g,熔点在100~165 ℃,煅烧中在450~650 ℃失去羟基水和有机物,850 ℃煅烧成方石英结构,1 050 ℃煅烧成莫来石结构[15]。吸水率是自身体积的2~4倍,是热、电、声的不良导体。硅藻土本身主要由不定形二氧化硅组成,化学稳定性高,除溶于氢氟酸以外,不溶于任何强酸,但能溶于强碱溶液。硅藻土表面丰富的Si-OH使得硅藻土表面呈弱酸性,同时硅羟基在水溶液中会离解出H+,使得硅藻土在较宽的范围内呈现负电性[16]。硅藻土表面官能团和反应位点在界面反应中起着关键性作用,不仅控制着表面电荷和表面酸位、溶解性以及亲/疏水性等,同时还是表面接枝及配位与交换反应的主要活性位点,对第二相的表面吸附、负载及后续生长等物理化学过程产生重要的影响,从而强烈影响着硅藻土表面改性及应用性能[17]。

图1 (a~j)几种海洋硅藻的扫描电子显微镜图像。比例尺=10 μm[12]
1.2 硅藻土提纯
由于所处地域和老化条件不同,硅藻土原矿中会包含Al2O3、Fe2O3、CaCO3、CaO、Na2O、MgO和有机质等其他成分,可能会干扰生物医药应用所需的硅藻土的性质,并且工厂在开采、研磨或煅烧(400~900 ℃)除去低品位硅藻土杂质的过程中,难免会破坏硅藻土完整的生物硅结构[18]。对于生物医学应用,既去除原矿中的杂质,又保留硅藻土微胶囊结构是至关重要的。因此,需要对开采的硅藻土原矿矿物进行处理,以去除这些杂质,并将硅藻土净化成具有这些应用所需品质的材料。硅藻土提纯常采用的方法有擦洗法、浮选法、焙烧法、酸浸法及联合提纯法[19]。擦洗法是在硅藻土颗粒磨细后利用水流与矿粒之间的剪切力,使硅藻土外壳杂质得到有效去除,且擦洗次数越多,效果越好,但成本较高且难以获得高品位硅藻土。浮选法虽在硅藻土提纯中应用较少,却能改善硅藻土原矿与脉石矿物因粒度较细而存在的相互夹杂包裹现象,使硅藻土原矿与脉石矿物得到良好的分散。高莹等人采用反浮选法对吉林临江Ⅲ级硅藻土进行提纯试验研究,将SiO2含量由74.58%提高至79.38%,回收率为42.74%,成本较高但还是难以得到较高品质的硅藻土[20]。焙烧法净化可以燃烧杂质,因此需要在高温下煅烧原始硅藻土,过程简单且能有效除去有机杂质。然而硅藻土的煅烧会导致硅藻土结晶块的烧结,当焙烧温度继续升高到1 150 ℃后,硅藻土的微孔结构基本消失并产生具有毒性的结晶二氧化硅,不适合生物医药应用[21]。其次,可以通过酸浸法将硅藻土原矿中的某些可溶性杂质选择性地溶解从而提高硅藻土纯度,并且优化孔隙结构,并且恰当的酸用量不会破坏硅藻土自身结构。但存在用酸量和洗涤用水量较大,因此成本较高且废酸容易造成环境污染。Goren等人探索了酸浸法去除原硅藻土中的杂质,使硅藻土更适于安全的生物医药应用,但存在酸处理耗时长、酸对设备腐蚀严重等缺点[22]。可见单一的提纯方法有利有弊,实践中往往采用两种或两种以上联合的方法,常用的提纯方法有擦洗—酸浸提纯法、超声—碱浸提纯法、擦洗—酸浸—焙烧法等。孙林等人将超声预处理和水热法与传统的酸浸—焙烧工艺相结合,纯化后低品位硅藻土SiO2含量由76.68%提升至94.95%,高品位硅藻土SiO2含量可由83.03%提升至97.12%,回收率可达73.12%,其结构性质也得到了很大的提升[23]。采取粉碎机粉碎硅藻土后使用硫酸和过氧化氢配制的食人鱼刻蚀液和盐酸对硅藻土进行提纯从而产生生物官能化[24-25]。该方法具有净化简单、环境友好、快速处理等优点,为生物医学应用的新型生物工程纳米结构材料提供了思路,被广泛采用。提高硅藻土纯度,确保硅藻土结构的完整性,才能满足生物医药领域对硅藻土的应用要求。
1.3 硅藻土表面改性
硅藻土表面易于修饰,并根据功能使用者的要求,它们可以被专门设计来控制药物通过孔洞的释放,对硅藻土的孔径进行调控,控制药物释放缓慢而延长释放时间,给病人提供保护[26]。硅藻土可以被无机修饰,转变为一种潜在的药物持续释放工具。氧化石墨烯与硅藻土通过静电吸附或硅藻土表面与氧化石墨烯薄片之间的共价键合形成的纳米杂化复合物已经有很多报道。在氧化石墨烯的作用下,硅藻土的载药量增加,药物分子与氧化石墨烯层之间的相互作用得到改善[27]。氧化石墨烯修饰硅藻土能提供持续的药物释放,已证明是非常有效的药物递送应用。相较来说,生物分子通过非共价结合(物理吸附及弱相互作用)和共价结合(功能单体通过化学键与硅藻土基体相互连接),就功能化的稳定性和再现性而言,生物分子与硅藻土表面的共价结合优于非共价结合。因此,利用硅藻土表面的活性硅羟基(SiOH)可轻易地和-NH2、-COOH、-SH和-CHO等反应性基团功能化,用于如酶、蛋白质、抗体、多肽、DNA、核酸适配体等生物分子偶联[28]。Barianaetal等人使用在硅藻土表面功能化含有不同疏水性和亲水性基团的有机基团,成功地改变了硅藻土对两种模型药物的载药量和体外释药性能[29]。结果表明,与未修饰的硅藻土相比,亲水修饰表面(3-氨丙基三乙氧基硅烷、3-缩水甘油氧基丙基三甲氧基硅烷和2-羧乙基膦酸)提高了疏水药物的载药量,延长了药物释放时间;相反,疏水修饰表面(16-膦酰基十六烷酸、甲氧基聚乙二醇和十八烷基三氯硅烷)的载药量更低,释放速度更快。疏水表面(16-膦酰基十六烷酸)有利于提高载药量和缓释量,而亲水修饰(3-氨丙基三乙氧基硅烷和2-羧乙基膦酸)则能降低载药量和缩短释药时间。Cicco等利用硅烷偶联剂的表面活性官能团接枝四甲基哌啶氮氧化物(TEMPO),通过硅烷偶联剂与硅藻土表面的硅羟基发生缩合反应进而接枝于硅藻土表面,研究了TEMPO功能化硅藻土继承了环丙沙星给药和抗氧化特性,已被证明是一种适合成纤维细胞和成骨细胞的材料[30]。Aw等人[31]用两种有机硅烷对硅藻土进行表面改性提供有机表面亲水和疏水性能(图2),调整硅藻土表面功能来实现不同治疗条件下所需的药物负载和释放特性,特别是亲水性功能化增加了载药量,延长了药物的释放时间。疏水修饰则形成了低负载量和药物快速释放。不难看出,对硅藻土表面功能化是一种独特的控制药物从介孔体系中释放的方法,可以调整其载药量和释放特性,从而设计更灵活的生物医药系统,优化治疗性能,提高其医学应用价值。
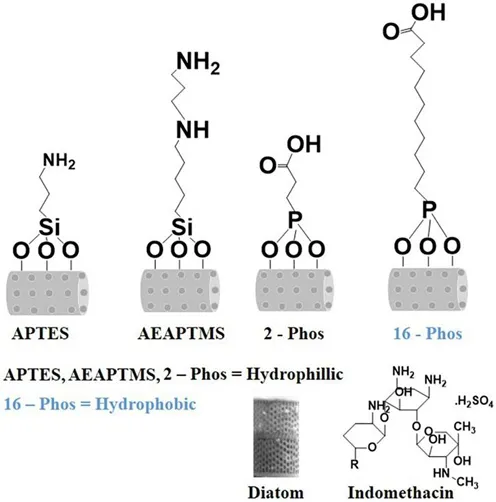
图2 硅藻土结构及其亲疏水化学成分的表面修饰:吲哚美辛作为模型药物[31]
2 硅藻土基微纳米结构的细胞毒性评价
参考国际标准化组织(International Standards Organization,ISO)10993和国家标准GB/T 16886的要求,评价材料的生物相容性遵循生物安全性和生物功能性两个原则,既要求生物材料具有很低的毒性,同时要求生物材料在特定的应用中能够恰当地激发机体相应的功能。美国食品和药物管理局已批准硅藻土为一种安全的生产食品和药品,并且被国际癌症研究机构分为人类致癌物的第三类,即“不对人类有致癌性”[32]。Santos等人于2013年首次描述了用于口服给药应用的硅藻土输送美沙拉胺和泼尼松两种胃肠道疾病处方药在结肠癌细胞(Caco-2/HT-29)中的体外细胞毒性,基于三磷酸腺苷(ATP)活性的细胞活力测定显示,硅藻土微胶囊对结肠癌细胞的低毒性(1 000 g/mL,24 h),证实了硅藻土给药应用的安全性,能够作为口服药物的渗透增强剂,低毒性、增强渗透性和延长药物释放特性,使硅藻土成为治疗胃肠道疾病的有前途的材料[33, 34]。其次,Rea等人采用采用MTT比色法测定硅藻土对表皮样癌细胞(H1355)的体外细胞毒性,MTT检测结果表明,在300 μg/mL的硅藻土纳米粉体作用72 h后,H1355细胞的活力仍未受到影响,从而证实了硅藻土作为纳米药物载体的安全性[35]。

图3 MTT法评价硅藻土的细胞毒性。20、100、200和300 μg/mL硅藻土在37 ℃下处理H1355细胞24、48和72 h后细胞活力的变化。数据代表平均值±标准差(n=3)。细胞存活率以活细胞百分比表示,与无纳米颗粒作为对照培养的细胞(100%)相比[35]
陈西广教授团队研究了壳聚糖改性硅藻土制得复合气凝胶(CDDs-TBA),使用不同浓度气凝胶(10、5、2.5、1.25、0.625 mg/mL)提取液与L929细胞孵育,当孵育时间从24 h延长到72 h时,所有测试浓度的细胞存活率高于94%[36]。类似地,杨鹤等人通过冷冻干燥和离子交联联用的方法制备了一系列掺杂氨基化硅藻土的复合止血海绵CS/SA/ADia,CS/SA/ADia与浸提液共培养的L929细胞可以健康存活,几乎不存在细胞坏死/凋亡的现象,说明制备的硅藻土基止血海绵不影响组织细胞生长和增殖,不会对其形态产生不利影响,具有良好的细胞相容性[37]。与人造多孔结构相比,由于硅藻土在生理pH值下的溶解率较低。在此背景下,Voelker等人[38]进行了体内生物分布研究,评估了组织损伤是否由生物硅藻土结构引起。裸鼠单次静脉注射后,没有小鼠表现出任何明显的急性组织损伤症状,主要器官大脑、心脏、肾脏、肝脏、肺或尾巴没有出现任何异常,表明硅藻土良好的生物相容性。水螅是研究新型纳米材料在全生物水平上的影响和毒理学效应的一个有价值的系统,水螅体对环境中的有机和无机污染物都高度敏感,在大多数污染情况下会导致生长延迟、形态改变、诱导凋亡,甚至基因表达改变。Monica等将淡水无脊椎动物刺胞水螅作为体内试验模型系统暴露于改性硅藻土纳米颗粒在其培养基中长期孵育,从生存力和遗传角度研究了水螅的摄取和毒理学效应。高浓度的硅藻土改性纳米颗粒(最高可达3.5 g/L)不会影响水螅的形态和生长速度,从动物、细胞和分子水平,包括形态学、生长速率、凋亡率和遗传分析清楚地证明了硅藻土的生物安全性[39]。医药工业必须专注于提高硅藻土基药物的生物利用度,需要通过更多的动物模型试验来实现,这必将为治疗致命疾病铺平道路。
3 硅藻土用于药物递送
药物/制药工业面临的主要挑战是将有效浓缩的治疗制剂输送到人体的病变组织,同时对健康组织产生最小的副作用。Morse等人在2000年发现硅藻生物产生的硅藻土表现出纳米结构的遗传控制精度,首次提出利用硅藻土的生物结构来构建新材料的想法[40]。硅藻土的三维多孔结构被认为是其他生物医药功能微纳结构生长的极有价值的天然模板,这些结构是现有制备方法无法制备的,成就了硅藻土在生物医药领域优异的治疗性释放特性,使硅藻土成为药物传递领域的理想材料,并且硅藻土的生物相容性和细胞吸收能力、控制载药与释放的特性可以通过表面修饰来提高。近年来硅藻土在药物递送领域的应用日益增多。
3.1 口服给药硅藻土载体
口服给药是最常见的给药途径,通常限于小分子药物,因为更复杂的药物很容易在胃消化中降解。药物半衰期短,需要持续调控,这反过来又增加了错过药物剂量的可能性,导致患者依从性差。持续给药可以改变给药过程,并产生提供药物效益,例如,一次或多次给药的可控给药。Losic等首次验证了硅藻土作为载药载体在口服给药中的应用,硅藻土对疏水性小分子吲哚美辛的载药量为22%。药物在硅藻土表面吸附,在6 h内出现了快速释放,然后因为硅藻土微孔结构及内部空腔的结构,药物缓慢持续释放超过两周[41]。

图4 硅藻土载药释放机制[41]
Milovic等首次应用固体自乳化磷脂悬浮液(SSEPS)在介孔硅藻土中生成固化口服药物,硅藻土的高度有序多孔体系对制备的SSEPS中卡马西平的释放速率有很大影响[42]。吸附在硅藻土上的SSEPS比纯药物、物理混合物和固体分散乙醇具有更高的溶解速率。以硅藻土为固体载体的SSEPS已成为一种提高低水溶性药物溶出率的新方法,具有提高药物治疗效果和成本效益的潜力,并为晚期治疗提供了新的策略。Jelena通过将硅藻土均匀悬浮在硫酸铝水溶液常温搅拌进行无机功能化。布洛芬被吸附在功能化硅藻土上,载药量达201 mg/g,释放时间延长。在抑制大鼠疼痛方面,与硅藻土复合或物理混合都比同等剂量的布洛芬更有效[43]。化学修饰硅藻土表面的可能性为改善药物的装载及释放特性开辟了道路。Vasani等人通过表面引发原子自由基聚合(ATRP)将热响应性低聚(乙二醇)甲基丙烯酸酯共聚物接枝在其表面,从而获得了改性硅藻土微胶囊,实现了抑菌剂左氧氟沙星的可控药物递送[44]。Sherouk于2021年利用壳聚糖链对硅藻土结构进行功能化改性,以增强其作为药物载体的技术可行性和生物相容性,壳聚糖在复合材料中的比例可控制对布洛芬的释放速率。CS/D复合材料具有强负载能力(562.6 mg/g)以及优异的释放特性,可延长至约200 h,在胃液(pH=1.2)和肠液(pH=7.4)中最大释放率分别为91.5%和97.3%[45]。舌下给药途径是克服吞咽困难、黏膜粘连等口服给药困难的重要给药途径。在2018年,López-Cebral等人报道了β-壳聚糖膜中加入硅藻土制成复合材料,从而实现了舌下应用药物的传递[46]。随着配方中硅藻土百分比的增加,新材料的润湿性增加,促进细胞黏附的表面能值也较高。与纯β-壳聚糖膜相比,硅藻土修饰的β-壳聚糖膜具有更高的负载能力、更长的持续时间和更高的剂量释放。硅藻土对细胞的低毒作用证实了硅藻土作为来源广泛、廉价、生态友好的药物传递材料的潜力。在硅藻土上进行的每一项研究都鼓励了纳米技术和生物医学部门的重大变革的可能性。新型载药载体有望在不久的将来根据其适用性开发出不同的表面功能。
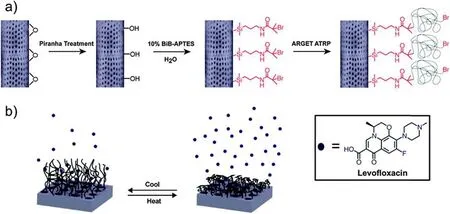
图5 硅藻土微胶囊功能化(a)和热响应聚合物接枝硅藻土的药物释放过程(b)[44]
3.2 硅藻土靶向微载体用于药物递送
在过去的20年中,硅藻土被越来越多的人认为是一种有前途的生物材料工具,用于药物递送应用。硅藻土基药物胶囊已经显示出一种双相模式,既有爆发性也有延长性的释放,这些结果为生物模板给药带来了巨大的希望。硅藻土基药物载体的修饰已经被广泛探索,表1列举了一系列功能化的硅藻土药物载体及其作用。将功能化硅藻土纳入生物活性支架会通过将硅藻土集中输送到损伤部位而显著增强局部输送,可以结合支架来补充药物本身的反应或提供对细胞微环境的刺激,因此在提供双重释放治疗效果方面非常有益。常见的功能化包括表面有机硅烷化、磁性涂层、抗体等方法,可以提高载药效率、持续和可控的药物释放能力,以及靶向给药潜力。
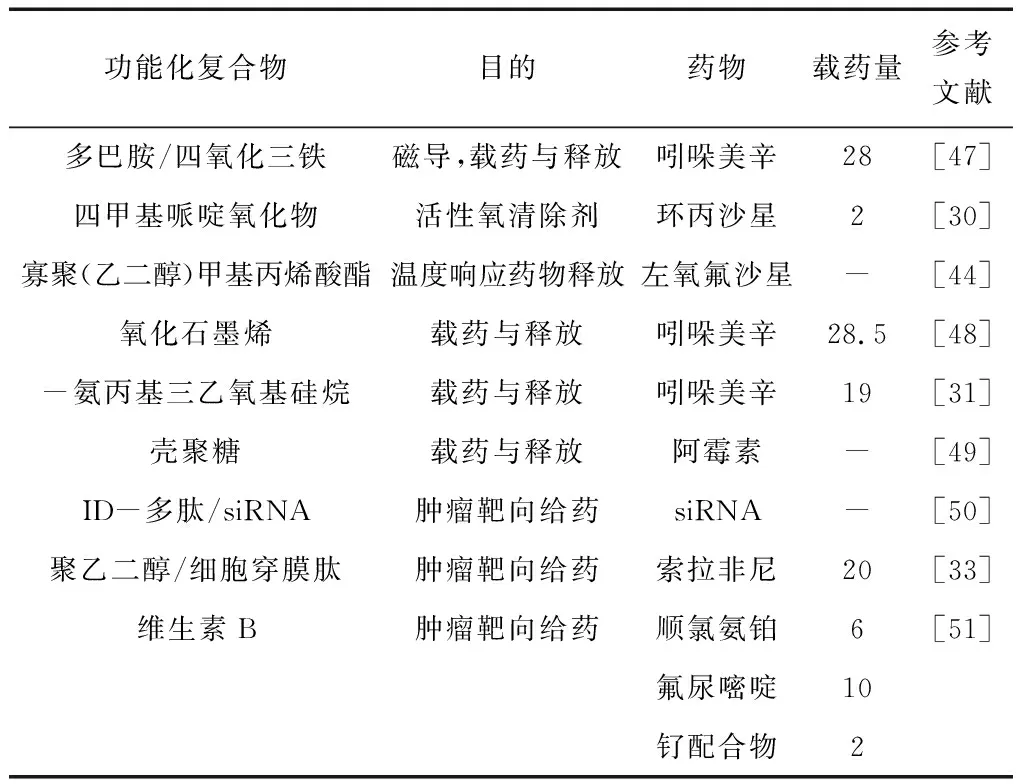
表1 功能化硅藻土载药在药物传递中的应用
基于位点特异性受体介导的药物传递方法,Martucci等人以小干扰RNA(siRNA)和B细胞淋巴瘤/白血病-2基因(Bcl-2)修饰硅藻土。利用表面免疫球蛋白B细胞受体高变区识别的独特型特异性肽,确保淋巴瘤细胞特异性靶向。修饰后的硅藻土无细胞毒性,并通过实时定量聚合酶链反应和免疫印迹分析评估其下调基因表达的有效性[50]。由此观察到的基因沉默具有重要的生物学意义,并为淋巴瘤的个性化治疗开辟了新的可能性。早在2008年,Townley等人报道了硅藻土与不同抗体的复合,使用抗体的氨基或糖基与硅藻土表面结合,证明了硅藻土给药系统在免疫沉淀分析中的潜在应用[52]。Ruggiero等人强调了功能化和尺寸小的硅藻土纳米颗粒可以很好地内化表皮样癌细胞的细胞质中。为此,作者对硅藻土进行了粉碎和超声波处理,使其尺寸减小到纳米级,然后用有机硅烷和四甲基罗丹明异硫氰酸酯作为可追踪物质进行功能化。这些纳米颗粒的共聚焦显微镜成像显示,它们能很好地内化到表皮样癌细胞的细胞质中,增强硅藻土在抗癌递送应用中的潜力[53]。2017年,Grommersch等报道了一种NO释放分子S-亚硝基-N-乙酰青霉胺(SNAP)修饰的硅藻土。化学发光定量法证实了SNAP-DE材料可在24 h内维持NO释放的能力。在金黄色葡萄球菌上测试时,SNAP-DE显示出抗菌活性,对金黄色葡萄球菌的杀灭率为92.95%。此外,对3T3小鼠成纤维细胞的体外细胞毒性试验表明,SNAP-DE对哺乳动物细胞无毒性,使其成为一种有前景的生物医学应用材料[54]。继Losic和同事报道了多巴胺铁氧化物(DOPA/Fe3O4)复合物对硅藻土的磁性功能化药物递送后,2013年Todd和他的同事报道了磁导硅藻土的制造,将人血清白蛋白(HSA)包覆的氧化铁纳米颗粒(IONPs)负载到硅藻土上,使其具有磁性,当磁场作用于肿瘤部位时,观察到明显的肿瘤保留改善。将zw800-IONP-DTMs静脉注射于4T1异种移植瘤1 h后,试验表明在磁处理组感兴趣区域分析中有特异性肿瘤聚集。在解剖肿瘤的体外荧光成像后,IONP-DTMs在磁处理动物体内的积累量增加了6.4倍[55]。这些结果表明磁性导向硅藻土微载体在药物递送应用中的潜在用途,可通过磁性引导来实现靶向药物递送。

图6 活体成像结果(上排),与MRI数据相关,在附磁铁的肿瘤中观察到明显更多的荧光信号,(下排)解剖肿瘤的体外成像,与对照组相比,在被磁铁吸附的肿瘤中,硅藻土的积累量增加了6.4倍[55]
Delalat等人为了克服抗体在有机溶剂中的变性问题,将药物以脂质体或胶束的形式负载在带正电荷的纳米胶囊中,然后吸附在带负电荷的硅藻土表面。释放研究表明,在培养基中释放的有效药物剂量超过规定要求,表明有杀死目标细胞的潜力。体外试验证明了载药硅藻土选择性杀死神经母细胞瘤细胞,而对照细胞在体外仍保持高度活性,对神经母细胞瘤细胞(2天后只有10%存活)的特异性细胞毒性,以B淋巴瘤细胞作为对照(2 d后95%存活)。在神经母细胞瘤的皮下小鼠异种移植模型中,使用硅藻土治疗可致使肿瘤生长退化。这些数据表明,硅藻土可用于靶向地将低水溶性抗癌药物输送到肿瘤部位[38]。Maher等人报道了硅藻土到单质硅的镁热还原过程[56],这个过程将材料的比表面积提高了13倍,柔红霉素体外研究结果显示其释放时间延长且持续时间长达30 d,可用于预防增殖性玻璃体视网膜病变。此外,与硅藻土相比,硅单质体表现出更高的生物降解性。在磷酸缓冲盐溶液缓冲液中,同样的时间后,20%的硅单质体被溶解,而降解的硅藻土不到1%。临床给药上,一个好的药物载体系统应该溶解或降解为无毒成分,硅藻土转化为生物可降解的微载体表明其作为药物传递载体的潜质[57]。
硅藻土被认为是合成二氧化硅的优质替代品,有望成为一种强大而稳定的药物传递载体。无论是口服或植入药物,以上研究证实了这种特殊物质的药物传递能力。然而,硅藻土是由无定形二氧化硅组成,在生物流体中生物降解性很差,这导致硅藻土颗粒在生物体内的积累,特别是在器官反复给药的情况下。如何将硅藻土转化为生物可降解的微载体作为下一代智能给药系统,具有进一步探索的潜力。此外,大量系统给药的靶向给药系统在达到目标前被吞噬系统清除,增加了带来意外急性或慢性毒性的可能性[58]。更多的研究需要回答硅藻土作为一种新的药物载体用于临床应用的生物学问题,如疗效,使用动物和临床前模型的体内条件下的生物相容性。这些试验不仅将证明硅藻土的巨大潜力,而且还将拓宽硅藻土的医药应用范围。
4 硅藻土基止血材料
不可控出血是创伤患者死亡的首要原因,每年有6 000万人遭受严重创伤,不可控出血死亡率高达10%[59-60]。无机材料如介孔二氧化硅、沸石、高岭土等具有止血效果好、安全性好、使用方便等优点,在创伤急救中表现出明显的止血优势,但是组织热损伤和异物反应等副作用限制了其发展[61]。硅藻土具有独特的孔结构、高的比表面积、可调节的孔径、热稳定性、化学惰性和优异的生物相容性,与沸石和黏土类止血材料相比,硅藻土的层次性多孔结构使其具有较大的比表面积和孔隙度,使其能够快速吸收血浆,并与红细胞、血小板等血液成分产生强烈的界面效应[62-63]。基于这一发现,冯超等人于2020年以多巴胺为交联剂,采用碱沉淀法和叔丁醇置换法制备了一种壳聚糖/硅藻土气凝胶。壳聚糖/硅藻土气凝胶具有良好的生物相容性和纳米至微米级的多级多孔结构,可通过叔丁醇浓度进行控制。30%叔丁醇置换气凝胶具有最大的比表面积(74.441 m2/g)、吸水量(316.83±2.04%)和优异的体外凝血性能(凝血时间70 s),且在大鼠出血模型中凝血时间最短、失血量最低。气凝胶与血液之间具有很强的界面效应,能够促进红细胞聚集、血小板黏附、活化,激活血液固有凝血途径,加速血液凝固[36]。因为遗传或慢性疾病,患有凝血病如血友病或糖尿病的患者血液不能有效凝固,因此控制表面超血亲性是特别重要的[64]。Haeshin等人报道了硅藻土的超亲水性甚至超血亲性可以显著激活内在通路,加速血液凝固[63]。不幸的是,未经任何修饰的硅藻土由于高密度硅醇阴离子与红细胞膜之间强烈的界面相互作用而具有较差的生物相容性。同时,由于与组织创面缺乏粘连,硅藻土容易被创面处血压高的血流分散,导致止血失败。冯超等人通过氧化自聚合的方法在硅藻土表面修饰一层薄薄的聚多巴胺。聚多巴胺涂层可以改变硅藻土的界面特性,改善血小板和红细胞的黏附。在装载一种将纤维蛋白原转化为纤维蛋白形成血凝块的蛋白质凝血酶后得到DA-diatom-T复合材料,该材料表现出强大的多种止血作用,包括组织黏附、血小板激活、纤维蛋白网络原位快速激活和伤口物理屏障的形成[65]。
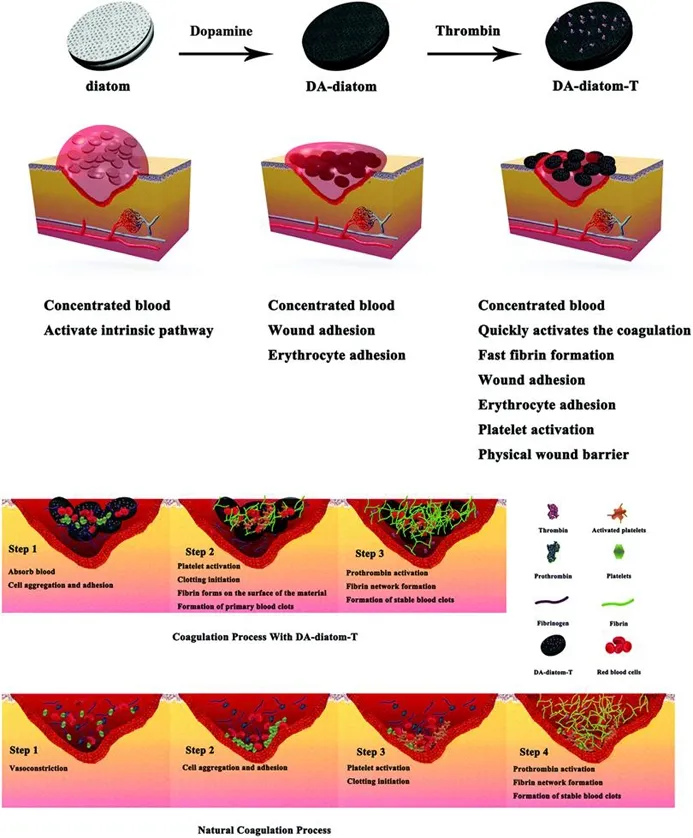
图7 DA-diatom-T的设计,凝固工艺,自然凝固过程[65]
单一的止血粉末具有穿过伤口进入人体引发不稳定血栓的安全问题。冯超等人进而进行了深入的研究,提出以壳聚糖、多巴胺和硅藻土为原料,采用碱化沉淀法制备了多功能壳聚糖/多巴胺硅藻土复合微球(CDDs)。CDDs的直径约为15 mm,可避免小颗粒随血流扩散到正常血管的潜在栓塞风险[66]。并且制备了以羟丁基壳聚糖和烷基化壳聚糖分别与硅藻土为基质的复合海绵,用于止血。硅藻土的加入使得原有海绵能够激活固有凝血通路,加速凝血效果。同时,硅藻土的加入增加了复合海绵的孔隙率。结合壳聚糖的引流作用,使复合海绵内部结构与血液充分接触,止血更快。体外凝血试验表明,硅藻土基复合海绵能提供较强的界面效应,诱导红细胞吸收聚集,激活凝血级联反应,加速血液凝固[67-68]。硅藻土结构可以浓缩凝血因子促进凝血反应发生,其表面的丰富硅羟基能够促进内源性凝血,在体内和体外均显示出优秀的止血效果。遗憾的是,目前尚缺乏制备具有良好生物相容性和止血性能的硅藻土基止血材料的更多研究。只有依据生物体内外出血机制,经过材料学、医学、药剂学等多学科交叉,才能将更多的基础研究转化为临床使用,造福生物医学事业。
5 基于硅藻土的其他生物医药应用
硅在骨形成和维持、改善成骨细胞功能和诱导矿化等方面发挥着重要作用。通常,骨变形和长骨异常与硅缺乏有关。硅藻土是硅藻骨架的天然沉积物,是一种廉价而丰富的生物硅来源。Alvarez等以硅藻土为硅源,研究硅取代羟基磷灰石涂层对成骨细胞样SaOs-2细胞系的影响。体外研究表明,与合成二氧化硅制备的涂层相比,硅取代羟基磷灰石涂层显著促进成骨细胞增殖和活性[69]。Hertz等人利用助熔剂煅烧硅藻土制备多孔SiO2和SiO2/TiO2单体,发现仅含SiO2的样品被证明对骨组织工程具有生物相容性[70]。Le等人研究了硅藻土颗粒作为骨组织工程硅供体材料的潜力,提纯的硅藻土微颗粒(MPs)和纳米颗粒(NPs)显示有限或无细胞毒性作用。硅藻土释硅动力学表现为先快速释硅,后随孵育时间增加释硅速率降低。特别是在最初的4 d里,硅的释放值从最终值的87%到92%不等[71]。Tamburaci等人使用硅藻土作为增强剂克服聚合物与骨力学不相容的情况,用于硬组织工程以帮助骨再生[72-74]。以硅藻土和壳聚糖为材料制备了一种新型的骨组织再生膜,结果表明,硅藻土的加入提高了膜的表面粗糙度、溶胀能力和拉伸模量。加入10%硅藻土的壳聚糖复合膜比不含硅藻土的壳聚糖复合膜的杨氏模量提高了约52%。另外间接提取法可获得较高的细胞活力。体外细胞增殖和碱性磷酸酶活性测试结果表明,硅藻土的加入显著提高了壳聚糖膜培养Saos-2的细胞的碱性磷酸酶活性。该新型硅藻土复合膜具有较好的生物相容性,可作为骨组织工程应用的支架材料,具有较强的物理化学性能和生物活性。细胞毒性、增殖、碱性磷酸酶活性、骨钙素生产和生物矿化的体外研究,证明了天然硅藻土颗粒在骨再生中的前景。在成骨培养基中,硅藻土纳米复合支架未表现出任何细胞毒性作用,并增强了表面矿化。因此,在硬组织工程应用中,硅藻土是一种潜在的用于纳米复合材料的增强材料。
硅藻土用于生物传感的光学和光子特性是众所周知的。De Stefano等人[75]研究表明,硅藻土可以作为合适的光学生物传感器,具有显著的灵敏度和多细节层次(LOD)。这些创新系统可作为表面增强拉曼(SERS)免疫分析检测人血浆中白细胞介素8应用的有吸引力的替代品。Kamińska等人构建了金纳米,将其集成到硅藻土基超灵敏表面增强拉曼光谱(SERS)免疫分析中,用于检测人血液中的白细胞介素8(IL-8)[76]。硅藻土用于生产具有增强荧光光谱和成像特性的超灵敏免疫检测生物传感器,具有点对点的优势,对生物传感应用具有吸引力。硅藻土作为片上色谱基质具有流体特性,同时,硅藻土光子晶体效应能增强金属纳米粒子的等离子共振,可用于SERS生物传感。电浆子纳米颗粒装饰的硅藻土生物传感器可以从混合样品中分离和检测小分子,检测灵敏度高达1 μg/g,比商用硅胶色谱板提高了10倍以上。在10 μg/g和5 μmol/L的LOD下实现了人血浆中苯乙胺和脱氧核糖核酸的多重传感。[77]。这种利用电浆子硅藻土混合的简易片上实验室装置证明了自身的成本效益和超敏感,具有多重传感能力,将在复杂环境中的污染物和毒素以及筛选生物流体中的非法药物监测方面发挥关键作用。对多孔介质微流体(如基于微流控纸的分析设备)不断升级的研究兴趣,催生了一种用于即时诊断和生物传感的新生物医学设备。Kong等人将硅藻土在400×30 μm的常规玻片上通过旋涂和胶带剥离法制备,从复杂的生物流体样品中分离小分子,并获得具有高特异性的目标化学物质的表面增强拉曼散射光谱。由于硅藻土微流控通道的超小尺寸和硅藻土锥柱的光子晶体效应,当从拉曼染料混合样品中检测芘(1 μg/kg)和从人血浆中检测可卡因(10 μg/kg)时,表现出前所未有的灵敏度,灵敏度可提高至十亿分之一(μg/kg)水平[78]。这项开创性的工作证明了硅藻土用于新兴的化学和生物医学传感微流控设备的独特优势,特别是在POC药物筛选方面。
6 结论
硅藻土生物纳米技术是一个新的跨学科领域,硅藻土作为合成多孔硅和其他人工材料的低成本替代品,为未来智能药物制备的生物应用提供了巨大可能。硅藻土具备的独特三维层次性多孔结构、高表面积、无毒副作用,易于表面化学改性以及高化学稳定性、特异性光学和光致发光特性,成就了其新型低成本的生物医学应用材料的无限潜力。
预计在不久的将来,人们可以通过调整硅藻土独特的表面性质来设计新的具有成本效益的生物医药系统,满足在药物医药商业化领域的巨大需求。尽管硅藻土已许可用于食品工业和农业,但在制药工业和医药中作为添加剂和药物载体的使用尚未获得官方批准。因此,在研究硅藻土作为临床应用所需的新型药物给药载体的生物反应方面,还有大量的工作要做,需要对硅藻土在体内动物模型上的长期安全性进行进一步的研究。目前也仍有许多未解之谜,如硅藻基因型与表型之间的关联,硅藻土藻凸是如何形成的?生物硅如何形成硅藻土的形状/大小或模式、遗传特征?所有这些问题都需要研究人员的有效回答,以证明硅藻土作为高效生物医药应用系统的适用性。大量的体外和体内研究证明了硅藻土基复合材料的生物相容性和低细胞毒性,这种独特的生物材料具有强大的生物医学应用潜力。虽然目前对硅藻土在生物医药各个领域的研究并不完善,但在不远的将来硅藻土医药应用的商业化可能终将成为现实。

