蔗糖异构酶PalⅠ-Cu2+纳米花固定化酶的制备及其结构、性能分析
孟虹,赵怡,李宪臻,李蓉
大连工业大学生物工程学院,辽宁大连116000
异麦芽酮糖(α-D-glucosylpyranosyl-1,6-D-fructofranose)是蔗糖的一种同分异构体,其物理性质与蔗糖相似,由于其能以缓慢的速率将葡萄糖释放于血液中,避免人体血糖突然上升及下降,对人体机制具有保护作用,因此被广泛应用于食品工业,是目前较受欢迎的甜味剂[1]。蔗糖异构酶是一种高效的将蔗糖转换成异麦芽酮糖的生物酶试剂,其高效专一,转化效率高,但利用游离的蔗糖异构酶作用时,其易失活、不稳定、难以重复利用及效率低[2-3]。因此,一般选用将蔗糖异构酶进行固定化来解决这一问题。酶的固定化方法较多,主要有物理及化学法[4-5],传统的固定化方法虽可提高酶的稳定性,但往往会导致酶活性的降低。
近年来,酶的固定化载体材料已逐渐由高分子材料转向纳米材料[6-7],因纳米材料拥有较大的表面积及巨大的空间结构,增加了酶的装载量,利于酶与底物充分接触反应,从而提高了游离酶的稳定性[8],却不对游离酶的活性造成损失[9-10]。目前,纳米花型固定化方法受到广泛关注[11]。有文献表明,利用含Cu2+的无机物与蛋白质杂化形成的纳米花,可提高游离酶的稳定性及效率[12]。
本实验以蔗糖异构酶PalⅠ结合Cu2+制备纳米花固定化酶(简称蔗糖异构酶PalⅠ-Cu2+纳米花),优化制备条件,通过扫描电子显微镜(scanning electron microscope,SEM)及透射电子显微镜(transmission electron microscope,TEM)观察纳米花固定化酶的形态结构,并分析其稳定性及重复利用性。
1 材料与方法
1.1 菌株 重组表达菌株pET28a-PalⅠE.coliBL21(DE3)[其中蔗糖异构酶PalⅠ(NCBI accession number AAK82938)来源于Klebsiella sp.LX3 菌株]及pET28a/E.coliBL21 由大连工业大学生物催化技术国家地方联合工程实验室构建保存。
1.2 主要试剂及仪器 IPTG、卡那霉素、LB 培养基、Q 柱及Ni 柱均购自生工生物工程(上海)股份有限公司;蔗糖、葡萄糖及3,5-二硝基水杨酸均购自天津科密欧化学试剂有限责任公司;无水硫酸铜购自北京百灵威科技有限公司;SpectraMax Paradigm 型酶标仪购自美谷分子仪器(上海)有限公司;JSM 6460扫描电子显微镜及JEM 2100 透射电子显微镜购自日本电子株式会社。
1.3 蔗糖异构酶PalⅠ的重组表达及纯化 将pET28a-PalⅠ-E.coliBL21(DE3)重组菌接种于含50 μg / mL卡那霉素的LB 培养基中,37 ℃,200 r / min 振荡培养至A600为0.6 ~0.8 时,加入终浓度0.5 mmol /L IPTG,16 ℃,200 r/min 振荡诱导16 ~20 h;8 601×g离心10 min 收菌,进行超声破碎,15 428 ×g离心20 min,获得蔗糖异构酶PalⅠ粗酶液;通过Q 柱及Ni 柱纯化蔗糖异构酶PalⅠ。各产物进行12% SDSPAGE 分析,以pET28a /E.coliBL21 为对照。
1.4 蔗糖异构酶PalⅠ-C u2+纳米花的制备及条件优化
1.4.1 制备 1.6 mg 蔗糖异构酶PalⅠ溶于2 mL 10 mmol/L 磷酸盐缓冲溶液,摇匀后滴入120 mmol/L无水硫酸铜溶液100 μL,掁荡混匀,静置反应,用缓冲液洗涤3 次,13 440 ×g离心10 min,收集沉淀,测定蔗糖异构酶PalⅠ-Cu2+纳米花蛋白含量及酶活性。
1.4.2 磷酸盐缓冲溶液pH 的优化 磷酸盐缓冲溶液的pH 分别设为6.0、7.4、8.0 及9.0,按1.4.1 项制备,确定最适pH。
1.4.3 制备时间的优化 制备时间分别设为12、24、48、72 及120 h,按1.4.1 项制备,确定最适制备时间。
1.4.4 制备温度的优化 制备温度分别设为4 及25 ℃,按1.4.1 项制备,确定最适制备温度。
1.5 蔗糖异构酶PalⅠ-C u2+纳米花的结构表征 以最适条件制备获得的蔗糖异构酶PalⅠ-Cu2+纳米花通过真空冷冻干燥,收集样品均匀涂布于载玻片上,通过SEM 观察其形貌及结构特征。另取适量蔗糖异构酶PalⅠ-Cu2+纳米花粉末悬浮于无水乙醇中混匀,取2~3 滴于铜膜上,待液体完全挥发后通过TEM观察单一纳米花的花瓣结构。
1.6 蔗糖异构酶PalⅠ-C u2+纳米花稳定性的检测 将游离的蔗糖异构酶PalⅠ及蔗糖异构酶PalⅠ-Cu2+纳米花分别保存于pH 7.4 的磷酸缓冲液中,置4 ℃冰箱中储存3、6、9、12 及15 d,分别测定其酶活性。
1.7 蔗糖异构酶PalⅠ-C u2+纳米花循环利用的检测将制备的蔗糖异构酶PalⅠ-Cu2+纳米花于37 ℃催化2%蔗糖反应2 h,测定的酶活性设为100%,回收蔗糖异构酶PalⅠI-Cu2+纳米花,洗涤3 次,去除纳米花表面残留的底物蔗糖及产物异麦芽酮糖,重复催化反应5 次,比较其酶活性变化。
1.8 酶活性测定 将蔗糖异构酶PalⅠ100 μL(或蔗糖异构酶PalⅠ-Cu2+纳米花0.016 mg)与200 μL 2%的蔗糖及1 700 μL 缓冲液组成2 mL 反应体系,于37 ℃反应2 h,使用3,5-二硝基水杨酸比色定糖法(DNS 法)检测反应后产生的还原糖量,并根据还原糖量检测蔗糖异构酶PalⅠ或PalⅠ-Cu2+纳米花酶活性。酶活性以1 min 内转化生成1 μmol / L 还原糖所需的酶量为1 U。
2 结 果
2.1 蔗糖异构酶PalⅠ的鉴定 经12%SDS-PAGE 分析,蔗糖异构酶PalⅠ粗酶液经Q 柱及Ni 柱纯化后,在相对分子质量约66 000 处均可见1 条明显的目标条带,大小与预期一致,见图1。表明蔗糖异构酶PalⅠ表达正确。
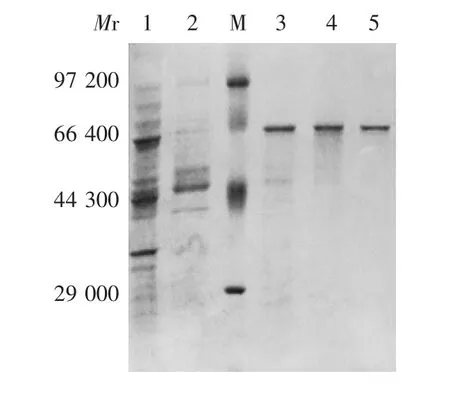
图1 蔗糖异构酶PalⅠ的SDS-PAGE 分析Fig.1 SDS-PAGE profile of sucrose isomerase PalⅠ
2.2 蔗糖异构酶PalⅠ-C u2+纳米花的最适制备条件
2.2.1 磷酸盐缓冲溶液pH 磷酸盐缓冲溶液pH 为7.4 时,蔗糖异构酶PalⅠ-Cu2+纳米花的酶活性最高,当pH >8.0 后,其酶活性显著降低至失活,见图2。选择7.4 为最适pH 值。

图2 磷酸盐缓冲溶液pH 对蔗糖异构酶PalⅠ-Cu2+纳米花酶活性的影响Fig.2 Effect of pH value of phosphate buffer on enzyme activity of sucrose isomerase PalⅠ-Cu2+nanoflower
2.2.2 制备时间 随制备时间(12 ~48 h)逐渐增加,蔗糖异构酶PalⅠ-Cu2+纳米花的酶活性逐渐升高并在48 h 时达峰值,制备时间的继续增加,酶活性明显下降,但仍保持在90%以上,见图3。选择48 h 为最适制备时间。
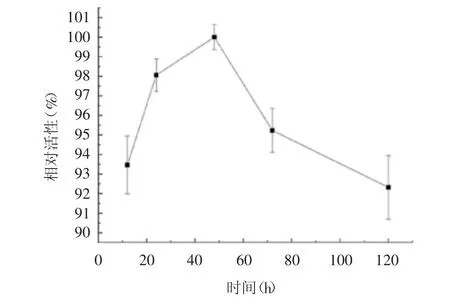
图3 制备时间对蔗糖异构酶PalⅠ-Cu2+纳米花酶活性的影响Fig.3 Effect of time for preparation on enzyme activity of sucrose isomerase PalⅠ-Cu2+nanoflower
2.2.3 制备温度 4 ℃制备的蔗糖异构酶PalⅠ-Cu2+纳米花的活性高于25 ℃下制备的PalⅠ-Cu2+纳米花,表明于4 ℃反应其稳定性更高,见图4。选择4 ℃为最适制备温度。

图4 制备温度对蔗糖异构酶PalⅠ-Cu2+纳米花的影响Fig.4 Effect of temperature on enzyme activity of sucrose isomerase PalⅠ-Cu2+nanoflower
2.3 蔗糖异构酶PalⅠ-C u2+纳米花的结构表征 SEM观察显示,蔗糖异构酶PalⅠ-Cu2+纳米花具有多级结构,组成纳米花的花瓣紧实周密,其形成的球型结构均匀、分散性良好,每个球形结构既独立又集中,见图5。TEM 观察显示,形成纳米花的花瓣细腻饱满,呈丝绸状,每朵花瓣间紧密附着,形成1 个聚集体,边缘整齐明显,见图6。

图5 蔗糖异构酶PalⅠ-Cu2+纳米花结构的20 000 倍(A)及10 000 倍(B)SEM 观察Fig.5 Structure of sucrose isomerase PalⅠ-Cu2+ nanoflower under SEM at magnifications 20 000(A)and 10 000(B)

图6 蔗糖异构酶PalⅠ-Cu2+纳米花结构的TEM 观察Fig.6 Structure of sucrose isomerase PalⅠ-Cu2+ nanoflower under TEM
2.4 蔗糖异构酶PalⅠ-C u2+纳米花的稳定性 结果显示,游离的蔗糖异构酶PalⅠ于4 ℃放置6 d 后仅余50%的酶活性,9 d 后已基本失活;蔗糖异构酶PalⅠ-Cu2+纳米花的酶活性随放置时间的延长,活性有小幅度的下降,15 d 后酶活性仍保留80%的初始活性。见图7。表明纳米花结构明显提高了酶的稳定性。

图7 游离的蔗糖异构酶PalⅠ及蔗糖异构酶PalⅠ-Cu2+纳米花的稳定性Fig.7 Stabilities of free sucrose isomerase and sucrose isomerase PalⅠ-Cu2+nanoflower
2.5 蔗糖异构酶PalⅠ-C u2+纳米花的循环利用性 蔗糖异构酶PalⅠ-Cu2+纳米花循环利用1 次后,其酶活性降低至初始酶活性的60%,之后的酶活性降低趋于稳定,循环6 次后,酶活性仍余40%,见图8。提示其具有较好的循环性能。

图8 蔗糖异构酶PalⅠ-Cu2+纳米花的循环利用Fig.8 Cyclic utilization of sucrose isomerase PalⅠ-Cu2+nanoflower
3 讨 论
Cu2+在滴加至磷酸缓冲液时会逐步形成花瓣聚集状的纳米花骨架。本实验通过向含有蔗糖异构酶PalⅠ磷酸盐缓冲液中滴加Cu2+制备获得杂化蔗糖异构酶PalⅠ-Cu2+纳米花。在最适的制备条件下,蔗糖异构酶PalⅠ酶分子均匀分布于溶液中,在纳米骨架生成过程中,花瓣状的结构可显著增加表面积,即可将更多的游离蔗糖异构酶PalⅠ酶包裹进去,提高了蔗糖异构酶PalⅠ的固定化率,也对酶起保护作用,使其免受外界因素的干扰,增加了酶的稳定性。
通过对蔗糖异构酶PalⅠ-Cu2+纳米花进行SEM 及TEM 观察表征,显示其为单一的、花瓣紧实的球形结构。与游离蔗糖异构酶PalⅠ相比,蔗糖异构酶PalⅠ-Cu2+纳米花结构具有更高储存稳定性及重复利用性,大大的提高了蔗糖异构酶PalⅠ的循环利用率。
本研究表明,利用金属离子制备纳米花技术作为新型固定化技术拥有良好的稳定性、实用性及高效性。在固定化酶领域中有无限的潜能,具有广泛的发展前景。

