miR-122-5p通过靶向CREB1抑制食管癌细胞及移植瘤的生长
福建医科大学附属泉州第一医院胸外科,福建 泉州 362000
食管癌是上消化道常见的癌症之一,也是全球癌症相关死亡率的第6大主要原因。食管癌患者的常规临床治疗包括手术、放疗和化疗[1]。尽管近年来改良了治疗技术,但食管癌患者的总体5年生存率仍仅为20%~30%[2]。因此,了解食管癌发病的分子机制,对于发现更多的肿瘤特异性生物标志物和治疗靶点,进行早期诊断和治疗具有重要意义。miRNA是一类高度保守的、非编码的18~25个核苷酸的RNA,在转录后水平上起负调控基因表达的作用[3]。miRNA依赖于其靶基因,通过影响肿瘤细胞的增殖、迁移、凋亡、分化和代谢,既可以作为癌基因,也可以作为抑癌基因。miR-122在胃癌、卵巢癌等肿瘤中发挥抑癌作用,抑制肿瘤细胞的增殖、迁移和侵袭等[4-5];而在肾癌、三阴性乳腺癌等多种肿瘤中发挥致癌作用,促进肿瘤细胞增殖、迁移和侵袭等[6-7];但是miR-122-5p对食管癌细胞的作用尚不清楚。已有研究[8]表明,cAMP反应元件结合蛋白1(cAMP response element-binding protein 1,CREB1)在食管鳞状细胞癌组织中过表达,与患者的淋巴结转移和肿瘤淋巴结转移阶段呈正相关。本文主要研究miR-122-5p通过靶向CREB1对食管癌细胞及移植瘤的生长的作用及机制。
1 材料和方法
1.1 材料
1.1.1 主要试剂及仪器
RPMI-1640培养基购自上海慧颖生物科技有限公司(货号:C21700500BT),miR-NC、pc-NC、miR122-5p mimic、pc-CREB1质粒和实验所用各种引物由生工生物工程(上海)股份有限公司设计并合成,MTT试剂盒购自上海歌凡生物科技有限公司(货号:GM01-500T),胎牛血清、青霉素和链霉素双抗溶液购自上海素尔生物科技有限公司(货号:16000-044、15140122),miRNeasy试剂盒购自南京新科元生物技术有限公司(货号:217004),SYBR-Green聚合酶链反应(polymerase chain reaction,PCR)试剂盒购自美国Thermo Fisher Scientific公司(货号:4309155),cDNA反转录试剂盒购自上海捷瑞生物工程有限公司(货号:GK8030-20),BCA试剂盒购自上海易色医疗科技有限公司(货号:BC201),辣根过氧化物酶标记的山羊抗兔二抗、Ki-67、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、活化胱天蛋白酶-3、Bax、Bcl-2、CREB1兔来源的单克隆抗体购自艾博抗(上海)贸易有限公司(货号:ab36151、ab92742、ab18197、ab2302、ab32503、ab182858、ab32515),LipofectamineTM2000转染试剂购自上海恪敏生物科技有限公司(货号:11668-027)。裸鼠购自四川夏派森医药科技有限公司[许可证:SYXK(川)2017-203]。Nano-Drop分光光度计购自美国Thermo Fisher Scientific公司,FACSCalibur流式细胞仪购自美国BD公司,FluorChem HD2凝胶成像系统购自美国ProteinSimple公司。
1.1.2 细胞及培养
人正常食管细胞HEEC和食管癌细胞系(EC18、EC109、EC9706、Kyse520、Kyse140、HKESC1)均购自上海素尔生物科技有限公司,所有细胞在含体积分数为10%胎牛血清、100 U/mL的青霉素和100 μg/mL的链霉素的RPMI-1640培养基中,于温度为37 ℃、CO2体积分数为5%的条件下培养。
1.1.3 组织样品
选取2017年11月—2019年11月于福建医科大学附属泉州第一医院行肿瘤瘤切除术后保存在液氮中的食管癌及相应癌旁正常组织(距癌边缘3~5 cm)标本43例。其中男性28例,女性15例,年龄35~71岁;按照美国癌症联合会TNM分期,Ⅰ期3例,Ⅱ期25例,Ⅲ期11例,Ⅳ期4例。所有患者术前均未接受化疗和放疗,且经术后病理学检查证实为原发性食管癌。该研究得到福建医科大学附属泉州第一医院研究伦理委员会批准,并根据《赫尔辛基宣言》的道德准则进行,且该实验获得患者的同意并签订知情同意书。
1.2 方法
1.2.1 实时荧光定量PCR(real-time fluorescence quantitative PCR,RTFQ-PCR)检测miR-122-5p和CREB1 mRNA的表达[9]
使用miRNeasy试剂盒从食管癌组织和细胞系中提取总RNA,并用Nano-Drop分光光度计测量RNA质量和浓度。用PrimeScript RT Master Mix Kit将mRNA反转录为cDNA,并按SYBR-Green PCR试剂盒说明扩增并检测mRNA。miR-122-5p的循环条件:94 ℃ 30 s,59 ℃ 30 s,共35个循环,用U6标准化。CREB1的循环条件为:95 ℃15 s,60 ℃ 60 s,共40个循环,用U6标准化。每个样品进行3次重复分析。使用2-ΔΔCt方法计算。miR-122-5p的上游引物序列:5’-CCGCTCGAG TTCGTGGCTACAGAGTTT-3’,下游引物序列:5’-CCGGAATTCTTTATCGAGGGAAGGAT T-3’;CREB1的上游引物序列:5’-CGCGGAT CCAAATGGACTGGCTTGG-3’,下游引物序列:5’-CGGAATTCTGCCCTATGGAAGAGC TG-3’;U6的上游引物序列:5’-GCTTCGGCA GCACATATACTAAAAT-3’,下游引物序列:5’-CGCTTCACGAATTTGCGTGTCAT-3’。
1.2.2 细胞分组及转染
将细胞分为对照组、miR-NC组、pc-NC组、miR-122-5p mimic组、pc-CREB1组、miR-122-5p mimic+pc-CREB1组。取对数生长期细胞,接种于6孔板(1×106个/孔)上。当达到80%融合时,根据LipofectamineTM2000说明书将100 nmol/L的miR-NC、pc-NC、miR-122-5p mimic、pc-CREB1质粒分别或联合转染进入EC109细胞中。
1.2.3 双萤光素酶报告基因实验分析靶向关系[5]
将EC109细胞接种在24孔板上,并温育24 h。将1 μg萤火虫萤光素酶报告基因构建体PGL3-CREB1-WT(CREB1野生型)或PGL3-CREB1-MUT(CREB1突变型)以及miR-122-5p mimic或mimic-NC和PRL-CMV海肾萤光素酶报告质粒转染细胞,转染48 h后,EC109细胞裂解15 min,采用双萤光素酶检测系统测量萤光素酶的相对活性,用萤火虫萤光素酶活性和海肾萤光素酶活性比值表示萤光素酶的相对活性。
1.2.4 MTT法检测细胞增殖情况[9]
取1.2.2处理的细胞,将每组2 000个细胞接种在含有150 μL培养基的96孔板上。在不同的培养时间(24、48、72 h)后,向每个孔中添加20 μL MTT底物(5 mg/mL),并将板再温育4 h。然后除去培养基,并将细胞溶解在150 μL的二甲基亚砜中。然后将培养板摇动15 min,并在490 nm处读取吸光度(D)值。
1.2.5 克隆形成实验检测细胞生长能力[5]
将细胞接种于6孔板(1×106个/孔)上,直到生长至可见菌落。用甲醇溶液固定菌落,0.25%结晶紫染色30 min,计算菌落数量。
1.2.6 流式细胞术检测细胞凋亡率[9]
取1.2.2处理的细胞培养24 h后,离心收集细胞,并按1×106个/mL的浓度重悬。细胞悬液中加入5 μL Annexin Ⅴ-FITC和碘化丙啶(propidium iodide,PI),避光温育15 min,然后用流式细胞仪分析细胞凋亡率。
1.2.7 蛋白质印迹法(Western blot)检测Ki-67、PCNA、活化胱天蛋白酶-3、Bax、Bcl-2、CREB1蛋白的相对表达水平[9]
取1.2.2处理的细胞,用RIPA裂解液提取总蛋白,并用BCA试剂盒检测蛋白浓度,然后经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白后,用半干转膜仪转移蛋白质至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,并用脱脂牛奶室温封闭蛋白2 h,再加入兔来源的单克隆一抗[Ki-67 1∶1 000、PCNA 1∶1 000、胱天蛋白酶-3 1∶500、Bax 1∶1 000、Bcl-2 1∶1 000、CREB1 1∶1 000、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)1∶1 000]4 ℃封闭过夜,接着加入对应山羊抗兔二抗(1∶2 000)室温封闭1 h,最后滴电化学反应液曝光,以GAPDH为内参,使用Quantity One软件分析蛋白条带灰度,以目标蛋白与内参蛋白GAPDH积分光密度(integrated-optical density,IOD)比值表示蛋白的表达水平。
1.2.8 裸小鼠移植瘤实验[10]
所有BALB/c裸小鼠分为4组:control组、miR-122-5p mimic组、pc-CREB1组、miR-122-5p mimic+pc-CREB1组。在裸小鼠左腋下皮下注射各转染过的EC109细胞(每只裸小鼠在100 mL PBS中注射5×106个细胞),继续在无特定病原体(specific pathogen free,SPF)条件下正常饮食饲养。第30天颈椎脱位法处死裸小鼠,完整取出皮下肿瘤,测定移植瘤体积和质量,采用免疫组织化学法检测Ki-67标记指数和胱天蛋白酶-3的表达水平。
1.2.9 免疫组织化学法检测Ki-67标记指数和胱天蛋白酶-3的表达水平[11]
移植瘤经常规石蜡包埋切片,脱蜡水化,过氧化物酶阻断内源性过氧化物酶活性,非免疫性动物血清阻断非特异性反应,分别加入兔来源Ki-67和活化胱天蛋白酶-3单克隆抗体,4 ℃过夜,滴加生物素标记二抗,二氨基联苯胺(diaminobenzidine,DAB)显色,蒸馏水冲洗,苏木精复染,梯度乙醇脱水,二甲苯透明,封片观察统计。Ki-67阳性染色多数位于细胞核中,胱天蛋白酶-3阳性染色多数位于细胞质中。每组选取5张片子,每张片子在×200光学显微镜下随机选取3个视野,使用Image-Pro Plus 6.0图像处理软件分析Ki-67标记指数和胱天蛋白酶-3在样本中的IOD值,用IOD值反映免疫反应物的表达强度。
1.3 统计学处理
所有统计数据采用SPSS 22.0处理,图形使用GraphPad Prism 6.0软件构建。实验数据以x±s表示,数据经Shapiro-Wilk检验发现均呈正态分布,多组比较进行One-Way ANOVA分析,两组比较使用SNK检验,P<0.05为差异有统计学意义。
2 结果
2.1 miR-122-5p和CREB1在食管癌组织和细胞中的表达情况
与正常组织相比,食管癌组织miR-122-5p表达显著下调(0.36±0.09vs1.00±0.04,P<0.0 1),CREB1mRNA表达显著上调(3.62±0.08vs1.01±0.05,P<0.01,图1A);食管癌组织中miR-122-5p与CREB1表达呈负相关(r=0.897 7,图1B)。人正常食管细胞HEEC及食管癌细胞系EC18、EC109、EC9706、Kyse520、Kyse140、HKESC1中miR-122-5p表达分别是1.00±0.05、0.34±0.08、0.3 1±0.0 9、0.3 6±0.0 7、0.3 9±0.0 8、0.41±0.07、0.43±0.08,CREB1 mRNA表达分别是1.00±0.04、4.32±0.09、4.53±0.07、4.1 6±0.0 8、3.7 2±0.0 9、3.4 3±0.0 9、3.17±0.07。与人正常食管细胞HEEC相比,食管癌细胞系EC18、EC109、EC9706、Kyse520、Kyse140、HKESC1中miR-122-5p表达显著下调,CREB1 mRNA表达显著上调(P<0.01,图1C);选取EC109细胞做后续实验。

图1 miR-122-5p和CREB1在食管癌组织和细胞中的表达情况Fig.1 miR-122-5p and CREB1 expressions in esophageal cancer tissues and cells
2.2 miR-122-5p和CREB1靶向关系
通过TargetScan软件预测发现,miR-122-5p与CREB1的3’UTR区存在结合位点(图2A);通过双萤光素酶报告基因试验发现,miR-122-5p mimic与PGL3-CREB1-WT共转染致萤光素酶活性显著降低(0.42±0.06vs1.00±0.05,P<0.01,图2B)。与对照组相比,miR-NC组miR-122-5p水平无明显变化(1.01±0.21vs1.00±0.20,P<0.01),miR-122-5p mimic组miR-122-5p水平显著上调(5.21±0.31vs1.00±0.20,P<0.01,图2C),说明转染成功。与对照组相比,miR-NC和pc-NC组CREB1蛋白表达无明显变化(0.83±0.07vs0.82±0.08,0.81±0.09vs0.82±0.08),miR-122-5p mimic组CREB1蛋白表达显著下调(0.43±0.06vs0.82±0.08,P<0.01),pc-CREB1组CREB1蛋白表达显著上调(1.42±0.09vs0.82±0.08,P<0.01,图2D);与miR-122-5p mimic组相比,miR-122-5p mimic+pc-CREB1组CREB1蛋白表达显著上调(0.83±0.07vs0.43±0.06,P<0.01,图2D);说明转染成功,且miR-122-5p靶向下调CREB1的表达。
2.3 miR-122-5p靶向CREB1对食管癌EC109细胞增殖的影响
对照组、miR-NC组、pc-NC组、miR-122-5p mimic组、pc-CREB1组、miR-122-5p mimic+pc-CREB1组24 hD值分别是0.49±0.04、0.48±0.03、0.50±0.03、0.40±0.03、0.66±0.03、0.52±0.03,48 hD值分别是0.82±0.03、0.81±0.04、0.84±0.04、0.65±0.04、1.32±0.05、0.90±0.04,72 hD值分别是1.31±0.04、1.30±0.03、1.35±0.03、0.91±0.03、2.12±0.04、1.51±0.04,克隆细胞数目分别是86.52±5.42、87.34±5.31、85.26±5.29、36.98±3.27、127.55±6.05、86.29±5.34,PCNA蛋白表达水平分别是0.42±0.03、0.43±0.04、0.41±0.03、0.19±0.04、0.72±0.04、0.43±0.04,Ki-67标记指数分别是0.53±0.04、0.54±0.03、0.52±0.04、0.23±0.03、0.81±0.04、0.55±0.05。与对照组相比,miR-NC和pc-NC组食管癌EC109细胞D值、克隆细胞数目、PCNA和Ki-67标记指数均无明显影响,miR-122-5p mimic组食管癌EC109细胞D值和克隆细胞数目显著减少,PCNA和Ki-67标记指数显著降低(P<0.01,图3),pc-CREB1组食管癌EC109细胞D值和克隆细胞数目显著增加,PCNA和Ki-67标记指数显著升高(P<0.01,图3);与miR-122-5p mimic组相比,miR-122-5p mimic+pc-CREB1组食管癌EC109细胞D值和克隆细胞数目显著增加,PCNA和Ki-67标记指数显著升高(P<0.01,图3)。
2.4 miR-122-5p靶向CREB1对食管癌EC109细胞凋亡的影响
对照组、miR-NC组、pc-NC组、miR-122-5p mimic组、pc-CREB1组、miR-122-5p mimic+pc-CREB1组细胞凋亡率分别是(4.92±0.52)%、(4.8 6±0.5 3)%、(4.9 8±0.5 5)%、(3 2.1 5±0.6 1)%、(1.1 6±0.3 2)%、(5.02±0.53)%,活化胱天蛋白酶-3表达水平分别是0.18±0.03、0.18±0.02、0.17±0.02、0.53±0.04、0.07±0.03、0.17±0.03,Bax表达水平分别是0.15±0.04、0.16±0.03、0.15±0.02、0.63±0.04、0.06±0.03、0.12±0.03,Bcl-2表达水平分别是0.55±0.04、0.56±0.03、0.54±0.03、0.21±0.03、0.72±0.04、0.55±0.04。与对照组相比,miR-NC和pc-NC组食管癌EC109细胞凋亡率和活化胱天蛋白酶-3、Bax、Bcl-2蛋白表达均无明显影响,miR-122-5p mimic组食管癌EC109细胞凋亡率显著升高,活化胱天蛋白酶-3、Bax蛋白表达显著上调,Bcl-2蛋白表达显著下调(P<0.01,图4),pc-CREB1组食管癌EC109细胞凋亡率显著降低,活化胱天蛋白酶-3、Bax蛋白表达显著下调,Bcl-2蛋白表达显著上调(P<0.01,图4);与miR-122-5p mimic组相比,miR-122-5p mimic+pc-CREB1组食管癌EC109细胞凋亡率显著降低,活化胱天蛋白酶-3、Bax蛋白表达显著下调,Bcl-2蛋白表达显著上调(P<0.01,图4)。

图2 miR-122-5p和CREB1靶向关系Fig.2 miR-122-5p and CREB1 targeting relationship
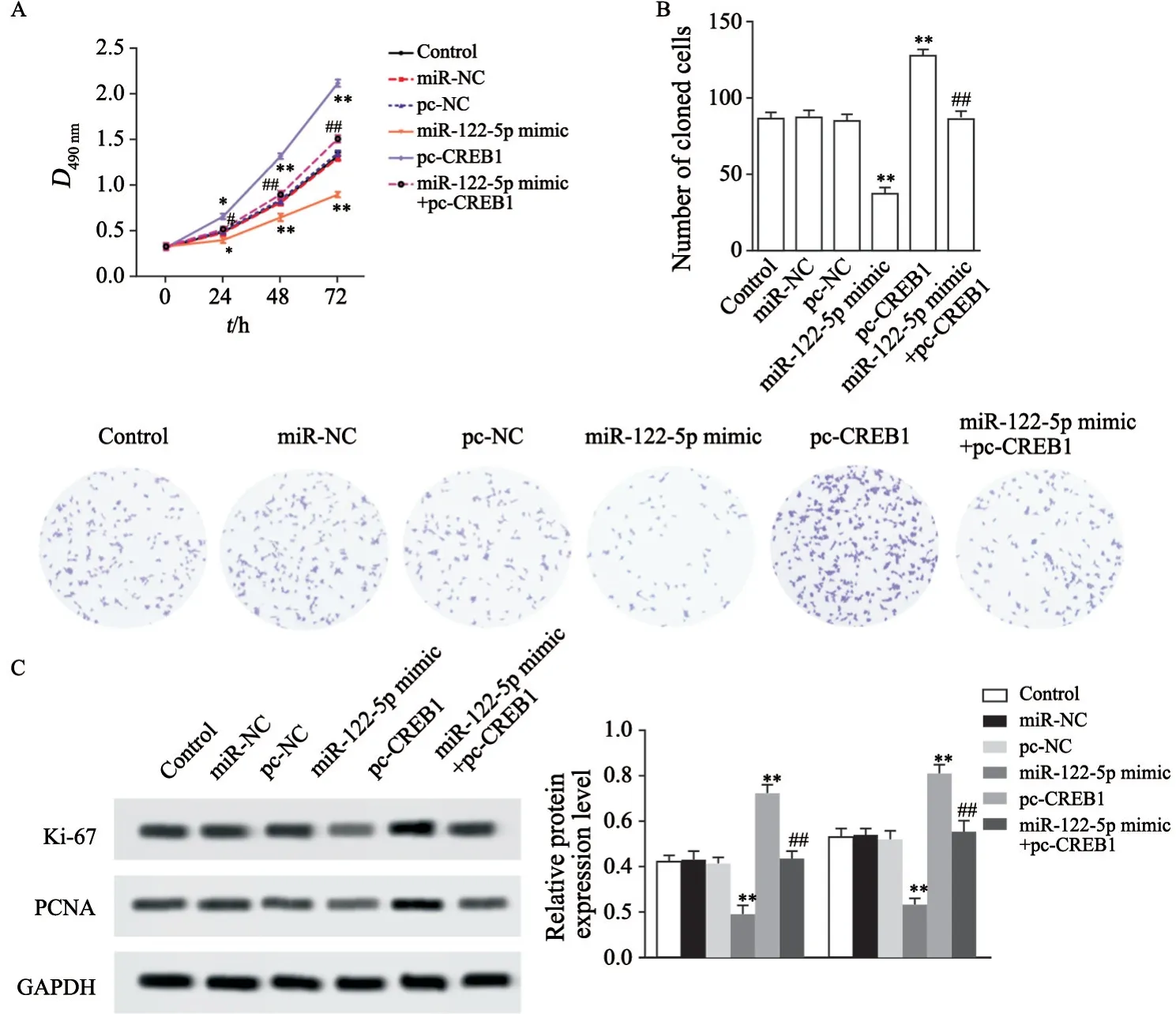
图3 miR-122-5p靶向CREB1对食管癌EC109细胞增殖的影响Fig.3 The effect of miR-122-5p on the proliferation of esophageal cancer EC109 cells by targeting CREB1
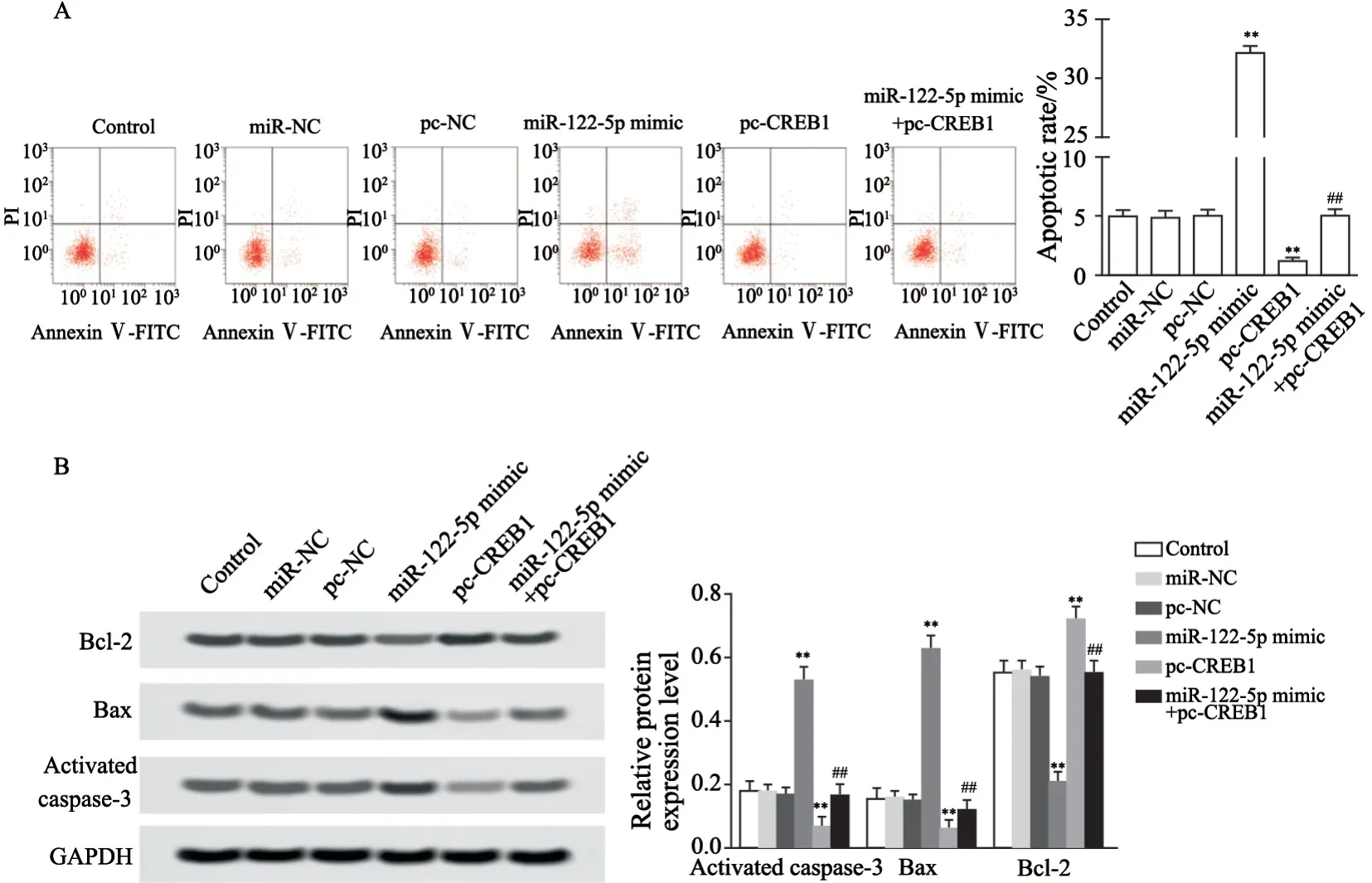
图4 miR-122-5p靶向CREB1对食管癌EC109细胞凋亡的影响Fig.4 The effect of miR-122-5p on apoptosis of esophageal cancer EC109 cells by targeting CREB1
2.5 miR-122-5p靶向CREB1对食管癌EC109移植瘤生长的影响
对照组、miR-122-5p mimic组、pc-CREB1组、miR-122-5p mimic+pc-CREB1组食管癌EC109移植瘤体积分别是(833.46±22.95)、(397.52±20.56)、(1286.43±26.42)、(856.99±22.75)mm3,移植瘤质量分别是(0.83±0.05)、(0.39±0.04)、(1.21±0.05)、(0.85±0.04)g,Ki-67的IOD值分别是162.49±23.55、89.53±22.73、281.46±27.18、172.44±25.64,活化胱天蛋白酶-3的IOD值分别是97.33±25.37、186.92±28.12、48.73±24.55、104.52±26.16。与对照组相比,miR-122-5p mimic组食管癌EC109移植瘤体积显著减小,质量显著减轻,Ki-67标记指数显著升高,胱天蛋白酶-3表达显著减少(P<0.01,图5),pc-CREB1组食管癌EC109移植瘤体积显著增大,质量显著增加,Ki-67标记指数显著降低,活化胱天蛋白酶-3表达显著增加(P<0.01,图5);与miR-122-5p mimic组相比,miR-122-5p mimic+pc-CREB1组食管癌EC109移植瘤体积显著增大,质量显著增加,Ki-67标记指数显著降低,胱天蛋白酶-3表达显著增加(P<0.01,图5)。
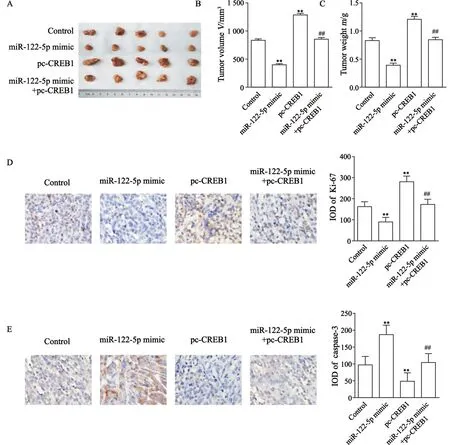
图5 miR-122-5p靶向CREB1对食管癌EC109移植瘤生长的影响Fig.5 The effect of miR-122-5p on the growth of esophageal cancer EC109 xenografts by targeting CREB1
3 讨 论
越来越多的证据显示,miRNA在肿瘤的发展和转移中发挥关键作用。miRNA充当基因表达的主要调节剂,在食管癌中存在大量miRNA的异常表达,如miR-574-3p在食管癌中低表达,作为抑癌基因[12];miR-424在食管癌中高表达,作为致癌基因[13]。已有研究[14]表明,miR-122-5p既可以作为致癌基因,如miR-122通过体外靶向ALDOA促进结肠癌的发展,又可以作为抑癌基因,如miR-122-5p通过靶向ALDOA抑制胆管癌细胞的增殖、侵袭和生长[15]。同已有研究[16]结论相一致,本研究表明,miR-122-5p在食管癌组织和细胞中低表达。此外,本研究还发现,过表达miR-122-5p减少食管癌细胞克隆数目,下调PCNA和Ki-67标记指数,增加细胞凋亡率,上调活化胱天蛋白酶-3和Bax蛋白表达,下调Bcl-2蛋白表达。肿瘤的一大特征就是细胞的无限生长。在正常情况下,细胞的增殖和凋亡处于一种动态平衡,但是在肿瘤细胞中细胞可无限增殖,而细胞凋亡被抑制[17]。PCNA和Ki-67标记指数反映细胞增殖能力[18]。Caspase家族和Bcl-2家族在细胞凋亡转导通路尤其是线粒体途径中发挥极为重要的调控作用,其中活化胱天蛋白酶-3、Bax和Bcl-2是常见的细胞凋亡标志蛋白,反映细胞的凋亡能力[19]。这说明过表达miR-122-5p抑制食管癌细胞增殖,并诱导细胞凋亡。
本研究结果显示,miR-122-5p对食管癌细胞的作用是通过靶向下调CREB1表达来实现的。CREB1基因位于人类染色体2q32.3-q34处,属于碱性/亮氨酸拉链转录因子家族[20]。CREB1基因编码多效性转录因子,在癌症中经常失调,可以调节肿瘤细胞的增殖或迁移状态[21]。CREB1在胃癌、非小细胞肺癌、乳腺癌、结直肠癌等多种癌症中表达上调,作为癌基因,促进肿瘤细胞增殖、侵袭和迁移,并抑制肿瘤细胞凋亡,从而促进肿瘤的发展[22]。已有研究[8]表明,CREB1在食管鳞状细胞癌组织中高表达,同本研究结果相一致。本研究结果显示,CREB1过表达增加食管癌细胞克隆数目,上调PCNA和Ki-67标记指数,减少细胞凋亡率,下调活化胱天蛋白酶-3和Bax蛋白表达,上调调Bcl-2蛋白表达,提示CREB1过表达诱导食管癌细胞增殖,并抑制细胞凋亡。同时本研究还发现,同时过表达miR-122-5p和CREB1可逆转miR-122-5p过表达对食管癌细胞增殖的抑制作用及凋亡的诱导作用,提示miR-122-5p过表达对食管癌细胞增殖的抑制作用及凋亡的诱导作用是通过下调CREB1表达来实现的。与miR-506通过靶向CREB1抑制食管癌细胞增殖的研究[23]结果相似,本研究证明,miR-122-5p通过靶向CREB1抑制食管癌细胞增殖,并诱导细胞凋亡。同体外研究结果相一致,体内移植瘤实验结果表明,miR-122-5p靶向CREB1减小食管癌EC109移植瘤体积和质量,增加Ki-67阳性细胞比率,减少胱天蛋白酶-3阳性细胞比率,证明miR-122-5p通过靶向CREB1抑制食管癌移植瘤的生长。
综上所述,miR-122-5p通过靶向下调CREB1来抑制食管癌细胞增殖,并诱导细胞凋亡,从而抑制食管癌细胞和移植瘤的生长,提示miR-122-5p和CREB1可成为治疗和预防食管癌的潜在靶点。

