硅胶的改性及其脱碳性能研究
陈彬剑,韩雨雪,王志强
(山东建筑大学 热能工程学院,山东 济南 250100)
天然气是世界能源的重要组成部分,在所有能源中最清洁有效.直接开采出的天然气富含酸性气体二氧化碳(CO),CO的存在不仅降低天然气的热值,同时在水存在的情况下形成弱腐蚀性酸.为了降低CO对天然气运输管道及储存设备的伤害,需要对CO进行吸附捕获.目前,国内外多采用活化MDEA法、真空变压吸附法(vacuum pressure swing adsorption,简称VPSA)及膜分离法进行吸附捕获.其中VPSA工艺的原理是利用不同的吸附剂对混合吸附质的选择性吸附,再通过解压将吸附剂再生,因此吸附剂的选择成为衡量VPSA分离气体效率的重要指标之一.
常用的固体吸附剂包括活性炭、13X分子筛、硅胶等.其中硅胶(SG)是由多聚硅酸经分子内脱水而形成,属于Si—O四面体的无定形结构,拥有较大的比表面积和良好的物理吸附性能.同时其表面存在大量的羟基,能够提高气体吸附的选择性,目前已作为吸附材料被广泛应用,如天然气脱水、脱碳、氢气脱氯、挥发性有机化合物(VOC)吸附、苯蒸气吸附等.
为了提高硅胶的CO吸附性能,笔者采用浸渍法,将硅胶分别置于不同的氢氧化钾与硫酸溶液中浸渍,得到改性硅胶吸附剂,并利用静态容积法测试了不同吸附剂的CO吸附性能.通过对CO吸附量的比较,选择有效溶液种类,进一步探究最佳溶液浓度与吸附温度.为了得到吸附剂结构性能,揭示其吸附机制,对最佳吸附剂进行氮气吸脱附分析.通过对吸附剂的动力学吸附与热力学性能研究,得到动力学性能参数、动力学吸附最佳拟合方程与热力学性能参数,分析其吸附反应自发进程.另外,为了工程应用的可能性,对吸附剂重复使用性进行进一步分析.
1 实 验
1.1 主要试剂
硅胶:天津市永大化学试剂有限公司;浓硫酸:99%,烟台远东化工有限公司;氢氧化钾:AR,天津科密欧化学试剂有限公司;去离子水.
1.2 吸附剂制备
(1)氢氧化钾溶液改性硅胶:称取10 g硅胶加入50 mL 1.0 mol·L的氢氧化钾溶液中,在室温条件下搅拌10 h后,过滤洗涤3次后将混合物料直接放入鼓风干燥箱中,加热至120 ℃,干燥10 h得到固体吸附剂,接着转移至真空干燥箱,在150 ℃条件下,干燥5 h得到吸附剂(SG-K-1),密封保存.
(2)硫酸溶液改性硅胶:称取10 g硅胶加入50 mL 1.0 mol·L的硫酸溶液中,在室温条件下搅拌10 h后,过滤洗涤3次后将混合物料直接放入鼓风干燥箱中,加热至120 ℃,干燥10 h得到固体吸附剂,接着转移至真空干燥箱,在150 ℃条件下,干燥5 h得到吸附剂(SG-S-1),密封保存.
1.3 氮气吸脱附
取定量吸附剂在150 ℃干燥箱中预处理6 h,随后将样品置于Max-asap2460 型物理吸附仪中,以氮气为吸附质,进行吸脱附实验.
1.4 CO2静态吸附
CO在改性硅胶的平衡吸附量采用静态容积法测定,如图1 所示.

图1 吸附量测定实验装置
系统的主体测试单元为参比槽与吸附槽,其中吸附槽体积为16 mL,参比槽的体积为78 mL.在静态吸附过程中,维持吸附压力为0.62 MPa,吸附温度分别为t
=20,40,60 ℃.同时为了维持温度的恒定,将参比槽和吸附槽置于同一恒温水浴锅内.另外CO的吸附量随时间变化曲线及平衡吸附量由吸附前后系统内气压的差值计算,该气压差可以通过理想气体状态方程pV
=nRT
决定,其中:p
为样品槽内气体压强(Pa),V
为 He或CO的体积(m),n
为He或CO的物质的量(mol),T
为恒温水浴锅温度(K),R
为理想气体常数(J·mol·K).1.5 吸附剂的重复使用
好的吸附剂应具有良好的重复使用性能,因此实验中对改性吸附剂进行重复使用性能测定.当吸附剂达到饱和后,采用抽真空的方式使吸附在吸附剂上的气体脱附进而对吸附剂进行重复使用,后在相同工况下再次进行吸附实验.重复使用性能通过下降率(D
)来衡量,其定义如下式所示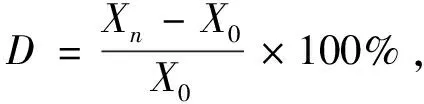
(1)
其中:X
为n
次脱附后再次达到饱和的吸附量,单位为mL·g;X
为初次达到吸附饱和时吸附剂的吸附量,单位为mL·g.2 结果与讨论
2.1 浸渍溶液种类对改性硅胶的CO2吸附的影响
为了比较酸碱溶液浸渍对硅胶的CO吸附的影响,将得到的2种吸附剂(SG-S-1与SG-K-1)置于静态吸附装置中,设置吸附压力为0.62 MPa,吸附温度为60 ℃.得到2种吸附剂吸附量随时间变化曲线及平衡吸附量如图2(a)所示.为了进一步揭示氢氧化钾溶液对吸附量的影响,改变氢氧化钾浓度(0.125,0.25,0.5,1,3,6 mol·L),得到多种吸附剂并进行CO吸附性能测试,结果如图2(b)所示.
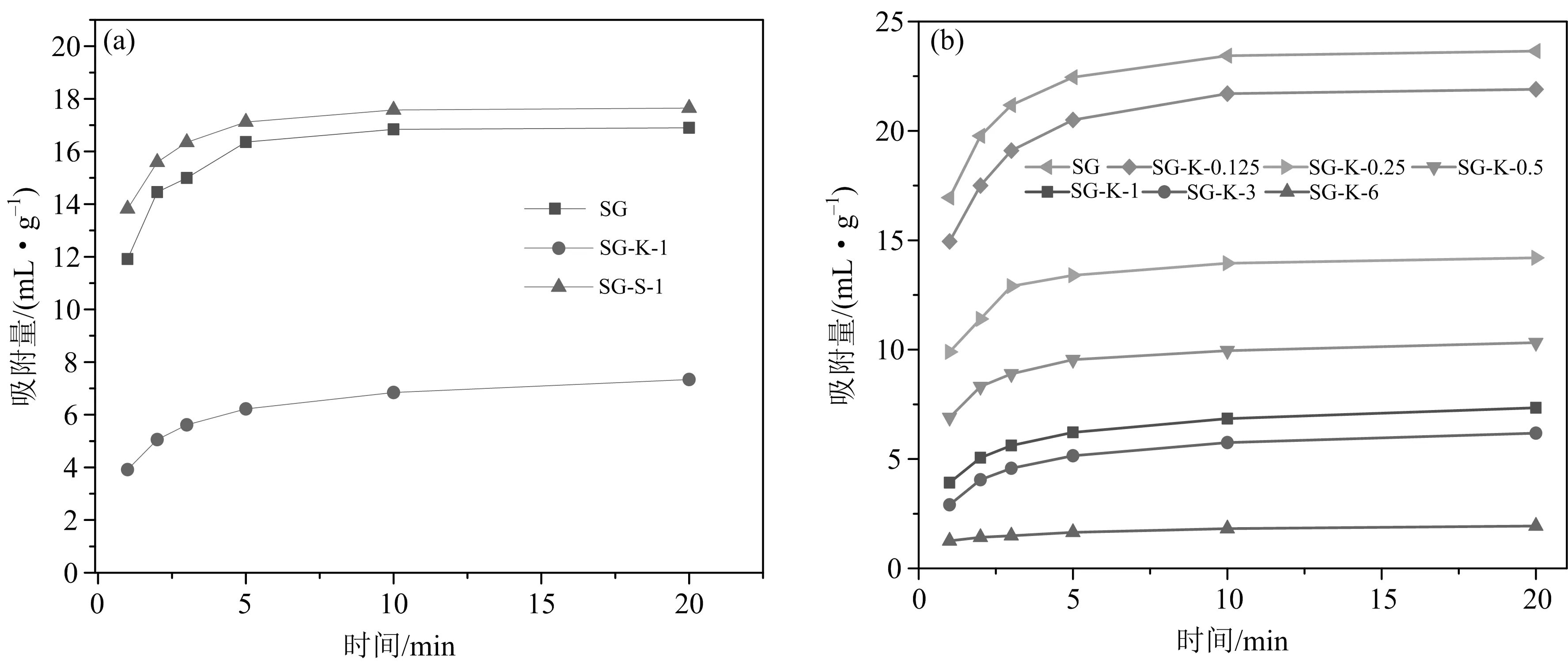
图2 60 ℃吸附温度下SG-S-1与SG-K-1的CO2吸附量随时间的变化(a)、氢氧化钾浸渍浓度对CO2吸附量的影响(b)
由图2(a)可知,吸附时间为1 min时,SG-S-1与SG-K-1的CO吸附量分别为17.65,7.33 mL·g.相对于硅胶本身的16.89 mL·g,使用氢氧化钾浸渍后,吸附量直线下降,下降率为56.6%.然而,硫酸溶液浸渍的硅胶,吸附量却有稍微的上升,上升了4.4%.另外,3种吸附剂到达平衡的时间相似,皆为20 min.到达平衡吸附后,虽然SG-K-1的吸附量有所上升,但相对于SG-S-1仍然有较大差距,3种吸附剂吸附量仍然维持原来的规律.冯庆革等采用硝酸溶液浸渍稻壳灰,制备了一种碳基CO吸附.在CO吸附实验中,得到了0.45 mL·g的CO吸附量,证明了一定浓度的酸溶液可以清理吸附剂本身孔道,甚至生成新的孔道,增加了硅胶表面羟基数量,有利于CO与硅胶的氢键连接.
由图(2)b可知,氢氧化钾溶液浓度的增加引起了CO吸附量的下降,尤其是SG-K-6的吸附量下降至1.94 mL·g,证明了氢氧化钾溶液对硅胶的溶解作用,破坏了硅胶本身的孔道.
2.2 硫酸溶液浸渍硅胶对CO2吸附的影响
为了增加硅胶的CO吸附量,选择硫酸溶液对硅胶处理,并进一步改变硫酸溶液的浓度(c
=0.125,0.25,0.5,1 mol·L),得到多种吸附剂,探究硫酸浸渍浓度对CO吸附的影响.为了便于比较吸附数据,将制备获得的吸附剂在吸附压力为0.62 MPa,吸附温度分别为20,40,60 ℃条件下,进行静态吸附,得到吸附量随时间变化曲线及平衡吸附量,如图3所示.

图3 不同温度下吸附剂的CO2吸附量随时间的变化(20 ℃(a),40 ℃(b),60 ℃(c))及平衡吸附量(d)
图3(a)揭示了吸附温度为20 ℃时不同吸附剂的CO吸附量,从图中可以看出,c
低于0.25 mol·L时,吸附剂的平衡吸附量高于本身SG,尤其是c
=0.125时,CO吸附量为32.97 mL·g,超过SG 的8.22%.这是由于硫酸溶液的浸渍清理了硅胶中原来堵塞的孔道,增加硅胶中羟基的含量,促进了CO与硅胶的氢键连接.Kazemi等在报道中表示氧和硫原子具有较高的电子密度,CO可以通过不同的方式(包括静电等)与其相互作用,增加吸附量.然而继续增加c
至0.5,1.0 mol·L时,CO吸附量迅速下降至30.02 mL·g与29.95 mL·g,明显低于SG的吸附.Aldana-Pérez等表明一定浓度酸性溶液有利于对载体的改性,但当酸性溶液浓度过高时,会对SG本身造成一定程度的腐蚀与破坏,从而降低吸附量.当吸附温度增加至40 ℃时(图3(b)),所有吸附剂的CO吸附量都随之减小,这是由于高温影响了硅胶孔道中CO的凝聚.但c
=0.125 mol·L与c
=0.25 mol·L的吸附量依然处于较高地位.另外,值得注意的是,当吸附温度增加至60 ℃(图3(c)),SG的吸附量快速下降至16.89 mL·g,低于c
=1.0 mol·L时的17.65 mL·g,这表明SG受温度影响远远高于改性后的吸附剂.同时c
=0.125 mol·L的吸附剂也失去了原来的优势,其平衡吸附量仅为19.41 mL·g,低于c
=0.25 mol·L时的20.68 mL·g.由图3(d)可明显看出,吸附剂的改性过程有效降低了吸附剂的温度敏感性(即吸附量随吸附温度升高而减小).尤其是c
=0.125 mol·L时,在吸附温度升高的过程中,CO吸附量得到了很好的保持.因此,选取最佳c
为0.125 mol·L,最佳吸附温度为20 ℃,为了方便描述,c
=0.125 mol·L时吸附剂定义为SG-S-0.125.2.3 吸附剂的氮气吸脱附
为了探究吸附剂的结构性能与吸附量的关系,揭示了吸附机制,研究了3种吸附剂(SG,SG-S-0.125,SG-K-0.125)的氮吸附/脱附等温线和孔径分布,结果如图4所示.SG,SG-S-0.125的结构性能列于表1.

图4 SG(a,b),SG-S-0.125(c,d),SG-K-0.125(e,f)的等温吸附曲线与孔径分布

表1 SG,SG-S-0.125的结构性能
图4(a),(c),(e)显示,SG,SG-S-0.125,SG-K-0.125的氮吸附/脱附等温线形状类似,皆具有明显的滞后环,根据IUPAC的分类,皆属于I型.由图4(b),(d),(f)的孔径分布和表1可以看出,SG吸附剂的表面积为586.98 cm·g,平均孔径为2.29 nm,孔隙体积为0.336 2 cm·g;SG-S-0.125的表面积为558.69 cm·g,平均孔径为2.49 nm,孔隙体积为0.229 0 cm·g.孔径的增加是由于硫酸溶液对SG硅胶孔道的清理与扩孔效果,使得更多的羟基暴露,促使CO与羟基的氢键连接,提高CO的凝聚与吸附.而比表面积的下降则是由于硫酸的存在对SG孔道的堵塞.另外,SG-K-0.125的比表面积下降至486.99 cm·g,这是由于氢氧化钾对硅胶的溶解作用,低的比表面积导致CO吸附量降低,这与图2(b)中的吸附实验结果一致.
2.4 吸附剂的重复使用性
根据实验设计,揭示SG-S-0.125的重复使用效果,如图5所示.

图5 SG-S-0.125的重复使用性能分析
图5显示,SG-S-0.125 的CO吸附量在第2次循环时存在明显降低(约降低5.68%),随后CO吸附量基本保持稳定.第10次重复使用效果仍然保持31.33 mL·g的较高水平,其下降率D
=7.77%.SG-S-0.125的重复使用性能均高于文献[20]中利用负载40% TEPA 的微介孔分子筛,这是由于TEPA的负载对分子筛孔道的堵塞,降低了CO在孔道内的凝聚效果.2.5 CO2吸附动力学
为了探究吸附剂的CO吸附动力学,采用4种动力学方程对吸附剂的CO吸附动力学进行拟合,分析吸附剂的动力学性能.动力学方程包括:准一级动力学方程、准二级动力学方程、Elovich 动力学方程和 Bangham 动力学方程,4 种动力学模型表达式分别为(2)~(5),拟合曲线和相关动力学参数分别如图 6和表2所示.

表2 吸附温度为20 ℃下SG-S-0.125的CO2吸附动力学参数
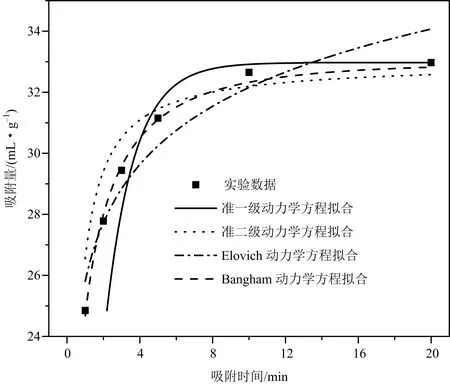
图6 吸附温度为20 ℃下SG-S-0.125的CO2吸附动力学模型拟合
ln(q
-q
)=lnq
-k
t
,(2)
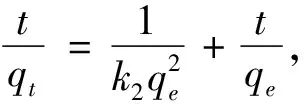
(3)

(4)

(5)
其中:q
,q
分别表示t
时刻和吸附平衡时 CO吸附量(mL·g);k
,k
分别为准一级和准二级速率常数;R
为拟合相关系数;α
为初始吸附速率常数;β
为脱附速率常数;k
,z
为动力学常数.由图6和表2可知,20 ℃下SG-S-0.125的4种动力学方程拟合的相关参数R
都超过了0.90,其中准二级动力学方程拟合的相关参数R
最大为0.999 9,因此准二级动力学方程可以更好地描述SG-S-0.125的CO吸附过程.为了验证准二级动力学方程对所有改性吸附剂的适用性,对所有吸附剂进行了准二级动力学方程拟合,如图7和表3所示,虽然硫酸浓度与吸附剂平衡吸附量不同,但4种吸附剂的准二级动力学方程拟合的相关参数R
都超过了0.999,因此硫酸改性的吸附剂均符合准二级动力学方程.
(a)SG-S-0.25;(b)SG-S-0.5;(c)SG-S-1.0.

表3 不同吸附温度下不同吸附剂的CO2吸附准二级动力学参数
在不同温度下对所有吸附剂进行准二级动力学方程拟合,以验证准二级动力学方程对吸附温度的适用性,其结果如表3所示.吸附温度为40 ℃时,所有吸附剂平衡常数k
有所增加,这是由于温度的提高促进了吸附过程.同时,所有的动力学拟合参数都大于0.999 9,证明了准二级动力学方程在吸附温度为40 ℃时的适用性.当吸附温度提高到60 ℃,平衡常数k
继续增加,动力学拟合参数却有所下降,但是都超过了0.999,证明在高温下,准二级动力学方程依然适用.2.6 CO2吸附热力学
为了进一步探究改性硅胶吸附过程,研究吸附过程中的标准自由能VG
、标准焓变VH
、标准熵变VS
等热力学参数.标准自由能VG
与吸附平衡常数k
的关系式为VG
=-RT
lnk
,(6)
其中:R
,T
分别为理想气体常数与气体热力学温度.标准焓变VH
、标准熵变VS
与吸附平衡常数k
的关系式为
(7)
以lnk
和T
作直线,VH
和VS
可以从直线的表达式中得到.当VH
<0时为放热反应,反之为吸热反应,结果如图8所示.
图8 lnk2与T-1关系
根据图8的截距和斜率,可得到SG-S-0.125的热力学参数VH
与VS
的值,结果列于表4.
表4 不同温度下SG-S-0.125的热力学参数
表4中,VH
=20.524 2 kJ·mol,VS
=3.224 9 kJ·mol.其中VH
与VS
的数值皆大于零,而VG
远小于零,说明吸附过程吸热,其中VH
因素不利于反应,而VS
因素利于反应进行.温度越高,VG
值越小,反应越容易自发进行,这是由于硫酸基团存在于硅胶孔道中,其中的氧和硫原子与CO相互作用,增加了自发反应进程.即实验中吸附温度越高,CO吸附量越低,但自发性进程越快.3 结束语
(1)氢氧化钾溶液对硅胶存在较高溶解作用,破坏孔道,降低吸附量.硫酸溶液则具有清理硅胶孔道与扩孔效果,对CO吸附有着良好的促进作用,然而过高的酸浓度有可能破坏硅胶结构,其中浸渍硅胶最佳的硫酸溶液浓度为0.125 mol·L.
(2)吸附剂吸附量随吸附温度升高吸附量下降,其中硅胶的最佳吸附温度为20 ℃,硅胶改性后,其CO吸附量的温度敏感性有效减小,即一定程度上克服了高温对吸附的抑制作用.
(3)改性后的硅胶吸附剂均符合准二级动力学模型,其拟合相关系数均大于0.99,拟合效果较好,同时该方程同样适用于不同吸附温度下吸附剂的吸附过程.
(4)SG-S-0.125吸附剂的标准自由能VG
、标准焓变VH
、标准熵变VS
等热力学参数表明吸附过程完全自发,同时吸附温度越高,自发进程越快.(5)选取最佳制备条件下的吸附剂SG-S-0.125进行重复性实验,表明10次重复使用后,吸附剂保持稳定,为工业应用提供可能.

