血清癌胚抗原、鳞状细胞癌抗原、调节性T细胞水平变化在评估宫颈癌患者术后放疗疗效中的应用
李 安,宋 蕊,李思瑾
(广州中医药大学第一附属医院妇科,广东 广州 510000)
宫颈癌是原发于子宫颈部位的恶性肿瘤,腹式根治术是治疗早中期宫颈癌的主要方式,放化疗作为手术综合治疗的一部分,能够抑制肿瘤活性,改善宫颈癌术后患者预后[1]。评估放化疗的敏感性,发挥放化疗的最大效用,就显得尤为重要。血清癌胚抗原(carcinoembryonic antigen,CEA)是一种反映恶性肿瘤存在的广谱性肿瘤标志物,鳞状细胞癌抗原(squamous cell carcinoma antigen,SCC-Ag)可通过激活MAPK信号通路促进鳞状上皮细胞浸润增殖,调节性T细胞(Treg)可诱导宫颈上皮内瘤变渐进性发展[2]。相关文献研究表明,宫颈癌患者血清CEA、SCC-Ag、Treg表达异常升高[3,4]。但是否能够动态监测宫颈癌术后放疗效果,仍需要进一步验证。本文主要分析宫颈癌术后放疗患者血清CEA、SCC-Ag、Treg变化特点,以及与放疗敏感性的关系。
1 资料与方法
1.1 一般资料选择2017年3月至2019年2月我院收治的子宫颈癌术后放疗患者123例,纳入标准:①均符合《妇产科学》[5]诊断标准;②有明显手术指征,且行腹式根治术治疗者;③经伦理委员会批准,告知研究事项后,患者均签署知情同意书。排除标准:①排除严重肝肾功能不全者;②放疗禁忌、凝血功能异常者;③中途退出或随访脱落者。123例子宫颈癌术后放疗患者年龄35~52岁[(43.45±6.16)岁]。国际妇产科联盟(FIGO)分期:ⅠA期25例,ⅠB期52例,ⅡA期26例,ⅡB期20例;病理类型:鳞癌70例,腺癌37例,腺鳞癌16例。
1.2 方法
1.2.1放疗方法 所有患者术后均实施调强放疗:CT扫描定位,勾画临床靶体积(CTV)、计划靶体积(PTV)、危及器官(OAR),使用6 mv-X线加速器照射,临床靶体积50~60 Gy,计划靶体积46~50 Gy,5次/周,共25次。靶区最大剂量不超过处方剂量10%,危及器官剂量:脊髓≤40 gy,肾脏V20≤30%,(小肠、结肠、直肠、膀胱)V50≤50%,(盆腔骨、股骨头)V30≤50%。、
1.2.2血清SCC-Ag、CEA、Treg检测 放疗前后,采集患者空腹静脉血8 ml,分为两管。一管3000 r/min离心10 min取血清,采用酶联免疫法检测血清CEA、SCC-Ag含量。一管肝素抗凝,采用流式细胞仪检测Treg细胞。
1.3 观察指标①根据WHO实体瘤疗效评价标准(RECIST)[6],分为完全缓解(病灶消失且维持时间≥4周)、部分缓解(病灶最大径与最大垂直径乘积减少>50%,维持时间≥4周)、稳定(病灶两径乘积减少<25%或增大<25%)、病变进展(肿瘤病灶两径乘积增大>25%或出现新病灶)。根据疗效评判标准分为有效组(完全缓解+部分缓解)、稳定组、进展组。②放疗前后CEA、SCC-Ag、Treg比较,血清CEA、SCC-Ag、Treg变化与放疗疗效的关系。放疗前后增减值=(放疗前-放疗后)/放疗前×100%。
1.4 统计学方法使用SPSS 22.0软件,计量资料比较采用t检验或方差分析;相关性分析采用Spearman分析,P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效123例宫颈癌术后放疗患者中,完全缓解18例,部分缓解66例,稳定26例,疾病进展13例,有效率为68.29%(84/123)。根据疗效评判标准分为有效组84例、稳定组26例、进展组13例。
2.2 放疗前后CEA、SCC-Ag、Treg比较放疗后,宫颈癌手术患者血清CEA、SCC-Ag、Treg低于放疗前(P<0.01)。见表1。

表1 宫颈癌术后患者放疗前后SCC-Ag、CEA、Treg比较
2.3 不同疗效组放疗前后CEA、SCC-Ag、Treg比较放疗前,有效组与稳定组SCC-Ag、Treg比较,差异无统计学意义(P>0.05),进展组血清CEA高于有效组与进展组,SCC-Ag、Treg高于有效组,稳定组血清CEA高于有效组(P<0.05);放疗后,CEA、SCC-Ag、Treg均表现为有效组<稳定组<进展组(P<0.05);放疗前后,有效组与稳定组血清CEA、SCC-Ag、Treg均减少,进展组血清CEA、SCC-Ag、Treg升高,三组比较差异有统计学意义(P<0.05)。见表2。
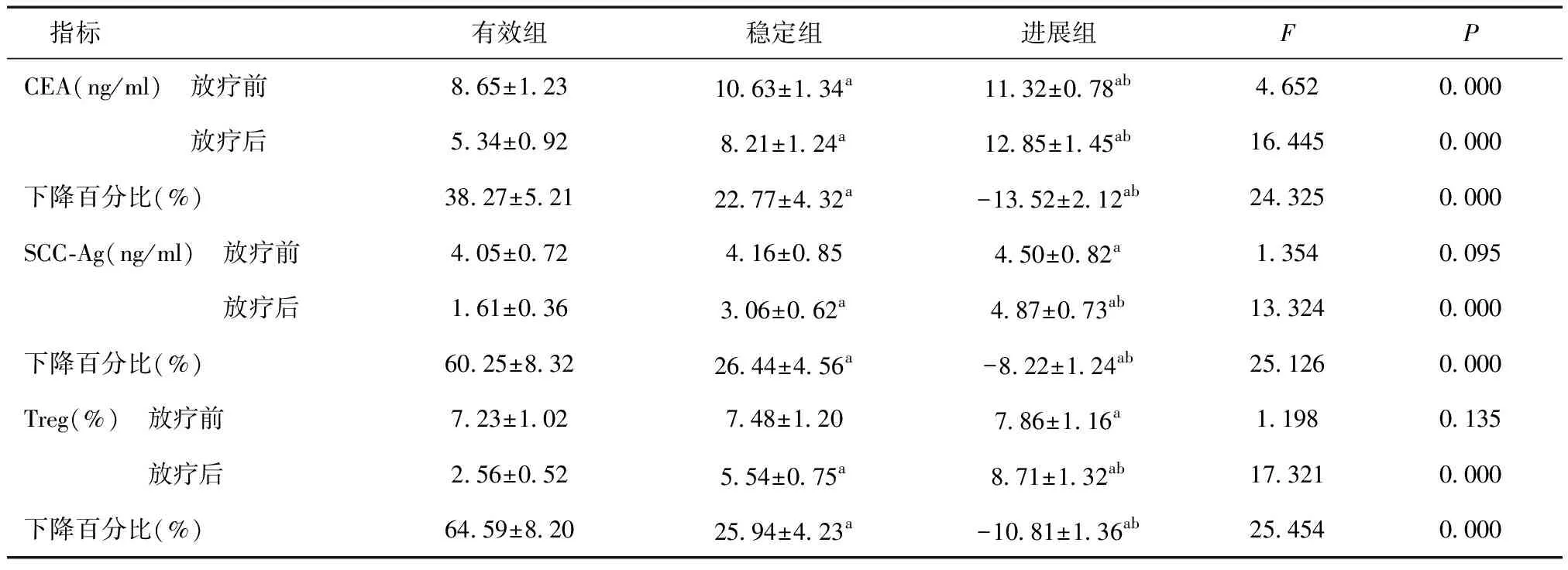
表2 不同疗效组放疗前后SCC-Ag、CEA、Treg比较
2.4 血清CEA、SCC-Ag、Treg与放疗疗效相关性分析以有效为-1、稳定为0、进展为1。以血清指标增减20%为临界值,分为下降>20%为-1、增减=20%为0、增加>20%为1,进行等级相关与多重回归分析,结果表明,血清CEA(r=0.352,P=0.014)、SCC-Ag(r=0.435,P=0.004)、Treg(r=0.412,P=0.008)下降百分比与放疗疗效呈相相关。
3 讨论
2018年全球新发宫颈癌约56.9万,我国每年新增超过13万,其中每年因宫颈癌死亡人数约为5.3万,已成为威胁女性健康和生命安全的重大疾病[7,8]。对于伴有高危因素的宫颈癌患者,术后辅助放化疗是改善预后的有效方法,但仍有20%患者放化疗敏感性较差[9,10]。放化疗在杀灭肿瘤细胞的同时,也会造成机体免疫功能的损伤[11]。如何评估放化疗敏感性,减少放化疗药物的过度使用,是摆在肿瘤学领域综合治疗的一道难题[12]。
临床评判放化疗效果主要根据肿瘤影像学,相对而言,肿瘤标志物更能反映肿瘤活性及功能的变化。CEA为一种特异性胚胎抗原酸性蛋白,可通过促进癌细胞DNA分裂途径,增加癌细胞浸润风险。SCC-Ag是一种鳞癌细胞相关抗原,能参与细胞基因调控、基质降解,特异性反映细胞增殖、浸润与转移情况[13]。Treg是一种肿瘤相关免疫细胞,可通过抑制效应T细胞导致肿瘤免疫逃逸,诱导肿瘤生长与免疫耐受[14]。曹锋等[15]研究报道,同步放化疗能降低中晚期宫颈癌患者Treg水平。程金龙等[16]研究认为,SCC-Ag水平与宫颈癌肿瘤临床分期、淋巴结转移明显相关,其变化程度能较好反映宫颈癌化疗敏感性。本研究中,宫颈癌术后患者放疗后血清CEA、SCC-Ag、Treg低于放疗前,说明放射治疗能降低宫颈癌术后患者血清CEA、SCC-Ag、Treg水平,维护手术治疗效果。
进一步分析表明,123例宫颈癌术后化疗患者中,有效84例,稳定26例,进展13例。进展组血清CEA、SCC-Ag、Treg高于有效组,且进展组血清CEA高于稳定组,稳定组血清CEA高于有效组。放疗后,有效组血清CEA、SCC-Ag、Treg低于稳定组、进展组,稳定组血清CEA、SCC-Ag、Treg低于进展组,说明宫颈癌术后患者放疗后血清CEA、SCC-Ag、Treg与放疗前存在一定的量效关系,顾金花等[17]在比较85例晚期胃癌化疗患者CEA、CA19-9比较中也有类似的文献报道。Yin等[18]研究认为,SCC-Ag预测宫颈癌化疗反应优于磁共振影像观察。为了更好说明CEA、SCC-Ag、Treg变化水平预测宫颈癌放疗的敏感性,本文采用增减百分比进行比较。结果表明,有效组、稳定组患者血清CEA、SCC-Ag、Treg下降幅度均为正值(放疗后血清CEA、SCC-Ag、Treg低于同组放疗前),而进展组血清CEA、SCC-Ag、Treg下降幅度均为负值(放疗后血清CEA、SCC-Ag、Treg高于同组放疗前),说明血清CEA、SCC-Ag、Treg下降幅度能反映宫颈癌放疗敏感性。董格等[19]研究报道,CEA、SCC-Ag下降百分比与局部晚期宫颈癌化疗敏感性正相关(r=0.324,0.415,P<0.05)。本文以疗效等级、血清下降百分比进行相关性分析,结果表明,血清CEA、SCC-Ag、Treg下降百分比与放疗疗效呈相相关(P<0.05),也支持上述文献观点。
综上,本研究结果表明,血清CEA、SCC-Ag、Treg水平变化与宫颈癌术后放疗效果相关,可作为评估宫颈癌放化疗敏感性评估的指标。需要指出的是,本文尚未对CEA、SCC-Ag、Treg不同下降幅度(即以<20%、20%-40%、>40%)放疗效果的比较,可能会对结论产生偏倚,需后续扩大样本作进一步研究。

