多囊卵巢综合征患者子宫内膜差异表达基因的生物信息学分析
李慕白 张 岩 王 蔚 刘 丽 吴效科
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种临床常见的内分泌紊乱性疾病,好发于育龄期女性,且对女性的生活、工作以及心理健康有重大影响。该疾病临床表现以月经失调、脂代谢异常和高雄激素血症为主。流行病学调查发现,各国各地区PCOS的临床表现具有高度的异质性,发生率约为8.7%~17.8%[1]。虽然异质性较高,但由于PCOS会引起患病女性卵巢形态改变,故其对于女性生殖功能的损害是不可避免的。对此有研究发现,PCOS患者子宫内膜蛋白质组的差异是其子宫内膜容受性降低和生育能力下降的重要原因[2]。本研究即从基因层面采用生物信息学技术比较PCOS患者子宫内膜与健康人子宫内膜差异表达基因,并对关键基因的生物学功能以及所影响的信号通路进行探讨,以期为临床修复PCOS子宫内膜损伤提供靶向治疗新位点。
对象与方法
1.研究对象:从2019年4~9月于黑龙江中医药大学附属第一医院妇科一科门诊就诊患者中挑选符合标准的PCOS患者3例(D组),另招募健康女性3例(T组)。本研究纳入标准:(1)女性年龄18~35岁。(2)育龄期女性。(3)排除其他疾病病史。(4)符合2003年国际鹿特丹诊断标准[①稀发排卵或无排卵;②高雄激素的临床表现和(或)高雄激素血症生化特征;③卵巢多囊改变:妇科盆腔超声检查提示一侧或双侧卵巢直径2~9mm的卵泡≥12个,和(或)卵巢体积≥10ml。上述3项中符合2项,并排除其他引起高雄激素血症疾病者,如先天性肾上腺皮质增生、分泌雄激素的肿瘤、库欣综合征等即可确定诊断]。(5)了解本研究程序并签署本研究知情同意书者。排除标准:①患有肝肾功能异常、心血管系统及其他内分泌代谢紊乱性疾病;②3个月内曾服用激素类药物;③妊娠、哺乳期女性及精神疾病患者;④合并心血管、脑血管、肝脏、肾脏和造血系统等严重原发性疾病;⑤近期参加过其他药物临床试验的患者。正常对照者年龄、体重等相近,差异无统计学意义。本研究经过黑龙江中医药大学附属第一医院医学伦理学委员会批准(批准编号:HZYLLKY201901201)。
2.子宫内膜的提取及差异表达基因的筛选:所有入选女性均于月经周期第7~10天内行宫腔镜检查术及部分子宫内膜诊刮术。子宫内膜样本经NanoDrop ND-2000(美国Thermo Scientific公司)定量并经Agilent Bioanalyzer 2100(美国Agilent Technologies公司)检测RNA完整性。质检合格后,将总RNA反转录成双链cDNA,并合成用cyanine-3-CTP(Cy3)标记的cRNA。标记好的cRNA和芯片杂交洗脱后利用Agilent Scanner G2505C(美国Agilent Technologies公司)扫描得到原始图像。采用Feature Extraction软件(version10.7.1.1, 美国Agilent Technologies公司)处理原图像提取原始数据。利用GeneSpring GX软件(wersion14.9, 美国Agilent Technologies公司)对原始数据进行质检标准化。根据t检验的P值和倍数变化值进行差异基因筛选,筛选标准为上调或者下调倍数变化值≥2.0且P<0.05。
3.基因功能及信号通路分析:采用Gene Ontology(GO)数据库对筛选出来的差异基因进行GO富集分析和 KEGG(Kyoto Encyclopedia of Gene and Genome)信号通路分析,同时绘制基因本体论气泡图。利用KEGG数据对差异基因进行通路分析,并利用超几何算法计算每个通路中差异基因富集的显著性,显著性富集的筛选标准为P<0.01。
4.蛋白相互作用网络的构建及基因编码蛋白的亚细胞定位分析:将筛选出的差异基因输入STRING数据库,得到一个蛋白质相互作用网络(protein-protein interaction, PPI)图。从中挑选出关键基因并利用PMLPR方法进行蛋白质亚细胞定位。
结 果
1.数据预处理:由于原始数据可能存在缺失值,基因对应多个探针等情况,故对各个样本的芯片进行预处理,绘制预处理前后芯片对比图(图1)。
图1 预处理前后样本质量箱式对比图
2.差异基因分布情况:按照差异筛选标准,共筛选出230个差异表达基因。对差异筛选结果进行火山图绘制以确定差异基因分布情况(图2)。
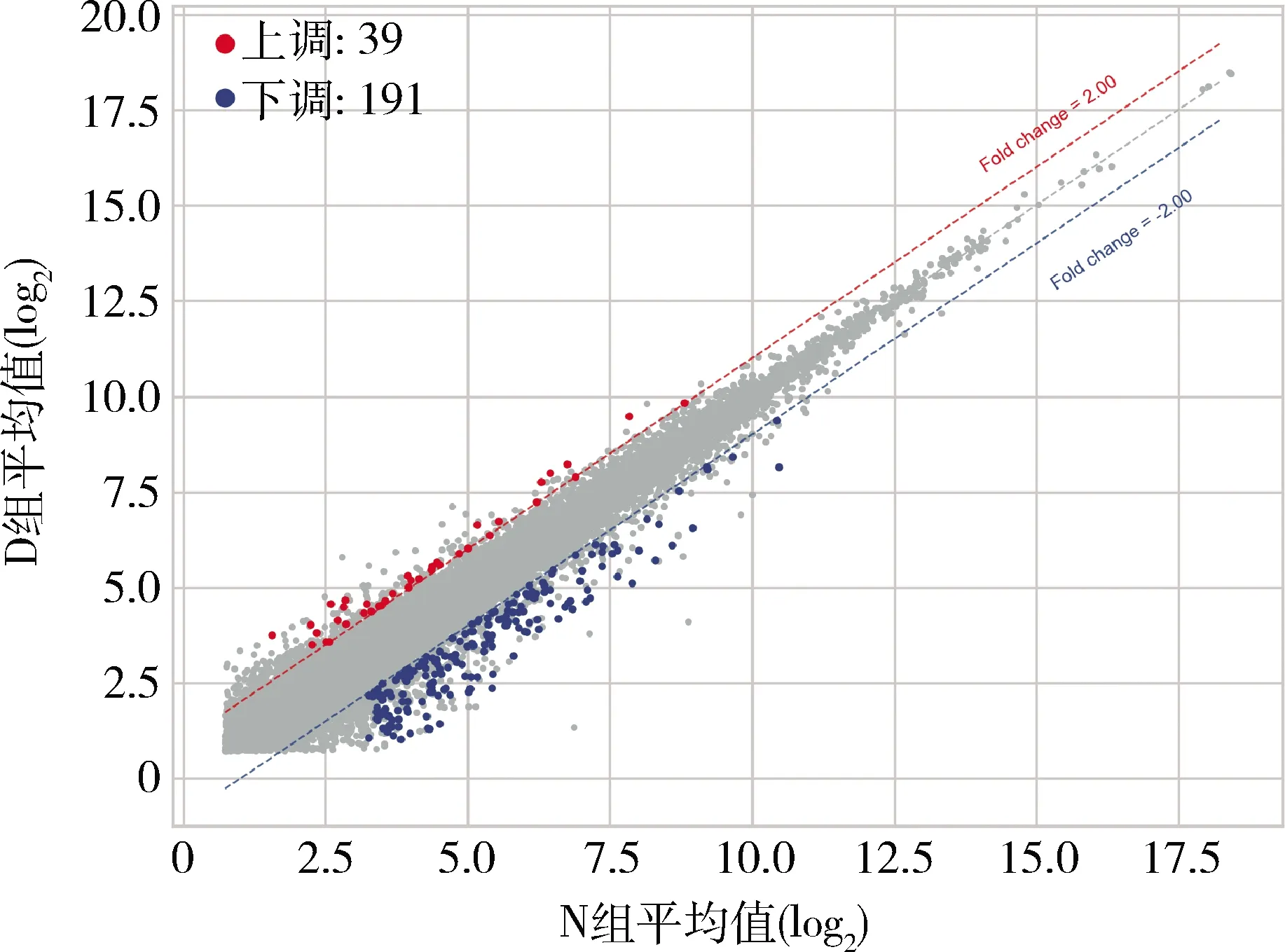
图2 筛选差异基因分布情况
3.GO富集及KEGG信号通路分析:利用GO数据库对差异表达基因进行GO功能富集分析。主要包含3大类,即生物学工程(biological process, BP)、细胞组分(cellular component, CC)和分子功能(molecular function, MF)。GO富集分析结果显示,其中BP中P<0.05的条目共计148条;CC中P<0.05的条目共计30条;MF中P<0.05的条目共计46条,主要包括参与蛋白轻、中链的结合,影响微管运动活性。对GO富集分析结果中各类P值最小的前10个条目绘制条形图(图3)。KEGG分析结果发现P<0.05的通路共计13条(图4)。
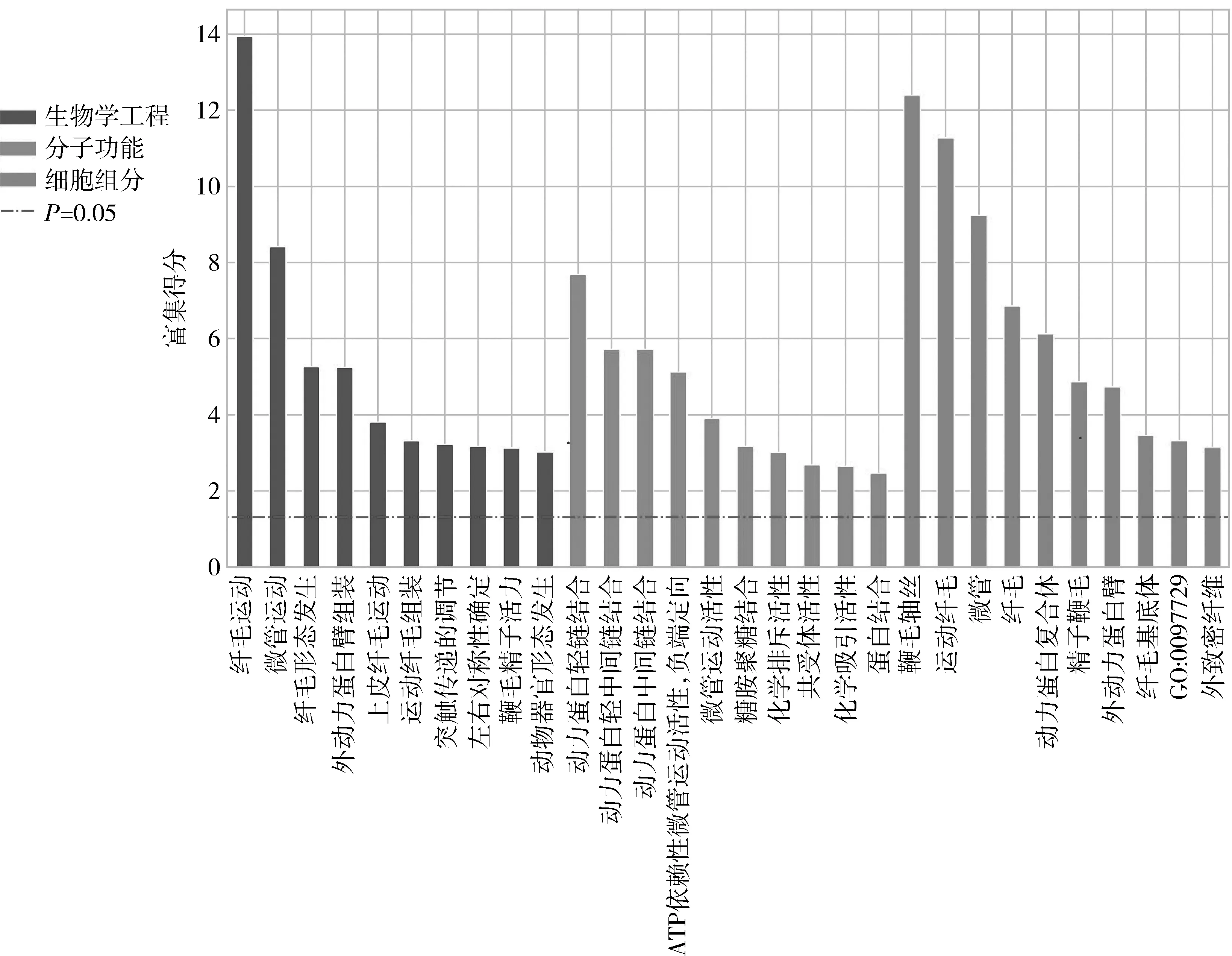
图3 GO富集分析结果条形图
4.蛋白相互作用分析及关键基因筛选:对所有筛选出的差异表达基因进行PPI构建并聚类(图5)。综合上述分析结果,从中筛选出6个与PCOS临床研究相关且差异表达较为显著的6个基因分别为CACNA1C、LAMB3、CCND2、PLCB4、IL7、NTF3。上述关键基因分子功能主要为影响蛋白结合、细胞分裂、层黏连蛋白复合体等。生物学过程主要参与组织器官生长发育、钙离子通道调节、信号转导等。主要信号通路富集于胰岛素分泌、促性腺激素信号通路、PI3K/AKT信号通路等。其中CACNA1C、LAMB3、CCND2表达上调,剩余3个在D组表达均下调(表1)。
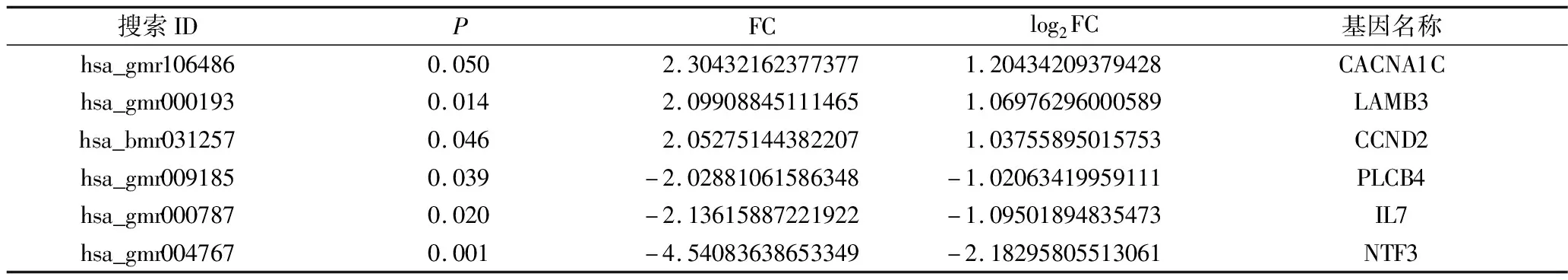
表1 关键基因相关数值

图5 差异基因蛋白相互作用网络
5.差异表达基因编码蛋白的亚细胞定位分析:利用PMLPR,检索条件为“Human”物种,分别输入6个关键基因,结果显示上述基因中除CCND2基因编码蛋白亚细胞大概率定位于细胞核外,余下基因编码蛋白位置处于细胞膜的可能性较大。
讨 论
PCOS作为一种激素内环境紊乱性疾病,主要引起生殖功能障碍和糖代谢异常。近年来,PCOS发生率逐年增加,但其发病机制仍不清楚。而遗传因素是导致PCOS发病的主要因素之一,这一观点受到了研究者的广泛认可。因此,从基因角度挖掘PCOS病情变化以及临床治疗已成为一条全新的临床思路。有研究者采用全基因组关联研究(GWAS)方法来确定常见疾病的遗传因素,结果发现,中国女性进行的两次GWAS中发现11个位点与PCOS发病风险密切相关[3]。另外,有研究结果表明,与脂质和类固醇合成相关的低甲基化基因能促进类固醇激素(包括雄激素)的合成,从而解释PCOS高雄激素血症的机制[4]。也有研究者研究早期胰岛素信号转导与异常转化生长因子β(TGF-β)调节的组织纤维化的关系中发现,基因表达暗示了TGF小分子配体调节纤维化在PCOS-肥胖协同胰岛素抵抗和运动反应的改变[5]。
由于PCOS是一种妇科内分泌疾病,故对其代谢紊乱的基因探索一直是研究重点,而对于女性生殖系统的基因探索则相对较少。有研究者观察PCOS大鼠模型发现卵巢出现大量闭锁卵泡和囊性扩张,颗粒细胞层减少,卵泡细胞层增厚,滤泡膜细胞增生[6]。卵巢的形态学改变影响其正常生理功能,导致无成熟卵泡形成甚至无排卵,而子宫内膜长期受雌激素影响,正常的内膜周期发生紊乱,子宫内膜呈不同程度的增殖性改变甚至发展成为子宫内膜癌[7]。本研究为了明确PCOS患者子宫内膜基因表达变化情况,采集PCOS患者及健康人部分增殖期子宫内膜各3例,利用当前先进分子生物学技术,筛选出有统计学意义的230个差异表达基因,并对其进行了功能富集和信号通路分析。后利用蛋白相互作用表达网络挑选出6个与PCOS临床研究密切相关且差异较为显著的基因,其中在D组中CACNA1C、LAMB3、CCND2表达上调,PLCB4、IL7、NTF3表达下调。这些差异表达的基因蛋白产物主要位于细胞核和细胞膜上。上述基因分子功能主要为蛋白结合、细胞分裂、层粘连蛋白复合体等。生物学过程主要富集于组织器官生长发育、钙离子通道调节、信号转导等,这些基因的发现可能为PCOS患者子宫内膜的修复提供新的临床靶点。
CACNA1C基因位于人12号染色体上,即L-型钙离子通道α1C亚基,其生物学功能是对人体内钙离子通道的调节,并参与了胰岛素分泌信号通路。该基因是一种编码电压门控钙通道的精神疾病风险基因,其转录谱非常复杂,最新被鉴定发现的就有38个外显子和241个转录本[8]。该基因在PCOS方面暂无相关报道。但在子宫内膜方面,Qiao等[9]对子宫内膜癌突变基因进行了筛选,发现KIAA1109、CACNA1C、BSN、AKAP13、CELSR2、HELZ2等基因的突变较为突出。这表明CACNA1C基因的表达对于人体子宫内膜的病变有一定影响,这可能是引发少数PCOS患者随着病情的发展逐渐出现子宫内膜息肉甚至不典型增生的重要原因。
LAMB3、CCND2、IL7、NTF3都参与了PI3K/AKT信号通路,PI3K/AKT信号通路是目前研究PCOS的重点通路,在最新研究中,有研究者造模PCOS胰岛素抵抗大鼠,后予以黄连素喂养,结果发现黄连素能有效降低大鼠模型系统中的PCOS胰岛素抵抗值,这一结果的产生则与400mg/kg的黄连素治疗能对PI3K/AKT信号通路起激活作用密切相关[10]。而对于该通路和子宫内膜之间的联系,也有研究者利用PI3K/AKT活性通路的特异性抑制剂作用于Ishikawa细胞,来研究其对细胞中AKT和SGK1激酶活性的影响,Ishikawa细胞是一种特征清晰的子宫内膜细胞系,代表接受性子宫内膜,结果发现PI3K/AKT活性通路的特异性抑制剂能够针对性治疗子宫内膜上皮细胞病变[11]。LAMB3名为层粘连蛋白β3亚单位,是编码LM-332的3个亚单位之一,当前对于该基因的研究是发现该基因的表达与某些类型的癌症的扩散和转移能力有关,例如胰腺癌,有研究者发现LAMB3在胰腺癌患者体内过表达,而通过抑制LAMB3可以消除PI3K/AKT信号通路激活的致瘤结果,包括细胞体外增殖、侵袭和迁移以及体内肿瘤生长等[12]。
CCND2属于CCNDs家族,该家族由MOTOKURA等在对于甲状腺癌的研究中被首次分离出来,共存在CCND1、CCND2和CCND3 3个亚型。目前,对于该基因的妇科研究重点在于卵巢癌方面,Chang等[13]通过实验发现长链非编码RNA HOTAIR在卵巢癌组织和细胞系中的表达显著高于对照组,同时负向调节miR-206表达,而CCND1和CCND2作为miR-206的下游目标,与HOTAIR形成了正向调控关系,并通过功能分析,表明在卵巢癌中同时过度表达CCND1或CCND2,可以挽救miR-206的抗癌作用,从而有效卵巢癌细胞的增殖和转移。CCND2作为促卵泡生成素(follicle-stimulating hormone,FSH)的下游因子之一,主要在卵巢颗粒细胞中进行表达,并且在卵泡的发育过程中促进颗粒细胞增殖[14]。作为卵巢重要组成部分之一的颗粒细胞,在卵泡发育成熟及排卵的一系列过称中起着极其重要的作用,并且颗粒细胞功能的异常也是引起PCOS的主要病理生理基础[15]。另有研究发现,CCND2作为LAMB3通路下游基因之一,在肝细胞癌上的治疗上,对于猕猴桃根提取物(ERAC)的响应相同[16]。由此推测在修复PCOS子宫内膜损伤方面,可以通过抑制LAMB3基因在PI3K/AKT信号通路发挥作用防止癌变的同时,也会抑制下游基因CCND2的过表达,使其可以有效治疗PCOS患者卵巢形态变化,恢复正常排卵功能,从而改善雌激素分泌情况,修复子宫内膜损伤。
PLCB4作为一种磷脂酶位于人20号染色体p12区域,磷脂酶C(phospholipase C, PLC)是一种膜相关酶,调节细胞的运动、生长、转化和分化等多种行为。PLC参与肿瘤的迁移、侵袭和耐药[17]。Li等[18]为了探讨脂质分解代谢相关基因在胃肠道间质瘤中的意义,鉴定了与肿瘤进展相关的复制和差异上调的PLCB4基因,结果证明与正常组织比较,不同风险水平的肿瘤中PLCB4 mRNA丰度均显著增加,且与免疫表达水平密切相关。本研究发现PLCB4除了参与癌症细胞通路外,还参与调控促性腺激素信号通路以及炎性反应的信号通路,推断该基因表达的下调,可能与PCOS患者子宫内膜存在慢性炎症病理反应相关。
综上所述,本研究通过生物学信息技术,从基因层面对PCOS子宫内膜差异基因进行了深入分析,获得了可信的基因数据。挑选出来的6个关键基因CACNA1C、LAMB3、CCND2、PLCB4、IL7、NTF3由于参与多条PCOS生殖内分泌相关信号通路,且具有重要的代谢调节作用,可以为临床上延缓PCOS子宫内膜损伤甚至病变发展进程提供新的基因靶向治疗参考。

