电活化过硫酸盐处理含溴水时含溴副产物的生成
张冬艺,张 峰,李红艳,王朝旭,崔佳丽,崔建国
(1.太原理工大学 环境科学与工程学院,太原 030024;2.山西省市政工程研究生教育创新中心,太原 030024)
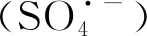
BDD+H2O→BDD(OHg)+H++e-.
(1)
(2)
在强调氧化效率高的同时也不能忽视当其应用于微污染原水处理时可能产生副产物,特别是高毒性的含溴副产物[5]。根据世界卫生组织(WHO)规定《饮用水质量标准的最大容许污染物质》中的消毒副产物(DBPs)标准,饮用水中总三卤甲烷(4种)和总卤乙酸(5种)的最大允许量分别为80 μg/L和60 μg/L;溴酸盐最大允许量为10 μg/L.
本研究采用BDD阳极和Ti阴极构建电化学体系,选用过二硫酸钠(PDS)作为活化前体物,以Br-和NOM典型组分腐殖酸(HA)配制的模拟含溴水体为反应对象,通过电化学行为表征、自由基猝灭实验对电活化体系的作用机理进行分析;通过对主要溴化物的转化过程进行监测,考察了电活化PDS过程中含溴副产物的生成规律;针对PDS投加量、电流密度和初始pH等操作条件对含溴副产物生成的影响进行了讨论。实验结果将为电活化PDS高级氧化工艺在微污染水处理领域的应用提供理论依据。
1 实验部分
1.1 实验药品与反应装置
实验使用试剂均为分析纯及以上纯度试剂。卤代甲烷(THMs)混标(4种)、卤乙酸(HAAs)混标(9种)、内标1,2,3-三氯丙烷以及1,2-二溴丙烷,均购自美国o2si;甲基叔丁基醚(MBTE)购自CNW Technologies GmbH;腐殖酸(HA)购自天津北联精细化学品公司;过二硫酸钠(PDS)、卡马西平(CBZ)购自阿拉丁公司。实验所用溶液均由超纯水配置(电阻率≥18.25 MΩ/cm).
实验在自制的单槽循环电解装置中进行。以14 cm×5 cm×10 cm的有机玻璃敞口电解槽作为主反应器,以有效容积为1 L的烧杯作为储液池。通过蠕动泵使反应溶液以一定流速在反应器和储液池之间形成动态循环。储液池置于磁力搅拌器上,使反应溶液浓度均匀、温度恒定。BDD阳极(25 mm×50 mm,瑞士Neo-Coat)和同样尺寸Ti阴极(天津艾达恒晟),垂直对置于反应器内,极板间距1.5 cm,浸入面积均为10 cm2.实验过程中采用精密直流稳压电源(0~30 V,0~5 A)恒电流供电。
1.2 实验方案及分析方法
1.2.1常规试验
TBM的分析参照国标HJ 620-2011进行。样品经顶空进样器挥发进入配备电子捕获检测器(ECD)和KB-1701气相毛细管色谱柱的气相色谱仪(GC-4000A,北京东西分析)进行测定。检测条件:99.999%高纯氮气为载气;进样口温度120 ℃,检测器温度300 ℃;初始柱温50 ℃,保持5 min;5 ℃/min升至90 ℃,保持2 min. MBAA、DBAA、TBAA的分析参照国标HJ 758-2015进行。在pH值<0.5条件下,用MBTE萃取水样,萃取液用硫酸酸化的甲醇溶液,使卤代乙酸形成卤代乙酸乙酯,由GC-ECD测定。检测条件:99.999%高纯氮气为载气;进样口温度210 ℃,检测器温度300 ℃;初始柱温40 ℃,保持5 min;8 ℃/min升至100 ℃后,6 ℃/min升至200 ℃,保持10 min.
1.2.2电化学行为表征
采用循环伏安法(CV)对电活化PDS体系中Br-、PDS、HA等主要参与物质在阳、阴极表面的电化学行为进行考察。CV曲线由CHI600E(上海辰华仪器有限公司)电化学工作站检测,采用三电极体系,以电活化实验所用的BDD和Ti电极交替作为工作电极和辅助电极,饱和甘汞电极(SCE)作为参比电极。CV曲线测定时,加入2.0 mmol/L的NaClO4作为基础电解质,试验前通入氮气以排除溶液中的氧气。BDD和Ti电极的扫描范围分别为0~2.5 V和-2~0 V;扫描速率均为0.01 V/s.
1.2.3自由基猝灭实验
以0.1 g/L的CBZ溶液(1 L,初始pH值为7.0)为目标对象,在投加设定浓度自由基猝灭剂(甲醇和叔丁醇)条件下进行电活化降解。间隔10 min取样,取样后的样品立刻加入10 μL甲醇终止剂,通过对CBZ的降解情况进行测定,间接考察电活化PDS体系中自由基生成情况。
CBZ的浓度采用高效液相色谱仪(LC100,上海伍丰)测定;仪器配备C18反向柱(5 μm×4.6 mm×150 mm)和可变波长扫描紫外光检测器。流动相:V(甲醇)∶V(乙腈)=6∶4;流速:0.8 mL/min;柱温30 ℃,检测波长286 nm,进样量20 μL.
2 结果与讨论
2.1 电化学行为表征和自由基猝灭实验
利用循环伏安法分别对Br-、PDS和HA在电活化PDS体系中阳、阴极表面的电化学行为进行了考察。拥有较高析氧电位的BDD电极属于典型的非活性电极,其表面直接氧化能力较弱,具有更强的物理性吸附态OH·的生成能力[13]。由图1(a),PDS的加入使得氧气析出反应起始电位相对增大,这与SONG et al[2]的发现一致。可能是PDS在BDD阳极表面生成的物质抑制了电解水析出氧气的副反应,从而促进了OH·的生成。在0.5~2.5 V的正向扫描中,Br-和PDS在BDD电极表面均未产生明显的直接氧化峰,这表明Br-在BDD/Ti电活化体系中的转化是依靠体系中活性物质的间接氧化来实现的;而BDD的直接氧化作用,也未参与到PDS的活化过程中。当HA存在的时候,1.0~1.5 V之间所产生的明显电流峰,表明HA可在BDD电极表面发生直接电子转移(direct electronic transfer,DET),其矿化及中间体的产生可能是电活化体系中电极DET和活性物质间接氧化共同作用的结果。
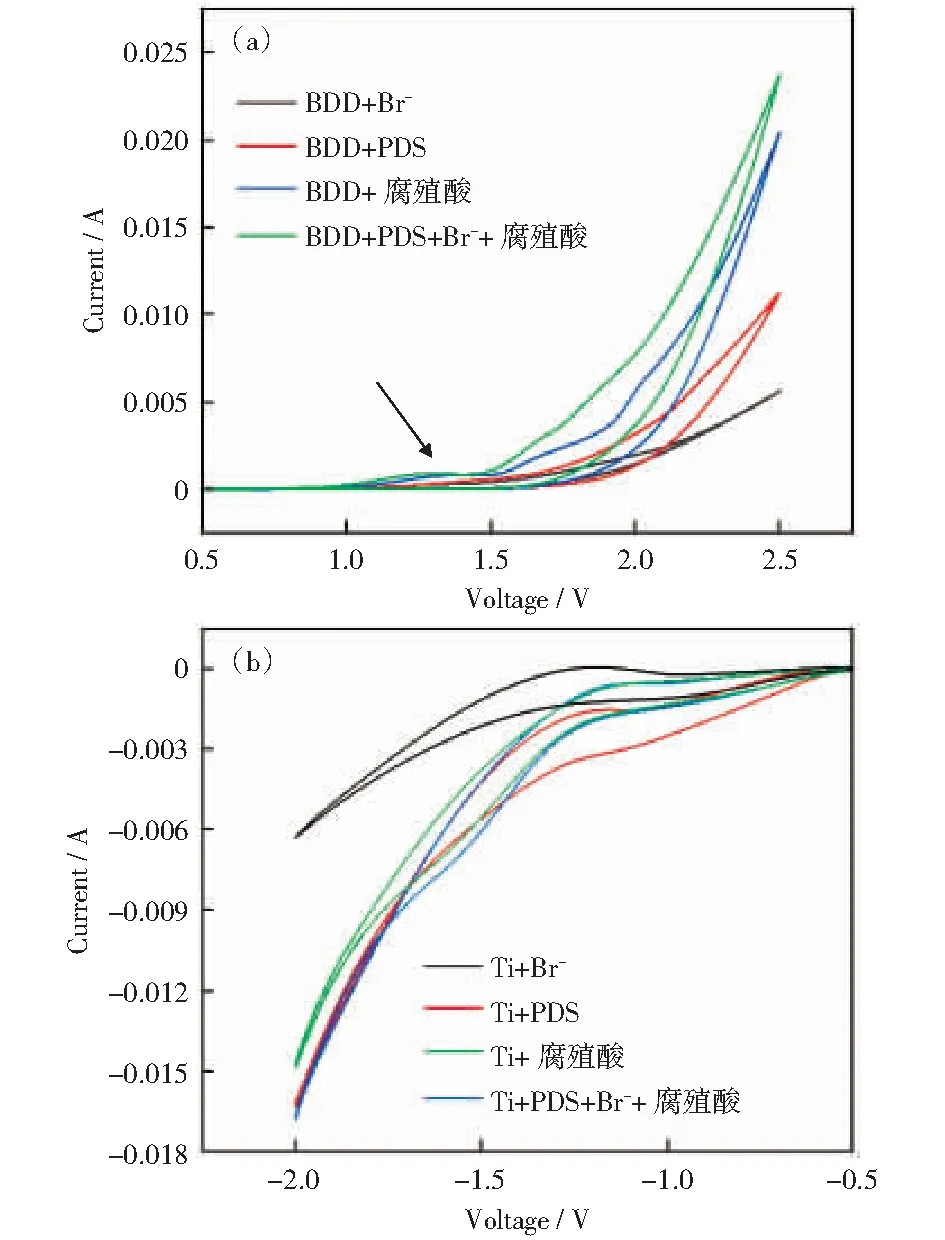
反应条件:电解质c[NaClO4]=2.0 mmol/L、c0[PDS]=5.0 mmol/L、ρ0[Br-]=1.0 mg/L、ρ[HA]=3.0 mg/L、J=20 mA/cm2

反应条件:c0[PDS]=5.0 mmol/L、ρ=0.01 g/L、J=20 mA/cm2、t=(30±2)℃
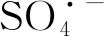
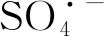
2.2 反应过程中溴的转化
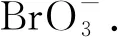
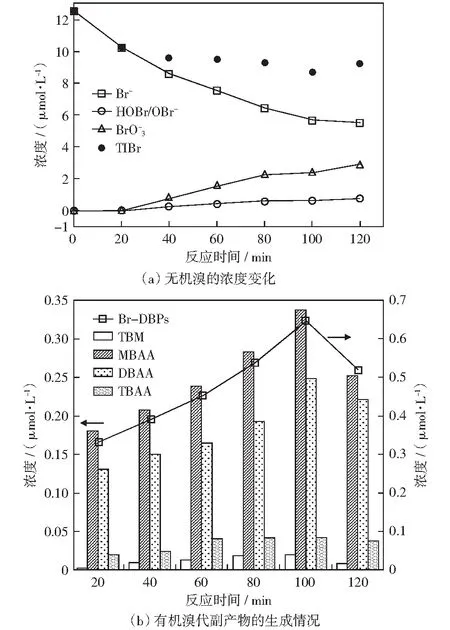
反应条件:ρ[Br-]=1.0 mg/L、c0[PDS]=5.0 mmol/L、ρ[HA]=3.0 mg/L、pH=7.0、J=20 mA/cm2
NOM是水处理过程中有机副产物的重要前体物,其官能团结构与副产物的分布规律显著相关。作为NOM的主要组分,HA是以芳香结构为核心,具有羧基、酚羟基、羰基、醌基、甲氧基等官能团的大分子有机物,容易与次卤酸、卤素自由基等游离卤素发生反应,生成THMs、HAAs等卤代DBPs[18]。如图3(b),在模拟溶液HA和Br-共存且未投加氯的条件下,电活化PDS反应体系中检测到了溴代THMs和溴代HAAs的存在。在这些主要副产物中,溴代HAAs的浓度占据优势(反应时长中始终大于Br-DBPs的94%),其中MBAA生成浓度最高,DBAA其次。
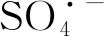
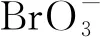
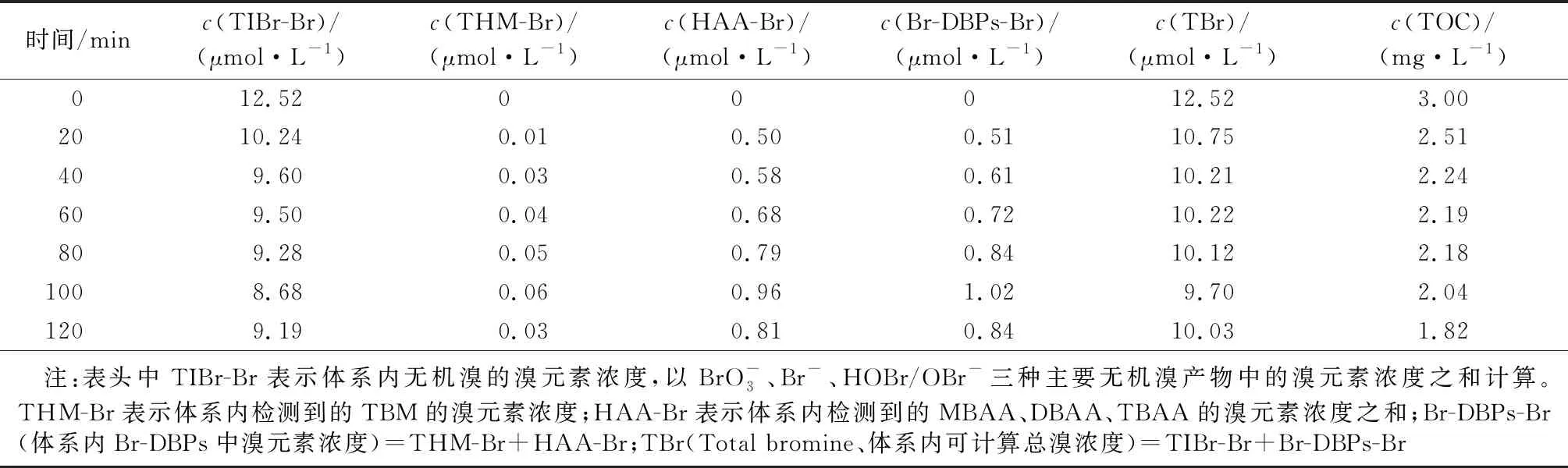
表1 电活化模拟含溴水体系中溴的变化及TOC降解情况
(3)
R-Xn+nH++ne-→R-Hn+nX-.
(4)
综合上述分析,对BDD/Ti电极对构建的电活化PDS体系内含溴副产物的转化机理总结如图4所示。
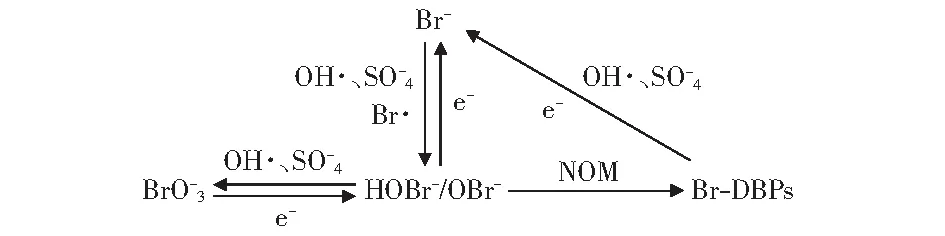
图4 电活化PDS体系中含溴副产物转化路径
2.3 初始PDS浓度对含溴副产物形成的影响
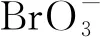
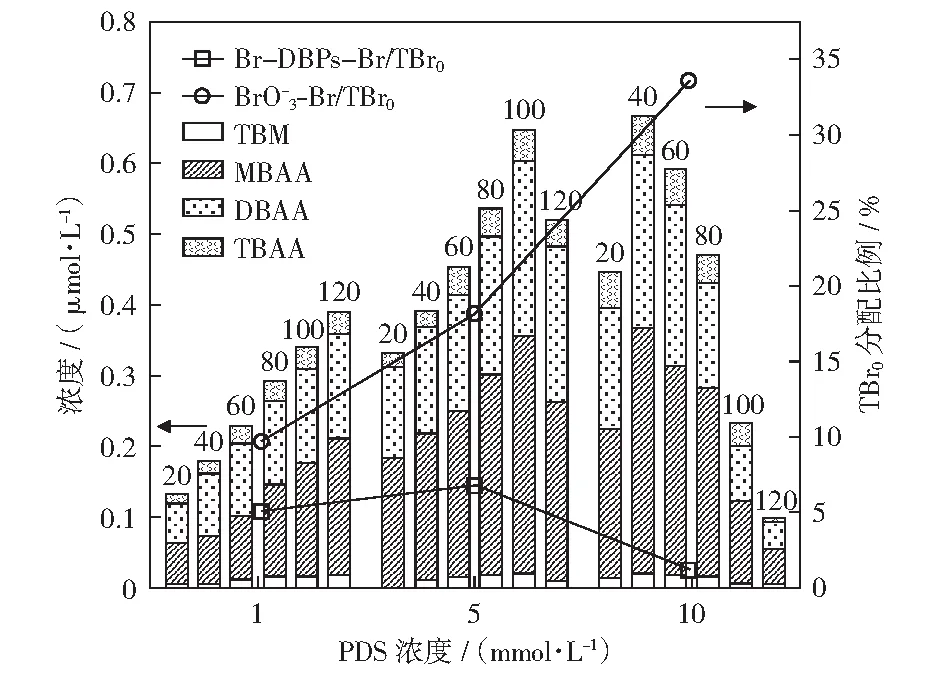
注:堆积柱状图上方数字为反应时间(min);TBr0(初始总溴)分配比例反应时间为120 min;反应条件:ρ0[Br-]=1.0 mg/L、pH=7.0、J=20 mA/cm2
2.4 电流密度对含溴副产物形成的影响
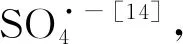
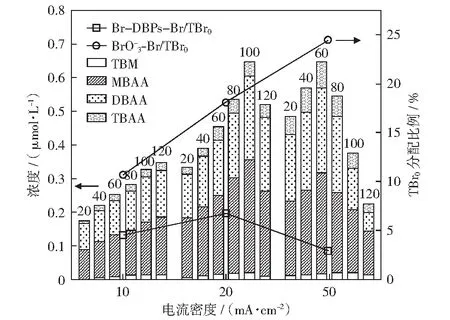
注:堆积柱状图上方数字为反应时间(min);TBr0分配比例的检测时间为120 min时;反应条件:ρ0[Br-]=1.0 mg/L、c0[PDS]=5.0 mmol/L、pH=7.0
H2O→2H++0.5O2↑+2e-.
(5)
2H2O+2e-→2OH-+H2↑ .
(6)
2.5 初始pH值对含溴副产物形成的影响
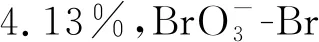
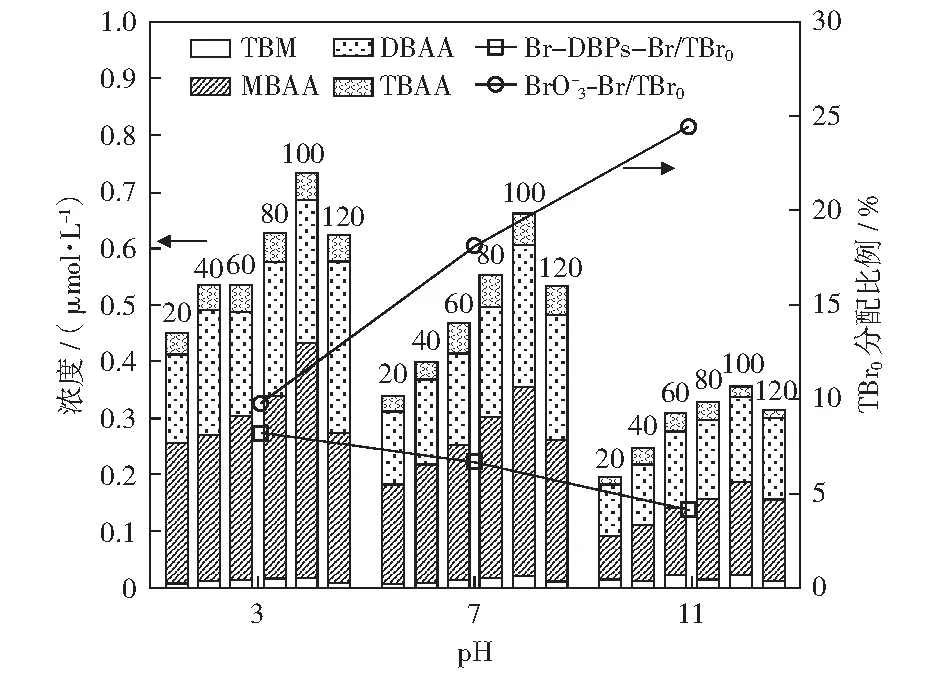
堆积柱状图上方数字为反应时间(min);TBr0分配比例反应时间为120 min;反应条件:ρ0[Br-]=1.0mg/L、c0[PDS]=5.0 mmol/L、J=20 mA/cm2
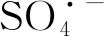
不同pH值条件下,4种有机副产物分布规律基本相同。但TBM的浓度总体上随着pH值增大而增大(碱性时,TBM占Br-DBPs的3.8%,高于酸性时的1.4%).这是因为溴仿反应可能同氯仿反应相似,属于碱催化反应[24],碱性更利于TBM的生成。弱酸性的HA在碱性条件下羧基离解程度更高[25],因而在较低的pH值下,表现出更高的HAAs生成潜力。
3 结论
2) 增大PDS投加量、提高活化电流密度,均可一定程度增加溶液内活性物质的生成量,提升电活化体系的氧化能力,从而加速Br-DBPs生成并同步矿化的反应过程。高电流密度下,阴极还原作用对于副产物分布的影响也会加剧,但过高的槽电压也会降低体系的电化学效率。在实际应用中,减小PDS投加量,降低电流密度可以抑制含溴副产物的生成,但是同时也会对有机物的矿化效率造成影响。因此,应结合处理效率、运行成本、副产物毒性分布等因素综合分析,合理设定PDS投加量及电流密度。

