急性递增负荷跑台运动对小鼠腓肠肌自噬和葡萄糖转运功能的影响
王平 Chun-Guang LI 崔迪 丁树哲
1 杭州师范大学体育与健康学院(杭州311121)
2 Western Sydney University NICM Health Research Institute(Penrith NSW 2751)
3 湖南大学体育学院(长沙410082)
4 华东师范大学青少年健康评价与运动干预教育部重点实验室(上海200241)
骨骼肌不仅是机体运动的主要器官,也是葡萄糖转运及利用的主要场所,骨骼肌细胞糖代谢的变化对于整个机体糖代谢的平衡和稳态至关重要,也是维持骨骼肌健康乃至整个机体健康的重要前提[1]。运动刺激可使骨骼肌细胞糖代谢发生适应性变化。已有研究报道,急性运动使野生型小鼠骨骼肌的葡萄糖吸收明显增加、葡萄糖转运体4(glucose transporter 4,GLUT4)转位(从细胞浆转到细胞膜)明显增加[2]。游泳运动明显降低2 型糖尿病大鼠空腹血糖,增加腓肠肌GLUT4蛋白表达,改善口服糖耐量水平[3]。耐力运动可明显增加代谢综合征患者(2 型糖尿病高危人群)股外侧肌GLUT4 蛋白表达[4]。运动有助于改善机体糖代谢平衡,有效预防胰岛素抵抗、2型糖尿病、高胰岛素血症等代谢相关性疾病的发生和发展[5]。但其分子机制尚不清楚。
近些年研究发现,运动可适度激活自噬,是维持运动过程中骨骼肌细胞代谢和能量稳定,及时清除和回收胞浆中聚集代谢废物的重要机制[1]。自噬的激活可能是介导运动改善胰岛素抵抗等骨骼肌糖代谢紊乱的重要机制之一[6]。Guo等[7]探讨了自噬与胰岛素抵抗之间的关系,将糖尿病大鼠足细胞小干扰RNA(small in⁃terfering RNA,siRNA)靶向沉默GLUT4基因,结果发现GLUT4 siRNA 导致糖尿病足细胞Ⅱ型微管相关蛋白1轻链3(type Ⅱ microtubule-associated protein light chain,LC3Ⅱ)表达显著增加,提示GLUT4 对于自噬活性必不可少。反之,He等[2]的研究也发现,自噬基因缺陷(BCL2AAA,Thr69/Ser70/Ser84 磷酸化位点缺失)小鼠在运动后腓肠肌GLUT4 转位下降、腓肠肌葡萄糖吸收减少,高脂膳食小鼠胰岛素抵抗和糖代谢紊乱加重。然而,到目前为止,运动激活自噬在骨骼肌糖代谢中的分子机制尚不完全明确,因此,本研究采用急性递增负荷跑台运动小鼠模型,观察运动后0 h、6 h、12 h 和24 h 小鼠血糖、腓肠肌肌糖原含量、GLUT4 mRNA 和蛋白表达及腓肠肌自噬相关基因13(autophagy-relat⁃ed gene 13,Atg13)、自噬相关蛋白p62(autophagy as⁃sociated protein p62,p62)、溶酶体相关膜蛋白2(lyso⁃some-associated membrane protein2,LAMP2)和微管相关 蛋 白1 轻 链3(microtubule-associated protein 1 light chain 3,LC3)mRNA 和蛋白表达的变化,以及GLUT4 蛋白表达与骨骼肌自噬相关因子LC3Ⅱ和LAMP2 蛋白表达之间的相关性分析,进一步探讨运动改善骨骼肌葡萄糖转运功能的分子机制,预期成果将进一步阐明运动激活自噬是维持骨骼肌葡萄糖稳态的一种重要的作用机制,为运动改善骨骼肌糖代谢异常的调控机制提供理论依据。
1 材料与方法
1.1 实验动物与分组
4 周龄ICR(Institute for Cancer Research)雄性健康清洁级小鼠,由上海斯莱克动物实验中心提供,生产许可证号:SCXK(沪)2007- 0005,使用许可证号:SYXK(沪)2004-0001,常规分笼饲养,5 只/笼,自由摄食、自由饮水。小鼠购买后,适应性喂养3 天,然后随机分为安静对照组(Con 组)和急性递增负荷跑台运动组,随后急性递增负荷跑台运动组小鼠根据运动后恢复时间再次分为运动后即刻组(0 h组)、运动后6 h组(6 h 组)、运动后12 h 组(12 h 组)和运动后24 h 组(24 h组),每组6只。
1.2 运动方案
急性递增负荷跑台运动组小鼠先进行适应性训练3 天(坡度为 0℃,速度为 15 m/min,持续 30 min/day)。正式运动参照Bedford 方案[8],具体如下:1 级负荷为坡度0°,速度8.2 m/min,相当于53%VO2max,持续时间15 min;2 级负荷为坡度5°,速度15 m/min,相当于64%VO2max,持续时间15 min;3 级负荷为坡度10°,速度19.3 m/min,相当于76%VO2max,持续至力竭。在运动过程中为了保持运动强度,采用毛刷刺激,使小鼠的运动始终保持在跑道前1/3 。在小鼠不能继续坚持原来的速度,且毛刷刺激驱赶无效,停止运动后表现为俯卧位,对刺激反应迟缓、呼吸急促,神情冷漠,此时判断为运动力竭[9]。实验整个过程中,分别记录和计算每只小鼠跑到力竭的时间和距离,平均力竭时间为173.83 ± 13.75 min,平均距离为3.25 ± 0.91 km。
1.3 取材
运动组小鼠在运动力竭后对应的时间点采用脱颈椎法处死小鼠,迅速从心脏取血放于1.5 ml离心管(放在冰盒)静置30 min,以3000 r/min转速离心5 min,然后以10000 rpm 的转速离心10 min,离心过程采用低温离心机(温度为4℃),然后用移液器取出上清液,标记好放置于-80℃冰箱保存用于生化测试;同时迅速取出腓肠肌,称重,标记好放入冻存管,置于液氮中,随后转入-80℃冰箱,用于生化和基因表达测试,安静对照组小鼠在安静状态取材。
1.4 血糖和腓肠肌肌糖原的测定
血清葡萄糖采用葡萄糖氧化酶法,试剂盒购自南京建成生物有限公司;腓肠肌肌糖原采用比色法,试剂盒购自武汉博士德生物公司,检测时具体操作严格按照说明书进行。
1.5 实时荧光定量PCR
冰上取腓肠肌约40 mg,在液氮中研磨后加入1 ml TRizol,采用Invitrogen Trizol 法提取腓肠肌总RNA,紫外分光光度计检测和计算总RNA 的OD260/OD280 值,采用TOYOBO FSQ101 反转录试剂盒逆转录合成cDNA,ABI StepOne 型实时荧光定量PCR测定Atg13、LAMP2、LC3、p62 和GLUT4 的mRNA 表达量,荧光染料为TOYOBO QPK201 SYBR GREEN。根据PCR 仪给出各反应孔的Ct 值,以β-actin 为内参,据公式2-ΔΔCt计算各样品目的基因的相对表达量,引物由上海生物工程有限公司设计并合成,引物序列见表1。

表1 基因引物序列
1.6 免疫印迹法(Western Blot)
取腓肠肌约50 mg 在冰上剪碎放入研磨管中,加入RIPA裂解液于OMINI Bead Ruptor 24 型磁珠匀浆机匀浆,然后15000 rpm离心15 min取上清,用BCA法进行蛋白定量后,使用空白裂解液稀释样本至统一浓度,然后加5×上样缓冲液,混匀,95℃加热5分钟,冷却后待用。电泳时,上样量总蛋白为30 μg。依据目的蛋白的分子量制备分离胶浓度为8%、10%或12%,采用湿转法将蛋白转至PVDF 膜;转膜后将膜使用5%脱脂奶粉封闭1 h。用1% BSA/PBST 稀释一抗(Atg13 1︰1000,Cell Signaling Technology,USA;LAMP2 1︰1000,Santa Cruz Biotechnology,Inc.;p62 1︰1000,Santa Cruz Biotechnology,Inc.;LC3Ⅱ1︰1000,Santa Cruz Biotechnology,Inc.;LC3Ⅰ 1︰1000,Santa Cruz Biotechnology,Inc.;GLUT4 1︰1000,Santa Cruz Bio⁃technology,Inc.;和β-tubulin 1︰1000,Santa Cruz Bio⁃technology,Inc.),4℃孵育过夜。次日,PBST 洗涤3 次,每次10 min,然后加入HRP 标记二抗(1︰5000,Pro⁃teintech)室温孵育2 h,PBST 洗涤3 次后显影,显影试剂盒为Millipore ECL 超敏试剂盒,凝胶成像系统(Al⁃phaFC2型)进行冷光扫膜,FluorChem FC2软件对捕捉图像进行灰度值分析,内参为β-tubulin。
1.7 数据统计
实验数据用GraphPad Prism5软件处理,每组数据采用均数±标准差(±s)表示,多组间比较采用单因素方差分析(One-way ANOVA);相关性分析采用线性回归,计算相关系数r和P值。P<0.05 表示差异具有统计学意义。
2 结果
2.1 急性递增负荷跑台运动对小鼠腓肠肌自噬相关基因Atg13、LC3Ⅱ、LC3Ⅱ/LC3Ⅰ、p62 和LAMP2 的蛋白和mRNA表达的影响
与Con 组相比,运动后0 h 组、6 h 组、12 h 组和24 h组小鼠腓肠肌Atg13蛋白表达均未出现显著性差异(P>0.05);运动后0 h组腓肠肌Atg13 mRNA表达显著增加(P<0.01),而6 h 组、12 h 组和24 h 组腓肠肌Atg13 mRNA 表达均未出现显著性差异(P>0.05)(图1)。

图1 各组小鼠腓肠肌自噬相关基因Atg13表达变化
与Con组相比,运动后0 h组小鼠腓肠肌LC3Ⅱ蛋白表达和LC3Ⅱ/LC3Ⅰ均显著增加(P<0.01),6 h 组、12 h组和24 h组LC3Ⅱ蛋白表达和LC3Ⅱ/LC3Ⅰ蛋白表达均未出现显著性差异(P>0.05);运动后0 h组小鼠腓肠肌LC3 mRNA 表达显著增加(P<0.05),虽然6 h组、12 h 组和24 h 组腓肠肌LC3 的mRNA 表达均出现上升趋势,但均未出现显著性差异(P>0.05)(图2)。

图2 各组小鼠腓肠肌自噬相关基因LC3Ⅱ和LC3Ⅱ/LC3Ⅰ表达变化
与Con 组相比,运动后0 h 组、6 h 组、12 h 组和24 h 组小鼠腓肠肌LAMP2 蛋白表达均未出现显著性增加(P>0.05);运动后0 h 组腓肠肌LAMP2 mRNA 表达极显著增加(P<0.01),6 h组、12 h组和24 h组腓肠肌LAMP2 mRNA 表达均未出现显著性差异(P>0.05)(图3)。

图3 各组小鼠腓肠肌自噬相关基因LAMP2表达变化
与Con组相比,运动后0 h组、12 h组和24 h组小鼠腓肠肌p62 蛋白表达均显著下降(P<0.01 或P<0.05),6 h 组腓肠肌p62 蛋白表达未出现显著性差异(P>0.05);运动后24 h 组小鼠腓肠肌p62 mRNA 表达极显著增加(P<0.01),0 h 组、6 h 组和12 h 组腓肠肌p62 mRNA表达均未出现显著性差异(P>0.05)(图4)。
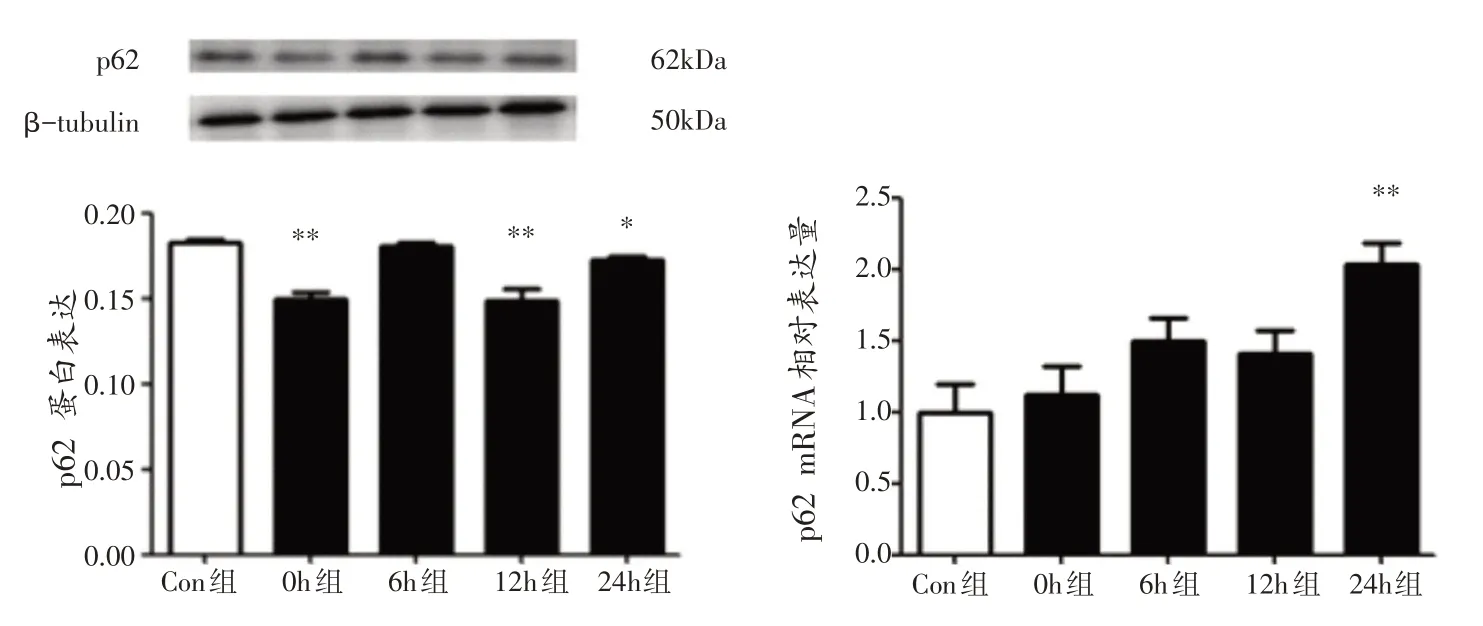
图4 各组小鼠腓肠肌自噬相关基因p62表达变化
2.2 急性递增负荷跑台运动对小鼠腓肠肌GLUT4 蛋白和mRNA表达的影响
与Con组相比,运动后6 h组、12 h组和24 h组小鼠腓肠肌GLUT4 mRNA 和GLUT4 蛋白表达均出现显著性增加(P<0.05 或P<0.01),但0 h 组腓肠肌GLUT4 mRNA 和GLUT4 蛋白表达均未出现显著性变化(P>0.05)(图5)。
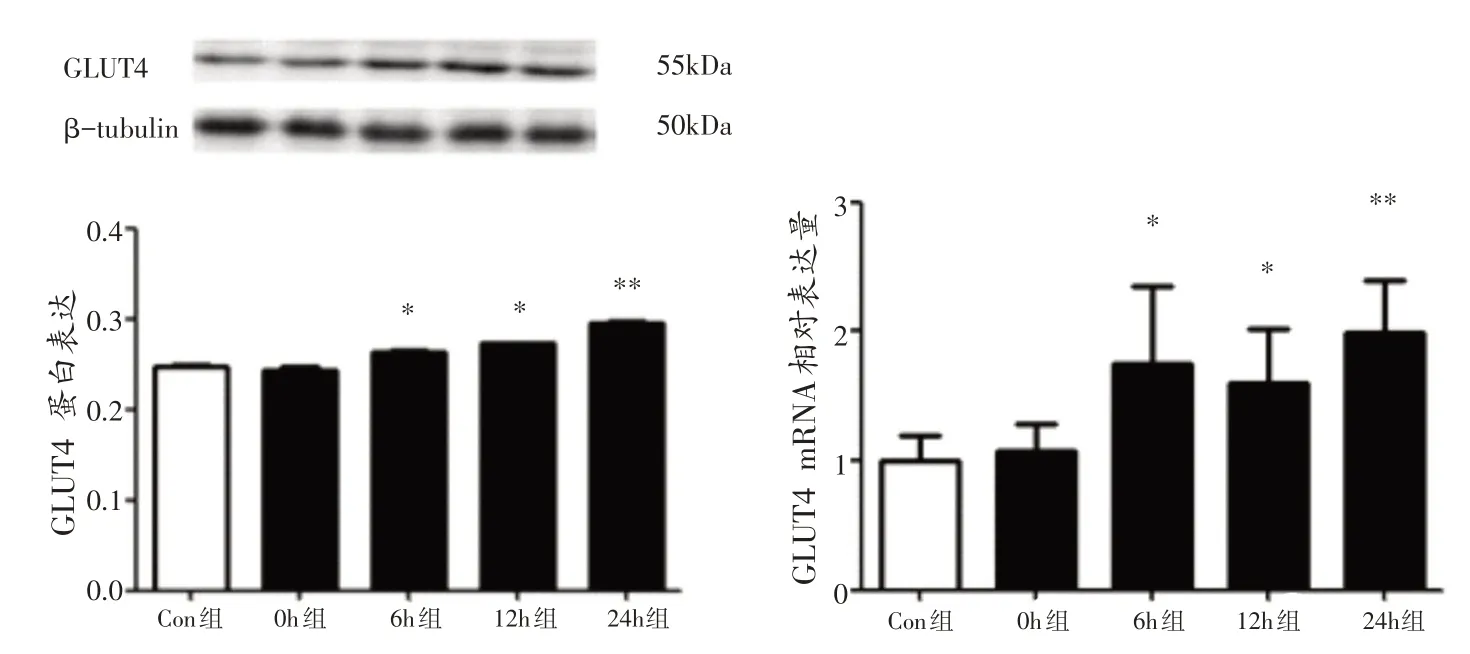
图5 各组小鼠腓肠肌GLUT4表达变化
2.3 急性递增负荷跑台运动对小鼠血糖和腓肠肌肌糖原含量的影响
与Con 组相比,运动后0 h 组、6 h 组、12 h 组和24 h组血糖均出现极显著下降(P<0.01),0 h组下降尤为明显,随后恢复期血糖水平逐渐回升,恢复到12 h达到最高水平;运动后0 h 组、6 h 组腓肠肌肌糖原含量均显著下降(P<0.01),但12 h组和24 h组腓肠肌肌糖原含量均未出现显著性差异(P>0.05)(图6)。

图6 各组小鼠血糖和腓肠肌肌糖原含量的变化
2.4 GLUT4 与自噬相关基因LC3Ⅱ和LAMP2 的相关性分析
小鼠腓肠肌GLUT4 蛋白表达分别与LC3 Ⅱ、LAMP2 蛋白表达之间呈正相关(r=0.6709,P<0.01;r=0.5705,P<0.01)(图7)。
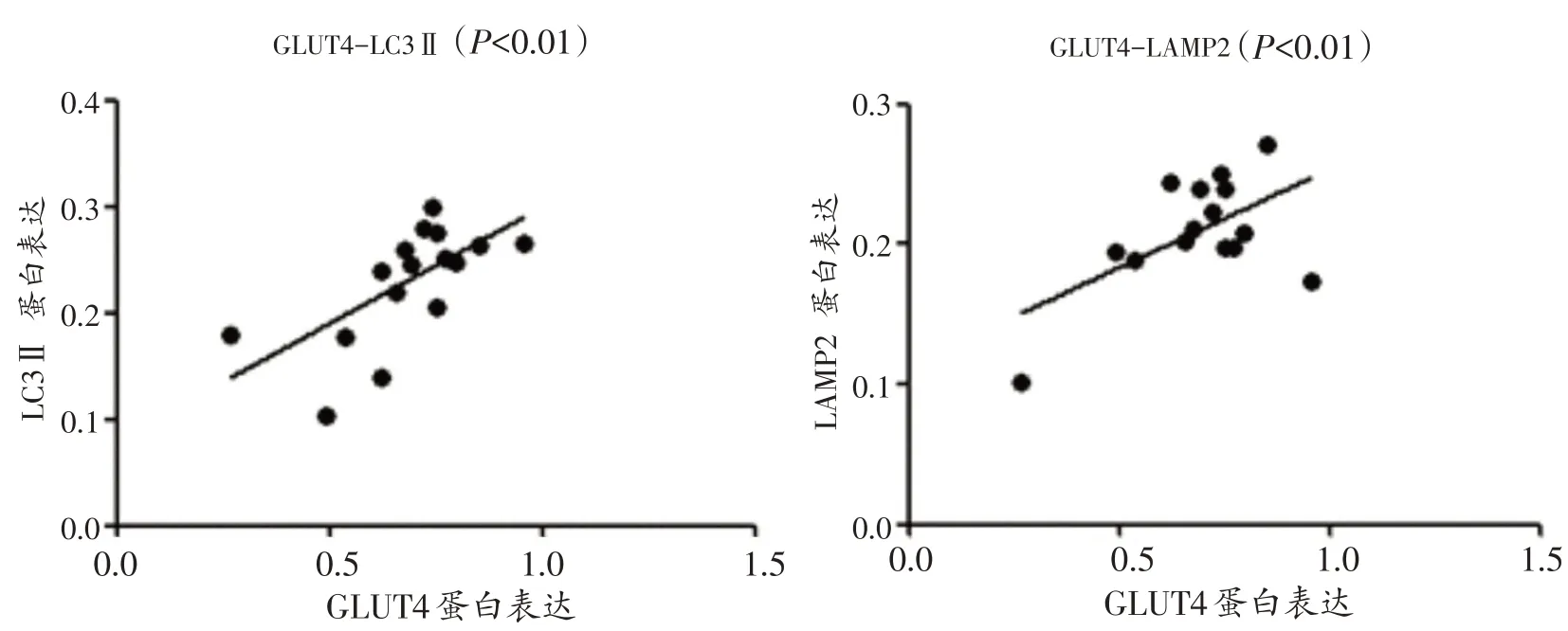
图7 小鼠腓肠肌GLUT4蛋白表达分别与LC3Ⅱ、LAMP2蛋白表达之间的相关性分析
3 讨论
3.1 运动对骨骼肌自噬相关因子LC3Ⅱ、LC3Ⅱ/LC3Ⅰ、p62、Atg13和LAMP2表达的影响
自噬对于细胞的存活、分化、发育和细胞内动态平衡至关重要,是细胞内质量控制和维持细胞能量和氨基酸稳态的一种重要机制[10,11]。自噬的功能依赖于细胞质中的自噬体[6]。自噬体的标志性蛋白是LC3,它的来去是一个动态过程:LC3 在羧基端(carboxyl termi⁃nus,C 端)被自噬相关基因4(autophagy related gene 4,Atg4)剪切,形成LC3Ⅰ,LC3Ⅰ通过自噬相关基因7(autophagy related gene 7,Atg7)和自噬相关基因3(autophagy related gene 3,Atg3)分别在泛素活化酶(ubiquitin-activating enzyme,E1)和泛素结合酶(ubiq⁃uitin-conjugating enzyme,E2)的作用下被泛素化,与磷脂酰乙醇胺结合,生成LC3Ⅱ,附着在自噬体膜上,成为哺乳动物自噬体形成的生化标志物[12]。而且LC3Ⅱ/ LC3Ⅰ已被广泛作为间接检测自噬体形成的生化标志物[13]。已有研究发现急性跑台运动的小鼠,当运动到60~90 min 时,其腓肠肌LC3Ⅱ蛋白表达明显增加[14]。Liu[15]等也发现1 小时的急性跑台运动使小鼠骨骼肌LC3Ⅱ表达明显增加,60~120 min的急性跑台运动可使小鼠骨骼肌LC3Ⅱ/LC3Ⅰ显著增加。本研究结果显示,递增负荷跑台运动力竭后即刻(0 h)小鼠腓肠肌LC3Ⅱ的mRNA、蛋白表达和LC3Ⅱ/LC3Ⅰ蛋白表达均显著增加,提示急性运动可激活自噬体的形成过程,LC3Ⅱ的表达或LC3Ⅱ/LC3Ⅰ可以作为运动后即刻自噬反应的敏感指标,而运动后恢复期的6 h、12 h 和24 h 均未发生显著变化。但也有相反的报道,有人将ICR 小鼠进行50 min 急性跑台运动(速度为12.3 m/min,坡度为5°),结果发现LC3Ⅱ蛋白表达在运动后即刻(0 h)未显著增加,但在运动后恢复期的3 h、6 h和12h 均显著降低[16];也有人以50%VO2max 的强度进行急性跑台运动,当跑到30 min 甚至120 min 后即刻(0 h)都未见小鼠腓肠肌LC3Ⅱ/LC3Ⅰ的蛋白表达增加[17]。分析造成上述结果不一致的原因,可能是由于运动强度的不同、运动持续时间不同和运动后恢复期取材时间的不同造成的。Fritzen 等为了排除LC3Ⅱ蛋白表达和LC3Ⅱ/LC3Ⅰ未发生变化是由于肌肉运动不足造成的,采用超级电生理刺激甚至剧烈的电刺激反复刺激肌肉,结果发现腓肠肌LC3Ⅱ蛋白表达和LC3Ⅱ/LC3Ⅰ还是未发生显著变化,故质疑只用LC3Ⅱ蛋白表达作为肌肉受到机械刺激变化的唯一指标的合理性,建议增加双荧光mRFP-eGFP-LC3自噬指示体系[18],以便更有利于监测运动诱发的自噬[17]。
需要强调的是,自噬体的含量不仅与自噬体的形成有关,还与溶酶体降解有关[13]。p62是一种反应自噬溶酶体降解的蛋白,可与LC3直接结合,募集其他蛋白质进入自噬溶酶体进行降解过程,p62蛋白表达下降提示自噬活性增加[19]。Lenhare[20]等研究发现,急性游泳运动明显降低老年小鼠腓肠肌p62蛋白表达。He也报道,一次性力竭跑台运动使小鼠腓肠肌p62 蛋白表达显著下降[21]。本研究结果显示,一次性力竭运动后0 h p62 蛋白表达显著下降,于运动后6 h 出现短暂回升、然后于12 h 一直持续到24 h 均维持在低水平状态,提示p62 蛋白对急性运动反应早,且延续时间较长,可作为一次性力竭运动后反应自噬活性的敏感性指标。但p62 mRNA 表达于运动后24 h 出现显著增加,与蛋白表达不一致,分析其原因可能与启动子激活或增强子激活,或与上游转录因子激活有关[22]。但关于其分子机制还需要进一步研究。
本研究中为了进一步监测自噬发生的变化,我们还检测了腓肠肌自噬基因Atg13表达。结果发现,急性递增负荷跑台运动后0 h 小鼠腓肠肌Atg13 mRNA 表达显著增加。自噬因子Atg13 是自噬体膜发生和形成的关键基因,与unc-51 样自噬激活激酶1(unc-51 like autophagy activating kinase 1,ULK1)和分子量大小为200 kD 的黏着斑激酶家族相互作用蛋白(focal adhesion kinase family interacting protein of 200 kDa,FIP200)共同形成复合物,负责自噬的启动过程[23]。正常情况下,磷酸化的哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)阻止ULK1、FIP200 与Atg13 形成复合物,抑制自噬活性[23],但运动可使mTOR 的磷酸化水平下降,促进ULK1、FIP200 与Atg13复合物的形成,激活腓肠肌自噬[24]。但本研究结果显示急性递增负荷运动并没有使腓肠肌Atg13 的蛋白表达出现显著变化,分析Atg13 mRNA 和蛋白表达不一致的可能原因:(1)为了避免自噬其他相关基因的耗竭,Atg13 基因在转录延伸阶段发生了部分消耗[25];(2)与复杂的生物学过程有关,譬如转录剪接、转录后剪接,翻译修饰,翻译调控和蛋白质复合物的形成等均可能影响mRNA 和蛋白质的相对表达[26],因此急性运动对腓肠肌Atg13表达的影响还需要进一步探索。
LAMP2是位于溶酶体膜且含量最高的一种特异蛋白,其作用在自噬起始阶段诱导自噬的发生、在自噬溶酶体阶段负责降解过程[27]。已有研究发现,抗阻运动明显增加老年人外周血单核细胞自噬相关基因LAMP2、自噬相关蛋白12(autophagy related protein 12,Atg12)和自噬相关基因16(autophagy related gene,Atg16)蛋白表达,增强自噬,改善老年人抗炎和抗凋亡能力[28];耐力运动明显增加老年人神经元LAMP2 的蛋白表达,减弱老年人神经退行性改变,改善老年痴呆症状[29],耐力运动可明显增加腓肠肌LAMP2 mRNA 表达,增强腓肠肌自噬,降低大鼠高血压[30]。但也有相反的报道,有氧运动(80%~85%最大心率的强度)并没有使老年人和青年人外周血单核细胞自噬相关基因LAMP2蛋白表达发生明显变化[31]。目前急性运动对腓肠肌LAMP2 蛋白表达的研究较少,本研究结果显示,急性递增负荷跑台运动后0 h 小鼠腓肠肌LAMP2 mRNA表达增加,但LAMP2蛋白表达未出现显著变化,可能原因:(1)由mRNAs 和蛋白的稳定性和生产效率不同造成的[32];(2)与转录或转录后的蛋白调控有关。已有文献报道,同一基因的mRNA 和蛋白表达不一定同步[33],同步率只达到0.46~0.68[34]。
3.2 运动激活自噬对小鼠骨骼肌葡萄糖转运功能的影响
众所周知,Glut4(又称Slc2a4)基因主要存在于人类骨骼肌中,GLUT4蛋白是一种跨膜蛋白,是骨骼肌摄取葡萄糖的主要转运体,也是维持机体葡萄糖稳态的关键因素[35,36]。目前研究证实,2型糖尿病小鼠中,骨骼肌GLUT4 蛋白表达下降,葡萄糖摄取和利用能力下降[37]。腓肠肌Glut4过表达转基因小鼠可明显增加腓肠肌葡萄糖摄取和利用能力,拮抗胰岛素抵抗[38],提示Glut4基因是抑制腓肠肌胰岛素抵抗的关键基因,增强Glut4基因表达对于防治胰岛素抵抗具有重要意义。有趣的是,最近有研究发现,自噬可调控GLUT4 蛋白的转位(从细胞质转位于细胞膜)和GLUT4 储存囊泡的释放[39],因此,通过自噬过程靶向调节GLUT4的转位和再循环对于预防和治疗2 型糖尿病至关重要。Yang[40]研究发现,自噬基因缺陷小鼠骨骼肌细胞膜GLUT4 表达下降、葡萄糖吸收减少、葡萄糖耐受降低、高脂膳食小鼠胰岛素抵抗和糖代谢紊乱加重。He[2]也发现腓肠肌特异性自噬缺陷小鼠GLUT4的转位明显下降,且葡萄糖耐受降低,糖代谢紊乱,更值得注意的是,不管是急性运动还是耐力运动均不能改善由于自噬缺陷导致的糖代谢紊乱,甚至加重糖代谢紊乱。因此,自噬对于运动过程中骨骼肌糖代谢稳定是必须的。本研究结果显示,急性递增负荷跑台运动后6 h 腓肠肌GLUT4 mRNA 和蛋白表达均出现显著性增加,此效应一直持续到运动后24小时,提示急性运动引起的GLUT4蛋白表达反应相对滞后但持续时间相对较长。结合上述本研究结果腓肠肌自噬基因LC3II、LC3Ⅱ/LC3Ⅰ、Atg13和LAMP2表达明显增加或p62蛋白表达明显下降的时间均为急性运动后0 h,提示急性运动触发腓肠肌自噬相关基因的表达明显早于GLUT4 的表达,但持续时间较短,推测也许运动源性自噬是运动促进骨骼肌葡萄糖转运功能增强的一种分子机制。同时,我们还发现,腓肠肌GLUT4 蛋白表达与自噬相关基因LC3 Ⅱ、LAMP2 蛋白表达呈正相关,提示自噬相关因子LC3Ⅱ和LAMP2 的蛋白表达可能与骨骼肌葡萄糖转运功能有关。关于自噬与葡萄糖转运功能的分子生物学机制还需要进一步研究。
另外,本研究还发现,运动后0 h血糖含量显著降低,血糖降低一直持续到恢复后24 h,血糖降低的趋势基本与骨骼肌GLUT4 表达增加的趋势一致。这提示,运动过程中,一方面运动促进骨骼肌GLUT4表达,将血液中更多的葡萄糖摄入细胞内,维持骨骼肌能量需求[41];另一方面运动激活自噬,自噬进一步促进GLUT4的表达,增强葡萄糖摄取入细胞内,血液葡萄糖下降[42]。同样,在运动过程中,肌糖原也是糖类化合物(carbohy⁃drate ,CHO)代谢的主要来源[21],James 等[43]研究发现,一次性力竭跑台运动后0 h大鼠腓肠肌肌糖原含量显著下降。本研究结果也显示,运动后0 h 小鼠腓肠肌肌糖原含量显著降低。提示,一次性力竭运动中肌糖原分解供能,这样既能满足骨骼肌运动时大量能量的需求,又有助于骨骼肌迅速按照细胞需求调整ATP 的合成速率和能量底物的种类,为骨骼肌能量代谢提供稳定的能源物质,使骨骼肌具有很高的能量代谢可塑性,很快适应环境变化,增强骨骼肌功能,有利于整个机体健康[44]。
4 小结
急性递增负荷跑台运动可明显增加小鼠腓肠肌自噬相关基因Atg13、LAMP2 和LC3 mRNA 表达、LC3Ⅱ和LC3Ⅱ/LC3Ⅰ蛋白表达、明显降低p62 蛋白表达,增强骨骼肌自噬;不同自噬指标对运动的反应时间和激活后延迟的时间基本一致;急性递增负荷跑台运动明显提高小鼠腓肠肌葡萄糖转运功能,腓肠肌葡萄糖转运功能的增加与自噬相关因子LC3Ⅱ和LAMP2蛋白的表达显著正相关。这种运动和骨骼肌自噬的关联可能是急性运动调节小鼠骨骼肌葡萄糖转运功能的重要分子机制之一。

