脂肪干细胞成骨分化的潜在关键基因与信号通路▲
李兴艳 杨业静 黄家志 代万武 黄祖权 杜勇军
(广西医科大学第三附属医院关节外科,南宁市 530031,电子邮箱:448445226@qq.com)
脂肪干细胞(adipose-derived stem cells,ADSCs)是从脂肪组织中分离出的一种具有多向分化潜能的干细胞,主要具有恢复组织细胞、促进细胞再生的作用,可有效改善亚健康、早衰等疾病,抵抗衰老[1]。此外,ADSCs因其具有来源充足、取材容易等优点,已成为骨组织工程研究的热点。但ADSCs成骨分化的分子生物学机制目前仍未完全阐明[2]。随着大数据及生物信息学的快速发展,以及ADSCs在临床医学领域的应用[3],已有一些学者针对ADSCs成骨分化进行了RNA芯片及测序研究,以进一步探讨这些RNA在ADSCs成骨分化过程中所发挥的分子生物学机制。因此,本研究应用生物信息学方法筛选ADSCs成骨分化过程中的差异表达基因及其涉及的信号通路,以探讨ADSCs成骨分化过程中潜在的关键基因所发挥的分子生物学机制。
1 材料和方法
1.1 基因表达谱芯片的搜索 利用NCBI平台下的GEO数据库(https://www.ncbi.nlm.nih.gov/geo/),检索与ADSCs成骨分化相关的基因数据集,在检索结果中选择GSE63754[4]数据进行挖掘。GSE63754是由国外学者使用Agilent-039494 SurePrint G3 Human GE v2 8x60K Microarray 039381探针测定6个ADSCs成骨分化相关样本的mRNA表达谱,包括3个ADSCs样本和3个成骨细胞样本[5]。
1.2 数据处理及差异表达基因分析 对数据进行整理及优化,如出现同名基因不同表达量时取均值,同时将数据进行对数变换(log2)使得数据服从正态分布。随后将数据分为成骨细胞组(实验组)和ADSCs组(对照组),利用R语言的Limma软件包(版本号:3.12)对数据进行归一化处理后进行差异表达基因分析。选取adjP值<0.05、|logFC|>2的基因作为候选差异表达基因。
1.3 蛋白质相互作用网络的构建及其转录因子预测 将差异表达基因所对应的蛋白上传至STRING数据库(版本号:11.0),选取打分值(基因或者蛋白之间最低互动得分)>0.4的数据,构建蛋白质相互作用(protein-protein interaction,PPI)网络,并利用Cytoscape软件(版本号:v3.7.1)将PPI网络可视化。同时,使用iRegulon软件(版本号:1.3)对PPI网络内的基因进行转录因子富集预测,将标准化富集分数(normalized enrichment score,NES)排名前5的转录因子进行可视化。
1.4 关键基因的筛选 为了进一步筛选与ADSCs成骨分化过程相关的潜在关键基因,使用cytoHubba插件(版本号:v3.7.1)中的Degree算法对PPI网络进行重要模块分析。选择Degree排名前6的基因作为与ADSCs成骨分化过程相关的潜在关键基因。
1.5 关键基因的功能和通路富集分析 采用clusterProfiler包(版本号:3.12)对关键基因进行基因本体论(Gene Ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路富集分析。根据adjP值<0.05进行筛选。
2 结 果
2.1 数据预处理及差异分析 将GSE63754数据预处理后各基因的表达均一化(见图1A和图1B),得到32 055个基因的表达矩阵(图2)。经过差异表达基因分析后,筛选出556个差异表达基因,其中228个基因在成骨细胞组处于上调水平,而另228个基因在ADSCs组处于下调水平。在这些差异表达基因中选取上下调最明显的100个基因(在ADSCs成骨分化过程中50个上调的基因和50个下调的基因)绘制热图(见图2)。
图1 数据预处理结果注:A为预处理前的数据表达情况;B为处理后的基因表达情况,可知数据处于同一水平线,代表处理后的数据佳。
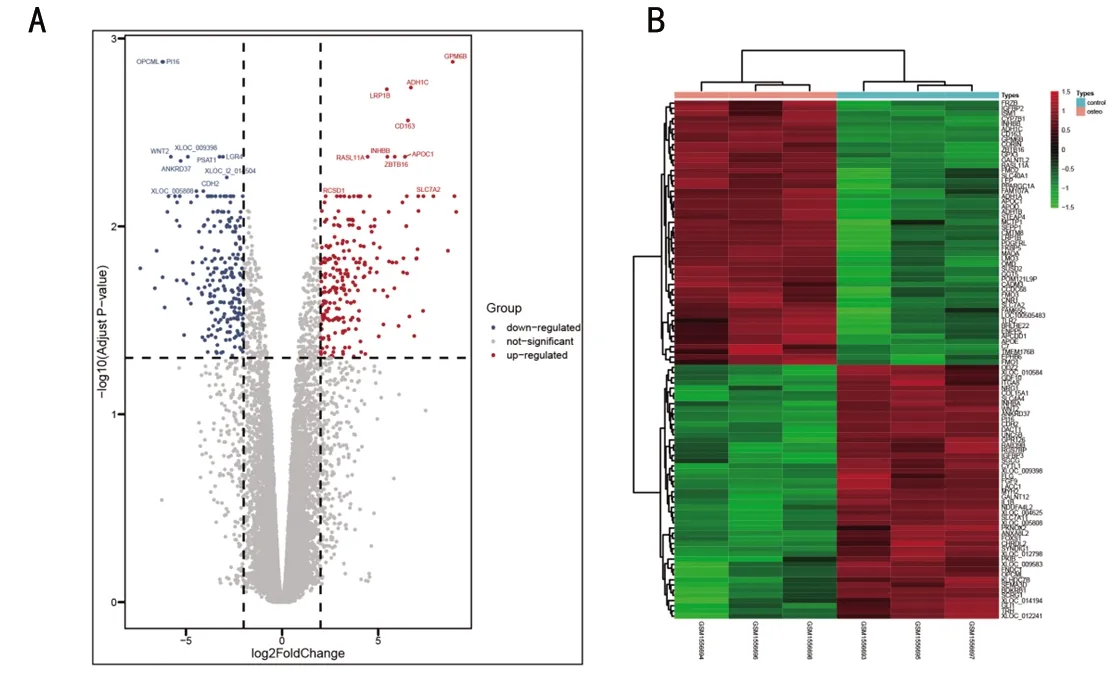
图2 差异表达基因分析结果注:A为火山图,红色代表在成骨细胞中上调,蓝色代表在成骨细胞中下调;B为热图,红色代表在成骨细胞中上调,绿色代表在成骨细胞中下调。
2.2 PPI网络及转录因子 通过STRING 11.0在线网络工具对556个差异基因进行PPI网络分析,排除242个无相互作用的蛋白,最后得到由314个节点、852条连接构成的PPI网络图。通过iRegulon插件对这些PPI网络里的基因进行转录因子预测,构建PPI和转录因子预测网络,预测出5个转录因子,包括ESRP1、PRKAA2、POU5F1B、ATF4HE和ZSCAN4(见图3),图中的蛋白与其他节点连线越多,表明该蛋白在该网络中越重要。
2.3 关键基因的筛选 Degree排名前6的关键基因分别是瘦素(leptin, LEP)、白细胞介素1β(interleukin 1β,IL1B)、成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)、钙黏蛋白1(cadherin 1,CDH1)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)和过氧化物酶体增生激活受体γ(peroxisome proliferative activated receptor gamma,PPARG)(见图3)。
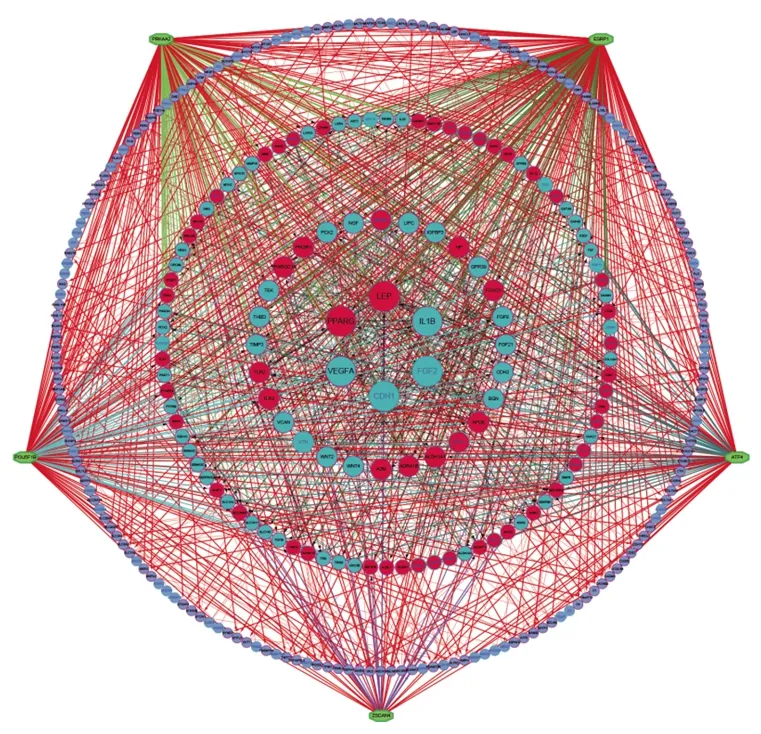
图3 PPI网络和转录因子预测图注:圆形代表基因,八边形代表转录因子,线条代表相互关联
2.4 功能和通路富集分析结果 LEP、IL1B、FGF2、CDH1、VEGFA和PPARG这6个关键基因主要富集在p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,并且可能与破骨细胞分化相关。见图4。
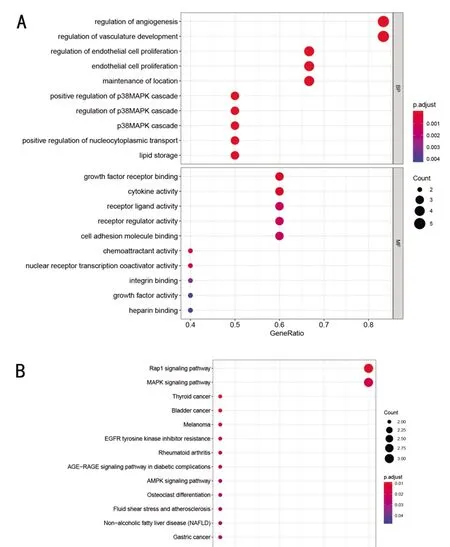
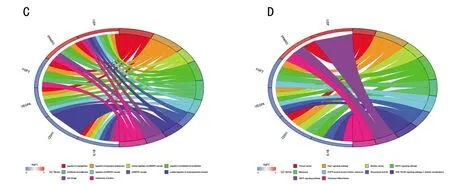
图4 ADSCs成骨分化过程相关的潜在关键基因的富集分析注:A为关键基因的GO富集分析图(前30);B为关键基因的KEGG信号通路富集分析图(前30);C为关键基因的GO富集分析结果中排名前10的GO条目;D为关键基因的KEGG富集分析结果中排名前10的信号通路。
3 讨 论
本研究共筛选出556个差异表达基因。最终发现LEP、IL1B、FGF2、CDH1、VEGFA和PPARG为ADSCs成骨分化过程相关的潜在关键基因,并且这些基因和信号通路主要富集在p38 MAPK信号通路上,可能与破骨细胞分化相关。
PPARG为过氧化物酶体增生激活受体γ的编码基因,其编码的过氧化物酶体增生激活受体γ可以与类维生素A受体结合形成二聚物,该二聚体可以与多种基因的特异DNA序列——过氧化物酶体增殖反应元件(peroxisome proliferators response element,PPRE)结合,从而激活基因的表达。PPARG主要与癌症、动脉粥样硬化、糖尿病和肥胖症相关[6],但尚未见有关PPARG调控细胞分化的研究。本研究结果表明PPARG可能是ADSCs成骨细胞分化过程中的潜在关键分子,但这只是通过生物信息学方法预测的结果,还有待体内外实验的进一步验证。
CDH1[7]、VEGFA[8]、FGF2[9]都是癌基因。CDH1基因编码E-钙黏蛋白,是一种钙依赖性细胞黏附蛋白,属于钙黏蛋白家族成员,CDH1基因参与调节细胞黏附、迁移和上皮细胞增殖,其功能缺失导致细胞更容易侵袭和转移,该基因的突变与胃癌、乳腺癌、结直肠癌、甲状腺癌和卵巢癌密切相关[10]。VEGFA基因是血小板衍生生长因子(platelet-derived growth factor,PDGF)/血管内皮生长因子(vascular endothelial growth factor,VEGF)家族的成员,是糖基化的有丝分裂原,除可特异性地作用于内皮细胞外,还具有多种作用,包括介导增加的血管通透性、诱导血管生成、血管发生和内皮细胞生长、促进细胞迁移和抑制细胞凋亡,其主要与糖尿病及动脉粥样硬化等微血管病变相关[11]。FGF2基因编码的蛋白是成纤维细胞生长因子家族的成员,具有广泛的促有丝分裂和血管生成活性,该蛋白与多种生物学过程有关,如肢体和神经系统发育、伤口愈合和肿瘤生长等。
值得注意的是,IL1B[12]、LEP[13]与炎症相关。本研究结果显示,两者是与ADSCs的成骨分化相关的潜在关键分子。因此,IL1B和LEP调控的炎症反应是否也参与了ADSCs的成骨分化有待进一步研究。
MAPK是一组丝氨酸-苏氨酸蛋白激酶,其能将信号从细胞外表面传导到细胞核的内部,能被不同的细胞外因子刺激所激活,如细胞黏附因子、神经递质因子、生长因子等。MAPK通路是一种较为保守的三级激酶模式,依次通过MAPK激酶激酶、MAPK激酶和MAPK激活下游信号,共同调节着细胞的炎症反应、对环境的应激适应、分化和生长等多种重要的细胞生理或病理生理过程。在调控细胞炎症反应方面,p38 MAPK在重症胰腺炎炎症反应中扮演重要角色[14];而在调控细胞生长、分化方面,p38 MAPK能够促进小鼠成骨细胞增殖、分化并抑制成骨细胞的凋亡[15]。本研究结果表明,p38 MAPK信号通路可能在ADSCs成骨分化的分子生物学过程中发挥着重要的作用,这与MAPK信号通路参与细胞生长、分化的作用一致。
综上所述,本研究通过对GEO 数据库中关于ADSCs成骨分化的相关数据进行挖掘,发现ADSCs成骨分化过程中潜在的关键基因及其涉及的通路。这或可为今后进一步开展实验研究,探索ADSCs成骨分化的发生、发展及分子生物学机制提供新的思路和依据。

