地黄化学成分和药理作用的研究进展
陈金鹏,张克霞,刘 毅,盖晓红,任 涛,刘素香,田成旺*
·综 述·
地黄化学成分和药理作用的研究进展
陈金鹏1, 2, 3,张克霞4,刘 毅1, 2, 3,盖晓红1, 2, 3,任 涛1, 2, 3,刘素香1, 2, 3,田成旺1, 2, 3*
1. 天津药物研究院,天津 300462 2. 天津市中药质量标志物重点实验室,天津 300462 3. 释药技术与药代动力学国家重点实验室,天津 300462 4. 天津药业研究院有限公司,天津 300462
地黄为我国民间传统植物药,有着久远的历史记载,主产于河南、河北、陕西、山西等地。其化学成分类型主要包括环烯醚萜类、紫罗兰酮类、苯乙醇苷类、三萜类、黄酮类及糖类等,对人体血液系统、心脑血管系统、中枢神经系统和免疫系统有显著作用。随着现代分离分析手段的不断创新,加之现代科学技术与药理学方法不断应用于地黄的药理作用及机理研究,近年来,地黄中的化学成分不断被发现,其药理作用进一步被开发,临床适用范围逐年扩大,引起了国内外科研工作者的热切关注。对地黄化学成分和药理作用的研究进展进行概述,旨在为传统中药地黄的进一步开发利用和现代化提供一定依据。
地黄;化学成分;环烯醚萜;紫罗兰酮;药理作用;降糖
地黄为玄参科(Scrophulariaceae)地黄属Libosch. ex Fisch. et Mey.植物地黄Libosch.的新鲜或干燥块根,始载于《神农本草经》,列为上品,是著名的“四大怀药”之一,至今已有千年的应用历史。地黄性寒,味甘、苦,归心、肝、肾经,具有滋阴补肾的功效,凡阴虚血虚肾虚者食之,颇有益处[1]。地黄依炮制方法不同,在药材上分为鲜地黄、生地黄和熟地黄[2]。地黄以鲜品入药习称鲜地黄,具有清热生津、凉血散瘀、解毒止痛等功效,用于热病伤阴、舌绛烦渴、发斑发疹、吐血、衄血、咽喉肿痛;将地黄缓缓烘焙至约八成干后入药习称生地黄,生地黄清热凉血、养阴和生津,用于热病舌绛烦渴、阴虚内热、骨蒸劳热、内热消渴、吐血、衄血和发斑发疹[1];将生地黄酒制再干燥后入药习称熟地黄,熟地黄滋阴补血、益精填髓,用于肝肾阴虚、腰膝酸软、骨蒸潮热、盗汗遗精、内热消渴,血虚萎黄、心悸怔忡、月经不调、崩漏下血、眩晕、耳鸣和须发早白[1]。地黄在我国药用历史悠久,且不同炮制品在临床上适用于不同症状,其化学成分和药理作用有一定差异,本文对国内外有关地黄的化学成分和药理作用概况进行综述,旨在为地黄的进一步研究和开发医药品种提供参考。
1 化学成分
迄今为止,从鲜地黄、生地黄、熟地黄、地黄叶及地黄愈伤组织中,共分离鉴定出化合物200余种,主要为环烯醚萜类、紫罗兰酮类和苯乙醇类化合物,此外还包括三萜类、黄酮类、木脂素类、酚酸类等其他类化合物。
1.1 环烯醚萜类
环烯醚萜类成分是地黄中数量最多、含量最大的一类化合物,具体名称见表1,化学结构见图1。该类成分中代表性化合物梓醇是地黄中的主要成分与活性成分,《中国药典》2015年版与2020年版均将其列为鉴别与含量测定项下的指标性成分[1,3]。该类化合物基本骨架以益母草苷为主,所含糖基配体以葡萄糖居多。据文献报道[30],该类化合物在地黄的加工炮制过程中含量变化很大,其可能原因与该类化合物所连糖基数目有关:当化合物连有3个糖时,其在炮制过程中含量几乎不变;当连有2个糖时,其含量随着炮制过程的进行而下降,最终降至原来含量的1/3;当连有1个糖时,则几乎全部降解。
1.2 紫罗兰酮类
地黄中发现的紫罗兰酮类多以单萜和倍半萜为主,其5位羟基可与葡萄糖等成苷,少有与环烯醚萜类化合物聚合。从地黄中分离得到的紫罗兰酮类化合物的具体名称见表2,化学结构见图2。
1.3 苯乙醇类化合物
地黄中的苯乙醇类化合物绝大多数以苷的形式存在,其结构特点是以β-葡萄糖为连接体,苯乙醇基和苯乙酰基为取代基,以糖苷键连接于糖的不同部位。其代表性化合物毛蕊花糖苷为《中国药典》2015年版[38]所规定的地黄与熟地黄的指标性成分。从地黄中分离得到的苯乙醇类化合物见表3,化学结构见图3。
1.4 三萜类
地黄中的三萜类化合物主要存在于叶中,其他部位未见相关报道。至今,从地黄叶中分离鉴定的三萜类化合物仅有9个,结构类型为齐墩果烷型和乌苏烷型。地黄中的三萜类化合物见表4,化学结构见图4。
1.5 黄酮类
与三萜类化合物相同,地黄中的黄酮类化合物主要存在于叶中。从地黄中分离得到的化合物见表5,化学结构见图5。
1.6 糖类
地黄中糖类化合物主要分为单糖和多糖2类。其中单糖主要包括-葡萄糖、-半乳糖、-果糖,蔗糖、棉子糖、甘露三糖、水苏糖、毛蕊花糖和-甘露糖[49]。在生地黄中,水苏糖的含量最高,在其水提物中质量分数可达48.3%[49]。地黄多糖主要有地黄多糖a、地黄多糖b[50]、地黄多糖SRPⅠ、地黄多糖SRPⅡ[51]以及由-阿拉伯糖、-半乳糖、-鼠李糖、-半乳糖醛酸按10∶10∶1∶1与14∶7∶3∶8的比例组成的2种酸性多糖[52]。这些多糖的相对分子质量巨大,多在10 000以上。
1.7 其他类
除上述类型成分以外,地黄中还有其他多种类型的成分,如木脂素类、酚酸类、氨基酸类[30,56-57]、挥发油类[32,58]以及无机元素[56]等。木脂素及酚酸类化合物名称见表6,结构见图6。
2 药理作用
地黄在我国药用历史悠久且药理作用广泛,现代药理学研究表明地黄对人体血液系统、心脑血管系统、中枢神经系统和免疫系统有显著作用,此外还具有调节血糖和血脂、抗衰老、抗肿瘤、抑菌和抗胃溃疡及保护胃黏膜等作用。

表1 地黄中的环烯醚萜类化合物
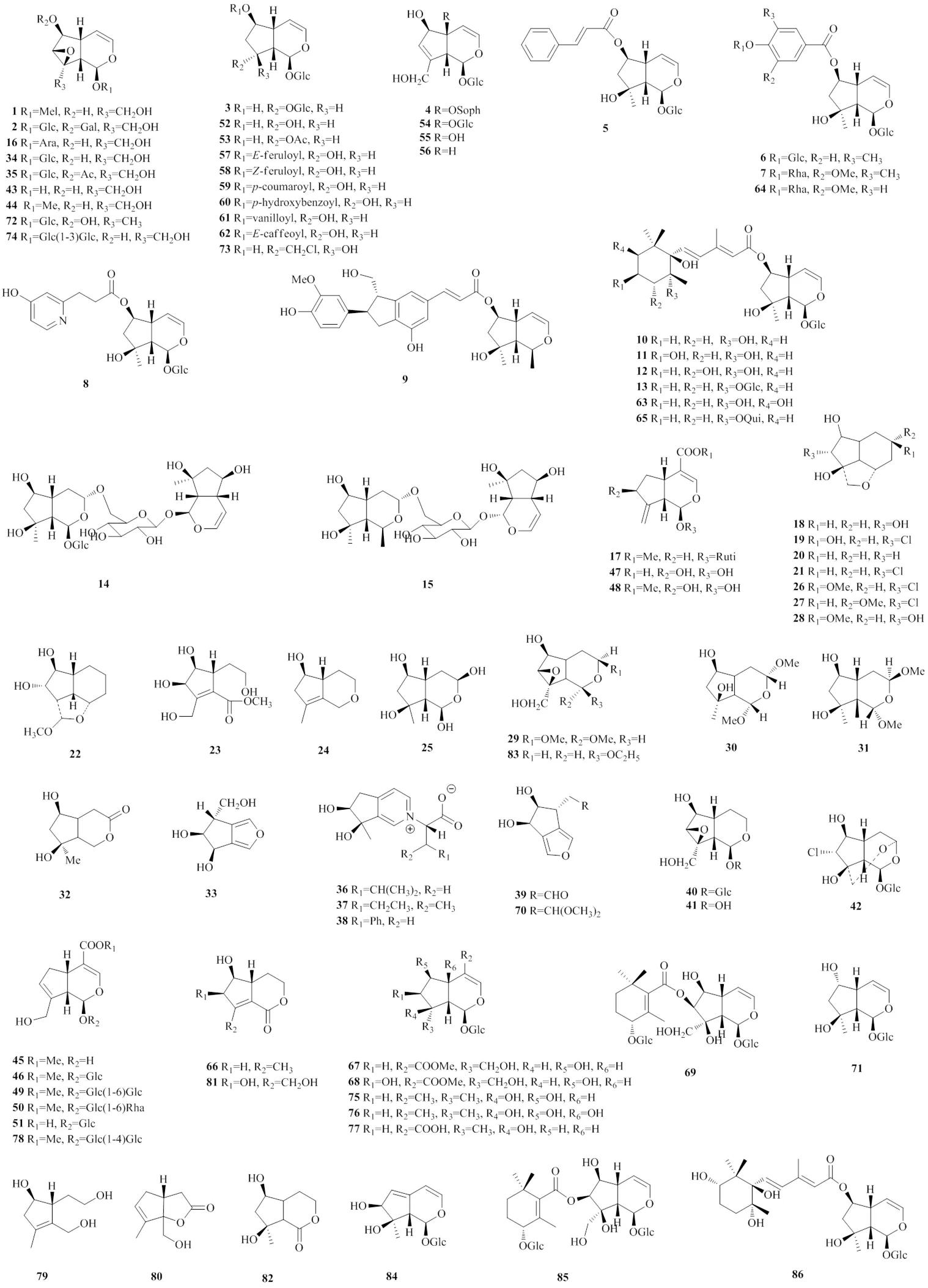
图1 地黄中环烯醚萜类化合物的结构

表2 地黄中的紫罗兰酮类化合物
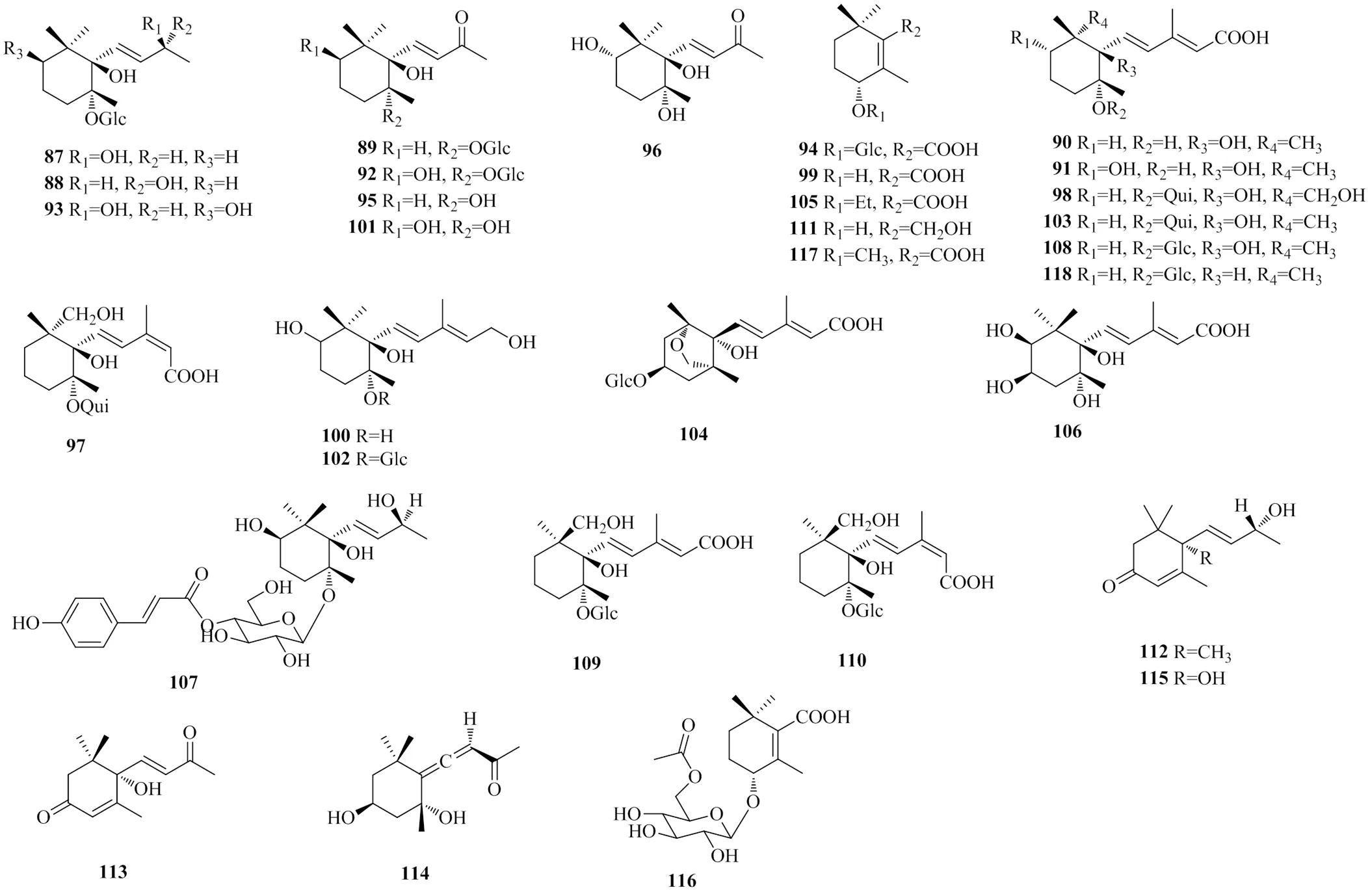
图2 地黄中紫罗兰酮类化合物的结构

表3 地黄中苯乙醇类化合物
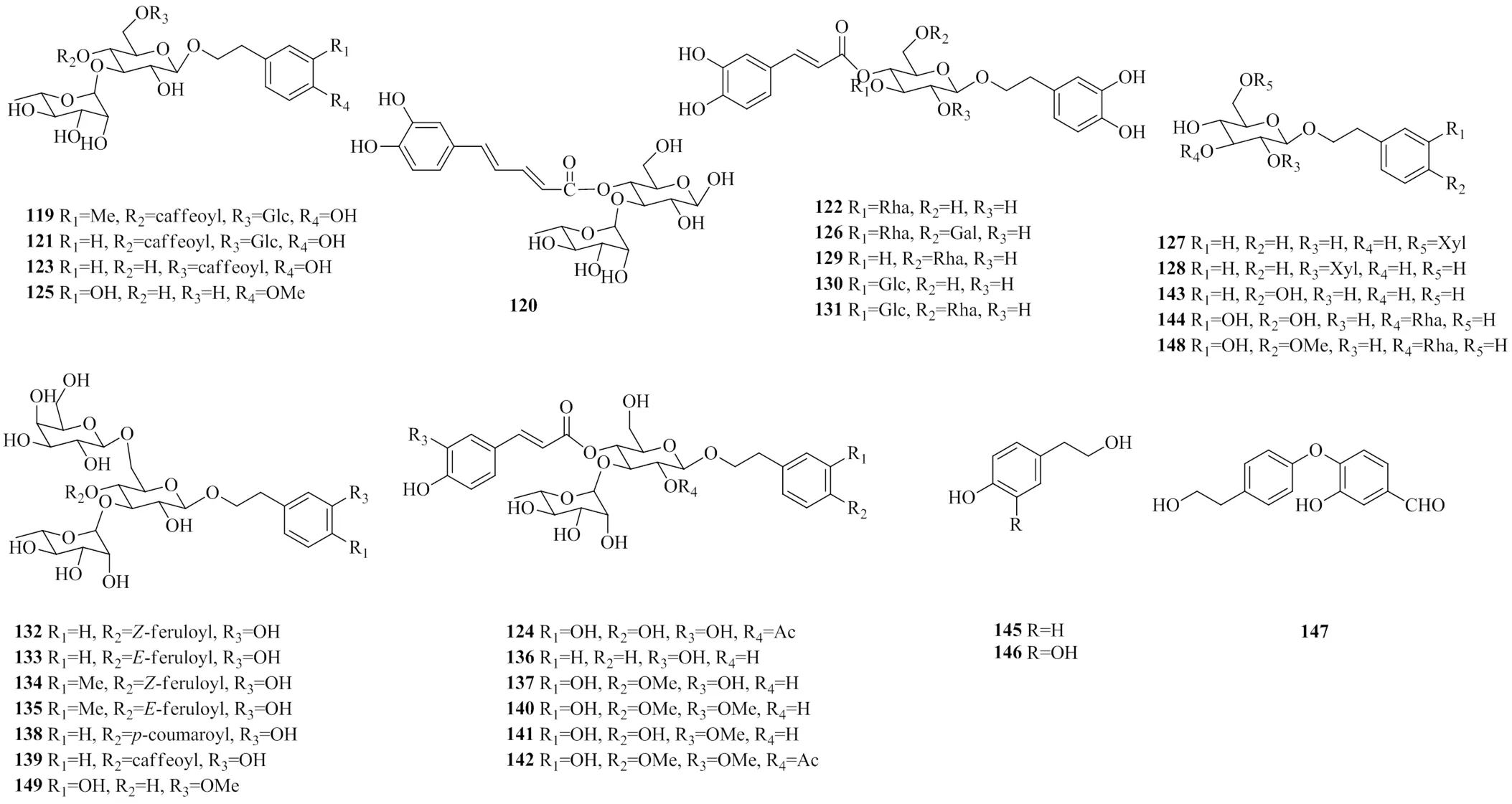
图3 地黄中的苯乙醇类化合物的结构

表4 地黄中的三萜类化合物
2.1 对血液系统的作用
熟地黄是临床常用补血要药,可增强机体造血,黄霞等[61]通过观察熟地黄多糖对模型小鼠外周血象、骨髓造血干细胞、骨髓有核细胞的影响发现,熟地黄多糖对于不同血虚模型小鼠外周血象、骨髓有核细胞下降均有拮抗作用,且对小鼠造血干细胞具有促进增殖、分化作用;此外,刘培建等[62]研究表明,地黄多糖可通过升高气血双虚模型小鼠血清中粒细胞-巨噬细胞集落刺激因子水平来维持造血前体细胞和成熟血细胞的增殖与分化,从而促进骨髓造血机能;给予贫血大鼠地黄提取物后,薛莉君等[63]发现,相对模型组,给药组大鼠红细胞数和血红蛋白显著升高、血浆促红细胞生成素(erythropoietin,EPO)水平提高、脑中EPO及其受体水平显著上调,证实了地黄可作用于大鼠骨髓造血系统,促进造血,改善贫血,从而发挥对于贫血大鼠的治疗作用。地黄还具有凉血止血作用,据报道鲜地黄能够减轻血热出血大鼠舌、肺、胃部出血损伤的相关症状,改善异常的血液流变学、凝血系统指标,具有凉血止血功效[64]。研究还发现,生地黄、炒生地黄炭和炒熟地黄炭均能缩短小鼠出血时间和凝血时间,具有一定止血作用[65]。王梅等[66]通过生地黄止血作用药效物质基础实验研究表明生地黄止血作用的药效活性物质与糖类、环烯醚萜苷类有关,具体作用机制还需进一步深入研究。
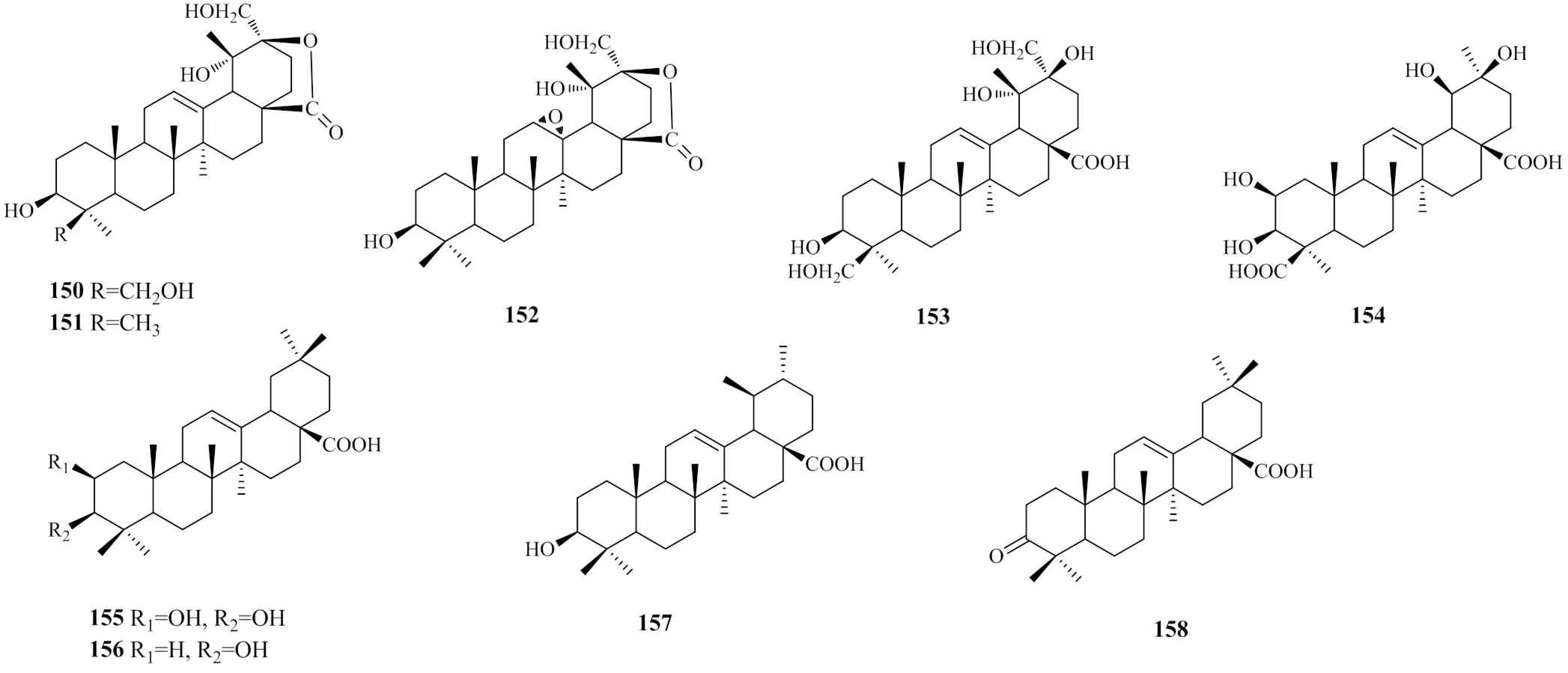
图4 地黄中三萜类化合物的结构

表5 地黄中的黄酮类化合物

图5 地黄中黄酮类化合物
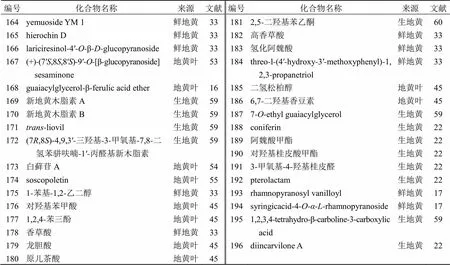
表6 地黄中的木脂素及酚酸类化合物
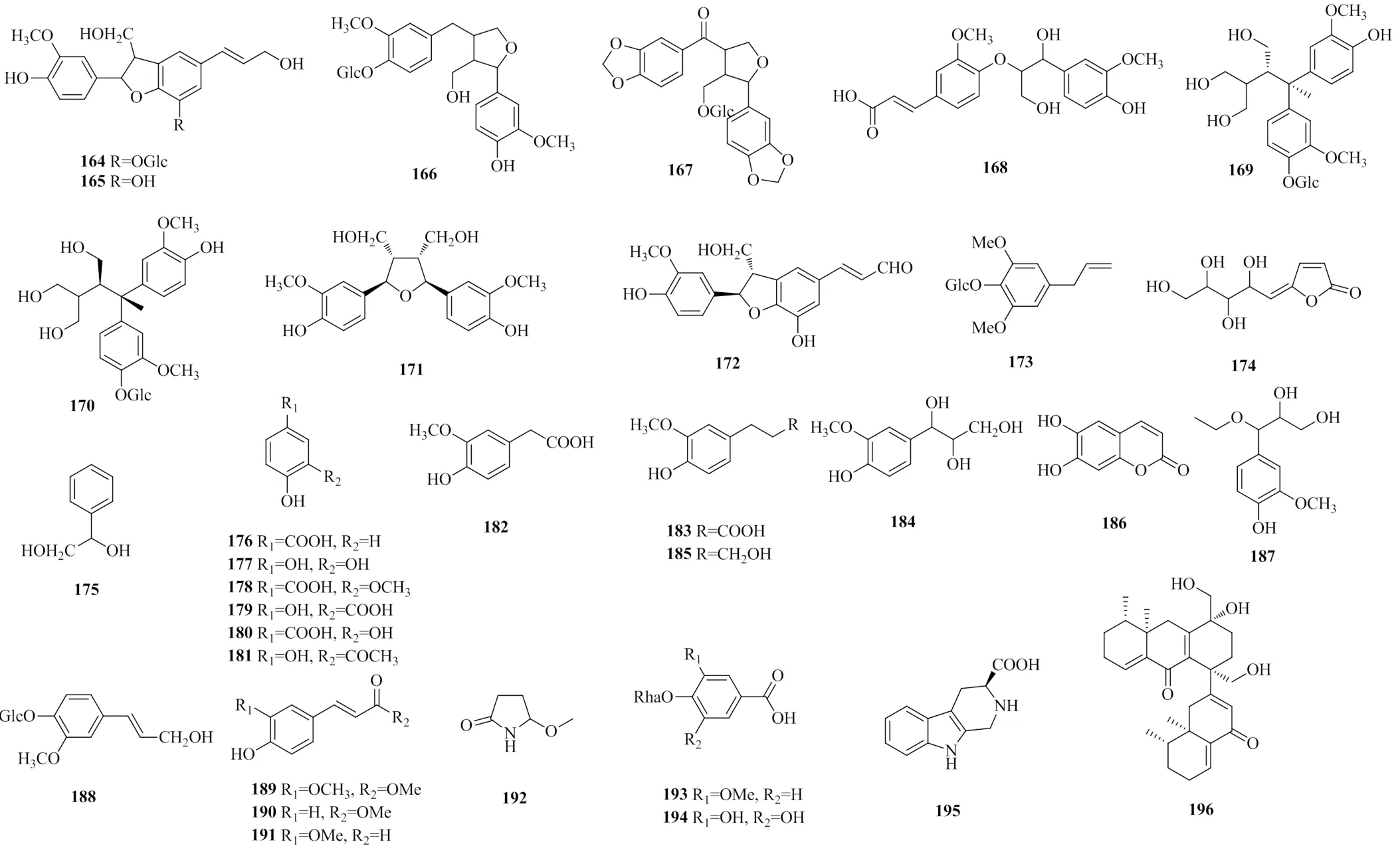
图6 地黄中的木脂素及酚酸类化合物
2.2 对心脑血管系统的作用
研究显示,地黄对心血管疾病有良好的治疗作用。杨焕斌等[67]通过临床实验观察到,给予冠心病心绞痛患者地黄饮子后,其治疗心绞痛作用优于单硝酸异山梨醇酯,且对心电图改善有效率也显著高于对照组;还有临床研究显示,以自拟加减地黄饮法治疗脑梗死总有效率达86.5%,且此法滋肾通络,标本兼顾,取得较好的治疗效果[68]。
2.3 对中枢神经系统的影响
阿尔茨海默病的临床表现为智能减退、记忆缺失、认知功能障碍、精神行为改变以及社会活动能力减退,是导致老年痴呆症最常见的神经退行性疾病。研究表明,地黄可广泛应用于治疗各种神经退行性疾病、有效改善认知和记忆障碍。Lee等[69]通过对大鼠ip东莨菪碱氢溴酸盐进行造模引起记忆缺陷,造模成功后,ip 200 mg/kg地黄提取物,2周后发现,地黄提取物不但明显改善大鼠记忆障碍,并减少大鼠在水迷宫中寻找平台的潜伏期,此外,该研究还显示200 mg/kg地黄提取物可增强与记忆相关的胆碱能免疫反应并降低海马中白细胞介素(interleukin,IL)-1β和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)mRNA的表达,提示地黄提取物可能通过刺激胆碱能酶活性改善认知并减轻炎症反应。刘志寿等[70]的类似研究也表明,地黄益智方对老年性痴呆有一定的防治作用,其机制可能与其能够改善脑组织中氧化应激水平和神经突触间的乙酰胆碱浓度有关。薛莉君等[63]采用断尾放血结合注射环磷酰胺制备贫血大鼠模型,模型成功后,ig 3、6、10 g/kg地黄水提物,10 d后发现地黄治疗组空间记忆能力明显提高,逃避潜伏期明显缩短,一定时间内穿越平台次数显著增多,且脑组织红细胞生成素及其受体表达明显升高,说明地黄水提物显著提高贫血鼠空间记忆能力。
2.4 对免疫系统的影响
免疫系统是机体执行免疫应答及免疫功能的重要系统,免疫功能低下容易受到各类疾病的侵袭。研究报道,不同剂量地黄提取物均能不同程度地提高小鼠免疫器官指数、碳粒廓清指数、IL-2和TNF-α水平,提高T淋巴细胞比值、血清溶血素水平及脾淋巴细胞增殖率,不同剂量地黄提取物组小鼠血清免疫球蛋白G、免疫球蛋白A水平也有不同程度地提高,表明地黄提取物可促进小鼠免疫功能[71]。奚香君等[72]的小鼠免疫功能低下模型实验研究表明,地黄煎能通过提高小鼠血清中IL-1α水平增强免疫功能,并调节内分泌、保护胸腺和卵巢形态结构。
2.5 抗衰老作用
衰老与体内自由基密切相关,自由基的过量可导致细胞损伤机体衰老。Piątczak等[73]研究表明地黄甲醇提取物可以抑制H2O2/Fe诱导血浆蛋白氧化,50 μg/mL甲醇提取物可抑制静息血小板产生超氧阴离子。麻锐等[74]研究表明地黄可以抑制H2O2诱导的大鼠肾脂质过氧化及红细胞溶血,通过清除自由基的产生,抑制脂质过氧化,延缓细胞衰老。
2.6 抗肿瘤
水苏糖是地黄寡糖中含量较多的成分,在体外有抗肿瘤作用。水苏糖可抑制人肝癌HepG-2细胞、人胃癌SGC-7901细胞的生长、促进癌细胞死亡,且其作用与浓度呈正相关,水苏糖联合环磷酰胺治疗H22荷瘤小鼠,小鼠肿瘤质量与水苏糖浓度呈负相关[75]。
2.7 调节血糖和血脂
蔡春沉等[76]研究表明高脂高糖饲料联合链脲佐菌素所致肥胖糖尿病大鼠模型,ip 10、20、30 mg/kg地黄多糖4 d,小鼠体质量、空腹血糖及胰岛素水平、三酰甘油、总胆固醇明显降低,胰高血糖素样肽-1及葡萄糖依赖性促胰岛素释放肽含量明显提高。地黄低聚糖可降低正常小鼠餐后血糖水平及α-葡萄糖苷酶活性并降低db/db 2型糖尿病小鼠葡萄糖耐量抑制,地黄低聚糖在体外可抑制肝H4IIE细胞中磷酸烯醇式丙酮酸羧化激酶基因的表达从而抑制肝脏糖异生[77]。
2.8 抑菌
地黄醋酸乙酯浸膏、正丁醇浸膏、不同浓度氯仿提取物等对大肠杆菌、金色葡萄球菌、枯草杆菌等有明显抑菌作用[78]。元辉明等[79]研究发现生地黄色素能抑制枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌活性,其中对枯草芽孢杆菌的抑制作用最强,其抑制作用与生地黄色素浓度呈正相关,但对酿酒酵母菌产朊、假丝酵母、黑曲霉没有明显抑制作用。
2.9 抗胃溃疡
干地黄80%乙醇提取物A液可明显减少无水乙醇所致的胃黏膜损伤,抑制热休克蛋白70的合成增加胃黏膜血流量;无水乙醇组HE染色切片显示胃黏膜损伤严重,胃小凹细胞、腺体细胞均有严重损伤表面上皮层脱落,A液组切片显示部分细胞脱落、大部分胃小凹细胞、腺体细胞完好[80]。
2.10 其他
2.10.1 糖尿病性骨质疏松症 Gong等[81]研究发现熟地黄水提取物可改善糖尿病引起的骨质疏松。熟地黄水提物可提高链脲佐菌素所诱导的糖尿病模型小鼠血清中骨特异性碱性磷酸酶活性,降低血清骨钙素,显著提高糖尿病大鼠股骨的骨密度、三维校准骨小梁厚度、小梁数和连接性密度,降低小梁间距和结构模型指数,抑制糖尿病大鼠所致的骨丢失和微结构恶化。地黄水提取物对地塞米松所致骨质疏松模型可改善小鼠股骨微结构,提高骨密度,增加骨小梁参数,促进成骨细胞增殖,其机制为地黄可增加碱性磷酸酶活性和骨基质矿化水平;增加Runt相关转录因子2和骨桥蛋白的表达,促进成骨细胞分化;通过上调细胞色素P45017A1和芳香化酶,下调11β-羟基类固醇脱氢酶的表达进而干扰固醇激素的生物合成,改善糖皮质激素对体内代谢失衡[82]。
2.10.2 糖尿病引起的肾功能障碍 Dai等[83]采用腹腔注射链脲佐菌素结合高脂饮食制备糖尿病肾病大鼠模型,分别服用地黄总苷、地黄叶总苷胶囊15 d,大鼠血清肌酐、尿素氮、24 h尿蛋白定量及肾间质纤维化程度均明显降低,人无翅型MMTV整合位点家族成员4、β链蛋白、转化生长因子-β1表达均明显减少,保护肾小球系膜细胞,2-酮基戊二胺酸、三磷酸鸟苷、新鹅去氧胆酸、1-磷酸鞘氨醇、三磷酸硫胺素、-乙酰--氨基葡萄糖6-磷酸等27种内源性代谢物在不同程度上恢复到正常水平。
2.10.3 抗抑郁 熟地黄水提物可通过改善慢性温和不可预知应激(chronic mild unpredictable stress,CUMS)抑郁症小鼠胃溃疡、抗氧化能力及运动能力缓解小鼠抑郁。熟地黄水提物可降低CUMS模型小鼠肝脏中丙二醛的水平,并提高超氧化物歧化酶和过氧化氢酶活性,减少机体氧化损伤[84]。地黄醇提物对CUMS抑郁症模型小鼠具有抗抑郁作用,可缓解由CUMS引起的小鼠对于蔗糖偏好降低的症状,并能恢复CUMS所致血清中异常升高皮质醇水平,可能通过抑制下丘脑-垂体-肾上腺轴的过度活动来升高中枢神经递质5-羟色胺、去甲肾上腺素,提高脑源性神经营养因子和原肌球蛋白相关激酶B蛋白的表达[85]。
2.10.4 保肝 Zhang等[86]用CCl4制备肝损伤模型,地黄寡糖连续给药21 d,小鼠血清中丙氨酸转氨酶和天冬氨酸转氨酶水平明显升高,总胆固醇和三酰甘油水平明显降低;肝脏氧化损伤明显改善,谷胱甘肽、谷胱甘肽过氧化物酶和超氧化物歧化酶活性升高。
3 结语与展望
地黄始载于《神农本草经》,列为上品,是著名的“四大怀药”之一,至今已有千年的应用历史。随着现代药学的不断发展以及对地黄的深入研究,地黄中越来越多的活性成分被挖掘出来,如环烯醚萜类、紫罗兰酮类和苯乙醇类,以及三萜类、黄酮类等化合物。然而,地黄或熟地黄常以水煎剂的形式入药,在汤剂中发挥药效的成分多为大极性的水溶性成分,因此地黄以及熟地黄水溶性成分的研究对其开发利用有着重要作用与意义。药理学研究发现,地黄对血液系统、心脑血管系统、中枢神经系统和免疫系统有显著调节作用,此外,还具有调节血糖和血脂、抗衰老、抗肿瘤、抑菌和抗胃溃疡及保护胃黏膜等作用[87]。尽管地黄的药理活性众多,但其中活性物质的作用机制尚未被研究清楚。此外,《中国药典》2020年版也对地黄以及熟地黄的质量控制方法进行改进,较2015年版,新增生地黄以及熟地黄中地黄苷D的含量测定,而删去了对毛蕊花糖苷的含量测定[1]。由此说明,国家以及学界对于中药有效成分的研究及质量控制更加重视。故后续地黄研究工作可以从以下几方面入手:(1)改善现有的地黄提取工艺,提高有效成分的获取量;(2)加大研究力度,拓宽研究维度,阐明地黄药理作用的分子机制,如借助分子生物学、网络药理学等现代研究手段,发掘新的活性成分以及现有活性成分的新靶点、新药理作用;(3)依据不同治疗目的、诊疗手段,选取不同活性成分,如采用质量标志物的研究手段及方法,建立地黄质量评价、质量控制系统,保证地黄中药材及饮片的安全、有效、可控。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 129.
[2] 徐军, 傅喆暾. 地黄炮制品名历史沿革及功效考辨探讨 [J]. 中成药, 2017, 39(9): 1913-1916.
[3] 中国药典 [S]. 一部. 2015: 124.
[4] Oshio H, Inouye H. Iridoid glycosides of[J]., 1982, 21(1): 133-138.
[5] Liu Y F, Liang D, Luo H,. Hepatoprotective iridoid glycosides from the roots of[J]., 2012, 75(9): 1625-1631.
[6] Morota T, Sasaki H, Nishimura H,. Two iridoid glycosides from[J]., 1989, 28(8): 2149-2153.
[7] Kitagawa I, Fukuda Y, Taniyama T,. Absolute stereostructures of rehmaglutins A, B, and D three new iridoids isolated from Chinese[J]., 1986, 34(3): 1399-1402.
[8] Kitagawa I, Fukuda Y, Taniyama T,. Chemical studies on crude drug processing. VIII. on the constituents of. (2): Absolute stereostructures of rehmaglutin C and glutinoside isolated from Chinese, the dried root ofLibosch. [J]., 1995, 43(7): 1096-1100.
[9] 刘彦飞. 地黄活性物质与功能研究 [D]. 北京: 北京协和医学院, 2013.
[10] 刘彦飞, 史国茹, 王欣, 等. 天目地黄化学成分研究 [J]. 中草药, 2016, 47(11): 1830-1833.
[11] Morota T, Nishimura H, Sasaki H,. Five cyclopentanoid monoterpenes from[J]., 1989, 28(9): 2385-2391.
[12] Morota T, Sasaki H, Sugama K,. Two non-glycosidic iridoids from[J]., 1990, 29(2): 523-526.
[13] 王太霞, 李景原, 胡正海. 怀地黄营养器官中梓醇的积累动态 [J]. 中草药, 2004, 35(2): 208-209.
[14] Li Y S, Chen Z J, Zhu D Y. A novel bis-furan derivative, two new natural furan derivatives fromand their bioactivity [J]., 2005, 19(2): 165-170.
[15] 胡红侠, 杨培明. 西藏胡黄连的化学成分研究 [J]. 中国医药工业杂志, 2005, 36(6): 336-339.
[16] Yoshikawa M, Fukuda Y, Taniyama T,. Absolute stereostructures of rehmaglutin C and glutinoside a new iridoid lactone and a new chlorinated iridoid glucoside from Chinese[J]., 1986, 34(3): 1403-1406.
[17] 史国茹. 地黄叶和蝴蝶花活性物质与功能研究 [D]. 北京: 北京协和医学院, 2016.
[18] 刘彦飞, 梁东, 罗桓, 等. 地黄的化学成分研究 [J]. 中草药, 2014, 45(1): 16-22.
[19] Nishimura H, Sasaki H, Morota T,. Six iridoid glycosides from[J]., 1989, 28(10): 2705-2709.
[20] Sasaki H, Nishimura H, Morota T,. Norcarotenoid glycosides ofvar.[J]., 1991, 30(5): 1639-1644.
[21] Lee S Y, Kim J S, Choi R J,. A new polyoxygenated triterpene and two new aeginetic acid quinovosides from the roots of[J]., 2011, 59(6): 742-746.
[22] Kitagawa I, Fukuda Y, Taniyama T,. Chemical studies on crude drug processing. VII. on the constituents of. (1): Absolute stereostructures of rehmaglutins A, B, and D isolated from Chinese, the dried root ofLibosch. [J]., 1991, 39(5): 1171-1176.
[23] 冯卫生, 李孟, 郑晓珂, 等. 生地黄化学成分研究 [J]. 中国药学杂志, 2014, 49(17): 1496-1502.
[24] Seren D, Seren R J, Bent J N. Structural revision of ajuglo and myoporside [J]., 1982, 23(11): 1215-1216.
[25] Bianco A, Guiso M, Martino M,. Iridoids from endemic sardinianspecies [J]., 1996, 42(1): 89-91.
[26] Boros C A, Stermiz R S. Iridoids. An updated review. Part 1 [J]., 1990, 53(5): 1087.
[27] Sasaki H, Morota T, Nishimura H,. Norcarotenoids ofvar.[J]., 1991, 30(6): 1997-2001.
[28] Sasaki H, Nishimura H, Morota T,. Norcarotenoid glycosides ofvar.[J]., 1991, 30(5): 1639-1644.
[29] Feng W S, Li M, Zheng X K,. Two new ionone glycosides from the roots ofLibosch. [J]., 2015, 29(1): 59-63.
[30] Oshio H, Naruse Y, Inouye H. Quantitative analysis of iridoid glycosides of[J]., 1981, 35(4): 291-294.
[31] Yoshikawa M, Fukuda Y, Taniyama T,. Absolute configurations of rehmaionosides A, B, and C and rehmapicroside three new ionone glucosides and a new monoterpene glucoside from[J]., 1986, 34(5): 2294-2297.
[32] Kitagawa I, Hori K, Kawanishi T,. On the constituents of the root of fukuchiyama-jio, the hybrid ofvar.andforma[J]., 1998, 118(10): 464-475.
[33] 刘彦飞, 赵宇, 武卫红, 等. 地黄的化学成分及其在加工炮制过程中的变化 [J]. 现代药物与临床, 2007, 22(3): 102-108.
[34] 吕艳艳. 鲜地黄的化学成分研究 [D]. 郑州: 河南中医药大学, 2013.
[35] Fu G M, Shi S P, Ip F C,. A new carotenoid glycoside from[J]., 2011, 25(13): 1213-1218.
[36] Champavier Y, Comte G, Vercauteren J,. Norterpenoid and sesquiterpenoid glucosides fromand[J]., 1999, 50(7): 1219-1223.
[37] Hasegawa Y, Gong X, Kuroda C. Chemical diversity of iridal-type triterpenes incollected in Yunnan Province of China [J]., 2011, 6(6): 789-792.
[38] Liu Y F, Liang D, Luo H,. Ionone glycosides from the roots of[J]., 2014, 16(1): 11-19.
[39] Sasaki H, Nishimura H, Chin M,. Hydroxycinnamic acid esters of phenethylalcohol glycosides fromvar.[J]., 1989, 28(3): 875-879.
[40] Sasaki H, Nishimura H, Morota T,. Immunosuppressive principles ofvar.[J]., 1989, 55(5): 458- 462.
[41] Shoyama Y, Matsumoto M, Nishioka I. Four caffeoyl glycosides from callus tissue of[J]., 1986, 25(7): 1633-1636.
[42] Li X N. Chemical constituents from[J]., 2011, 36(22): 3125-3129.
[43] Shoyama Y, Matsumoto M, Nishioka I. Phenolic glycosides from diseased roots ofvar.[J]., 1987, 26(4): 983-986.
[44] Nishimura H, Sasaki H, Morota T,. Six glycosides fromvar.[J]., 1990, 29(10): 3303-3306.
[45] 张艳丽. 地黄叶的化学成分研究 [D]. 哈尔滨: 黑龙江中医药大学, 2013.
[46] 邹妍, 张蕾, 续洁琨, 等. 地黄地上部分中一个新苯甲醛类化合物 [J]. 中国中药杂志, 2015, 40(7): 1316-1319.
[47] Zhang Y L, Feng W S, Zheng X K,. Three new ursane-type triterpenes from the leaves of[J]., 2013, 89: 15-19.
[48] 张蕾, 邹妍, 续洁琨, 等. 地黄地上部分化学成分的研究 [J]. 中国中药杂志, 2015, 40(16): 3214-3219.
[49] Tomoda M, Kato S, Onuma M. Water-soluble constituents of. 1 cabohydrates and acids off.[J]., 1971, 19(7): 1455-1460.
[50] 陈力真, 冯杏婉, 顾国民, 等. 地黄免疫抑瘤活性成分的分离提取与药理作用 [J]. 中国中药杂志, 1993, 18(8): 502.
[51] 张艳萍, 俞远志, 张虹. 气相色谱分析生地黄多糖的单糖组成及其含量 [J]. 中国中药杂志, 2009, 34(4): 419- 422.
[52] Tomoda M, Miyamoto H, Shimizu N,. Characterization of two polysaccharides having activity on the reticuloendothelial system from the root of[J]., 1994, 42(3): 625-629.
[53] 邹妍. 地黄地上部分化学成分的研究 [D]. 哈尔滨: 黑龙江中医药大学, 2015.
[54] Hu X Y, Dou D Q, Pei Y P. Chemical constituents of roots ofThunb. [J]., 2006, 15(2): 127-129.
[55] MyIntyre D D, Vogel H J. Complete assignment of the 1H-NMR spectrum of stachyose by two-dimensional NMR spectroscopy [J]., 1989, 52(5): 1008- 1014.
[56] Hasegawa T, Koike K, Takahashi S,. Constituents of leaves and roots of Kaikei Jio (Libosch. formaHsiao) [J]., 1982, 36(1): 1-5.
[57] 倪慕云, 边宝林, 姜莉. 地黄及其炮制品中游离氨基酸的分析比较 [J]. 中国中药杂志, 1989, 14(3): 21-22.
[58] 边宝林, 倪慕云, 王宏杰. 地黄及其炮制品石油醚提取物中酸性成分的分离、鉴定和比较 [J]. 中国中药杂志, 1991, 16(6): 339-341.
[59] 李孟. 生地黄化学成分研究 [D]. 郑州: 河南中医学院, 2014.
[60] Han Y, Jung H W, Lee J Y,. 2,5-dihydroxyacetophenone isolated frominhibits inflammatory responses in lipopolysaccharide-stimulated RAW264.7 macrophages [J]., 2012, 15(6): 505-510.
[61] 黄霞, 刘杰, 刘惠霞. 熟地黄多糖对血虚模型小鼠的影响 [J]. 中国中药杂志, 2004, 29(12): 1168-1170.
[62] 刘培建, 苗明三, 高渐联. 熟地黄多糖对气血双虚小鼠全血细胞及血清粒-巨噬细胞集落刺激因子水平的影响 [J]. 中国组织工程研究与临床康复, 2008, 12(38): 7543- 7546.
[63] 薛莉君, 万东, 王红利, 等. 地黄提取物改善贫血大鼠记忆及其机制 [J]. 中国科学: 化学版, 2011, 41(6): 1024-1030.
[64] 贾秀梅, 张振凌, 吴瑞环. 鲜地黄及保鲜加工品对血热出血模型大鼠凉血止血药效比较 [J]. 中国实验方剂学杂志, 2014, 20(6): 127-132.
[65] 李娴, 卫向龙, 石延榜, 等. 煅生地黄炭、熟地黄炭对小鼠出、凝血时间的影响 [J]. 中华中医药学刊, 2012, 30(5): 984-986.
[66] 王梅, 张丽娟, 郭东艳. 生地黄止血作用药效物质基础的初步研究[J]. 时珍国医国药, 2011, 22(8): 1938- 1939.
[67] 杨焕斌, 蔡敏, 汪晓红, 等. 地黄饮子治疗冠心病心绞痛临床观察 [J]. 中国医药学报, 2001, 16(4): 69-70.
[68] 邵夏, 张元泓, 苏泓. 自拟加减地黄饮治疗脑梗塞37例 [J]. 上海中医药杂志, 2002, 36(4): 11-12.
[69] Lee B, Shim I, Lee H,.ameliorates scopolamine-induced learning and memory impairment in rats [J]., 2011, 21(8): 874-883.
[70] 刘志寿, 杨小卫, 安红梅, 等. 地黄益智颗粒防治-半乳糖痴呆大鼠的作用机理研究[J]. 中药药理与临床, 2016, 32(1): 124-127.
[71] 李国辉, 刘佳, 刘建伟, 等. 地黄提取物对小鼠免疫功能的影响 [J]. 中国兽医学报, 2018, 38(4): 765-769.
[72] 奚香君, 张永宁, 袁丽超, 等. 香菇多糖、地黄煎影响小鼠免疫及内分泌功能的比较研究 [J]. 辽宁中医药大学学报, 2013, 15(2): 50-52.
[73] Piątczak E, Kuźma Ł, Porada W,. Evaluation of antioxidant properties of methanolic extracts from leaves and roots ofLibosch. in human blood [J]., 2015, 72(4): 777-783.
[74] 麻锐, 丁瑞恒, 廖蕴华. 不同浓度地黄对大鼠肾组织抗氧化作用的研究 [J]. 内科, 2012, 7(3): 220-223.
[75] 贾绍华, 张道勇, 刘冰洁. 地黄不同炮制品中水苏糖含量比较及其水苏糖抗肿瘤活性的研究 [J]. 黑龙江医药, 2012, 25(4): 511-514.
[76] 蔡春沉, 王洪玺, 王肃. 地黄多糖对肥胖糖尿病大鼠模型的治疗作用及对血清中GLP-1、GIP水平的影响 [J]. 中国老年学杂志, 2013, 33(18): 4506-4507.
[77] Chiu C Y, Hsu W H, Liu H K,. Preparedoligosaccharide regulates postprandial and diabetic blood glucose in mice [J]., 2018, 41: 210-215.
[78] 郭嘉昒, 马慧, 何伟明, 等. 地黄中活性成分的提取及抑菌实验研究 [J]. 上海化工, 2013, 38(12): 6-10.
[79] 元辉明, 朱金华, 马广强. 地黄内生菌的分离鉴定及其抑菌活性测定 [J]. 江西中医药大学学报, 2015, 27(1): 86-88.
[80] 王竹立, 崔颖, 叶美红. 干地黄提取物A保护胃黏膜作用的形态学研究及与热休克蛋白的关系 [J]. 中国中西医结合杂志, 2005, 25(S1): 38-42.
[81] Gong W, Zhang N D, Cheng G,.Libosch. extracts prevent bone loss and architectural deterioration and enhance osteoblastic bone formation by regulating the IGF-1/PI3K/mTOR pathway in streptozotocin-induced diabetic rats [J]., 2019, 20(16): 3964.
[82] Xia T S, Dong X, Jiang Y P,. Metabolomics profiling revealspreparata extract protects against glucocorticoid-induced osteoporosis mainly via intervening steroid hormone biosynthesis [J]., 2019, 24(2): 253.
[83] Dai X, Su S, Cai H,. Protective effects of total glycoside fromleaves on diabetic nephropathy rats via regulating the metabolic profiling and modulating the TGF-β1 and wnt/β-catenin signaling pathway [J]., 2018, 9: 1012.
[84] Zhang D, Wen X S, Wang X Y,. Antidepressant effect of Shudihuang on mice exposed to unpredictable chronic mild stress [J]., 2009, 123(1): 55-60.
[85] Wang J M, Pei L X, Zhang Y Y,. Ethanol extract ofexerts antidepressant-like effects on a rat chronic unpredictable mild stress model by involving monoamines and BDNF [J]., 2018, 33(3): 885-892.
[86] Zhang R J, Zhao Y, Sun Y F,. Isolation, characterization, and hepatoprotective effects of the raffinose family oligosaccharides fromLibosch. [J]., 2013, 61(32): 7786-7793.
[87] 李红伟, 孟祥乐. 地黄化学成分及其药理作用研究进展[J]. 药物评价研究, 2015, 38(2): 218-228.
Research progress on chemical constituents and pharmacological actions of
CHEN Jin-peng1, 2, 3, ZHANG Ke-xia4, LIU Yi1, 2, 3, GAI Xiao-hong1, 2, 3, REN Tao1, 2, 3, LIU Su-xiang1, 2, 3, TIAN Cheng-wang1, 2, 3
1. Tianjin Institute of Pharmaceutical Research, Tianjin 300462, China 2. Tianjin Key Laboratory of Quality Marker of Traditional Medicine, Tianjin 300462, China 3. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin 300462, China 4. Tianjin Pharmaceutial Research Institute Co., Ltd., Tianjin 300462, China
Dihuang () has been used as a traditional Chinese herbal medicine for thousands of years in China, which is mainly distributed in Henan, Hebei, Shaanxi and Shanxi Provinces. It mainly contains iridoids, ionones, phenylethanoid glycosides, triterpenoids, flavonoids, and saccharides, which has significant effects on human blood system, cardiovascular and cerebrovascular system, central nervous system and immune system. In recent years, with the development of innovative methods for separation and analysis, the modern science and technology and pharmacological methods were applied to study the chemical constituents and pharmacological action of. More and more chemical components inhave been discovered, and its pharmacological actions have been further improved by development. Furthermore, the clinical application scope ofhas been expanded year by year, which has aroused the keen attention of domestic and foreign scientific research workers. In this paper, the chemical constituents and pharmacological actions ofwere summarized, in order to provide some basis for its further utilization and modernization.
Libosch.; chemical constituents; iridoid; ionone; pharmacological action; hpyerglycemic
R282.71
A
0253 - 2670(2021)06 - 1772 - 13
10.7501/j.issn.0253-2670.2021.06.028
2020-07-01
国家科技重大专项项目(2019ZX09201005)
陈金鹏(1991—),男,助理研究员,博士,主要从事中药质量控制及药效物质基础研究。E-mail: chenjp@tjipr.com
田成旺(1978—),男,研究员,博士,主要从事中药质量控制及药效物质基础研究。E-mail: tiancw@tjipr.com
[责任编辑 崔艳丽]

