有机教材反应机理描述及其存在的问题与解决办法*
李海浪,彭跃颜,叶廷秀,毕丽伟,秦 飞
(1 厦门医学院药学系,福建 厦门 361023;2 厦门医学院教务处,福建 厦门 361023)
有机化学是研究有机化合物的组成、结构、性质、制备以及应用的一门科学。是化学学科的一个重要分支[1]。有机化学知识点的特点是信息量大,但知识之间的逻辑关系相对其他课程要弱一些,学生在学习时会觉得需要记忆大量的知识内容,以至于造成有些同学认为有机化学的学习就是单纯地记忆反应,结果大量的、无序的材料记忆起来相当困难[2]。其实,任何一门课程有其特点也有其特定的规律,有机化学也不例外。在某种程度上说,“学习”和“应用”有机化学与学习和使用一门语言非常相似。你需要词汇(也就是反应)才能使用正确的词汇,同时你也需要语法(即机理)才能正常交流。二者缺一都不是完整的知识和理解。但是两者组合却能形成强有力的交流方式,进行合理化和预测性分析[3]。学习有机化学的关键在于对基础理论以及基本机理过程的深刻理解,因为只有如此,才能将大量表面上互不相干的现象以及过程等联系成为一个整体,从而达到对有机化学本质的认识和掌握[4]。由此可见,如何学会给反应提出一个合理的反应机理非常重要[5]。
1 有机反应的几个基本概念
1.1 亲电试剂
对电子有显著结构上的亲和力,而起反应的试剂称为亲电试剂。亲电试剂是具有空轨道的中性分子或正离子。在反应中它们是电子对的接受体,即:Lewis酸[1]。
1.2 亲核试剂
对原子核有显著结构上的亲和力,而起反应的试剂称为亲核试剂。亲核试剂是具有未共用电子对的中性分子和负离子。在反应中它们是电子对的给予体,即:Lewis碱[7]。
1.3 底 物
在一般有机化学反应中,被试剂进攻的化合物称为底物[1]。
1.4 亲核取代反应
亲核试剂进攻底物分子中带正电荷或部分正电荷的原子而发生的取代反应,称为亲核取代反应。在此类反应中,亲核试剂是负离子或电子给予体(Lewis碱);底物R-L的C-L键发生异裂,离去基团(离核体)L带着一对成键电子离去[1]。
1.5 亲电加成
含有重键的化合物进行加成时,反应速率的控制步骤(即最慢的一步)是亲电试剂首先进攻重键原子生成正离子中间体,然后正离子中间体再与亲核试剂反应生成产物,这种加成称为亲电加成[1]。
1.6 亲电取代
亲电试剂进攻分子中带有负电荷或部分负电荷的原子而发生的取代反应。在此反应中,亲电试剂是正离子或Lewis酸;底物R-L的C-L键发生异裂,离去基团L多数为质子或带正电荷的金属离子[1]。
2 有机反应机理
反应物转变成为产物所经历的途径,即:对一个化学反应由反应物转变成为产物经历多少过渡态和中间体、包括多少个基元反应等一步步详细地描述[1]。
2.1 有机化学反应的类型
2.1.1 均裂和自由基反应
共价键的均裂是指组成共价键的一对电子,在共价键断裂后平均分布到共价键连接的两个原子或基团上,该反应为自由基机理。可表示为:
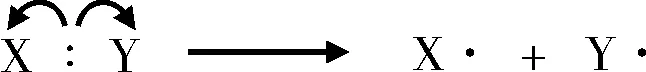
鱼钩箭头表示单电子转移的起始与终到位置[6]。显然,无论是共价键的均裂亦或者是共价键的生成,鱼钩箭头都是成对出现的,唯独金属外层失去自由电子的过程,鱼钩箭头不是成对出现。
2.1.2 异裂和离子型反应
共价键的异裂是指共价键断裂后,成键的一对电子完全归成键的一个原子或原子团所有,产生正离子和负离子,该反应为极性反应机理。可表示为:

弯箭头表示一对电子的转移过程,弯箭头的起点为反应前独对电子所处的位置,弯箭头的终点为反应后独对电子所处的位置,即:弯箭头的弯曲方向为该对独对电子所依附的元素方向[6]。根据电子转移规律,弯箭头的弯曲方向应该是弯向电负性较大的元素或基团,即:独对电子向电负性较大的元素方向转移。由于协同反应受极性影响非常显著,因此,我们可以把它看作一种特殊的“极性反应”。
2.2 有机反应机理的描述
2.2.1 电子推动
有机化学家书写反应机理的方式称为“电子推动”、“箭头推动”,或者叫“电子移动”。用箭号来指示化学反应中电子在物质结构内或物质结构间的移动情况,单向双箭头箭号表示一对电子的移动,单向单箭头箭号表示单个电子的移动。在画单向双箭头箭号代表一对电子移动时,箭尾应靠近电子源,箭头应指向电子穴。电子源通常以一对电子的形式出现,如:孤对电子,σ键或π键;电子穴通常指分子中的一个原子或一个键,它能够以孤对电子或形成一个新的化学键的形式接受一对电子。电子推动可形象地表述化学键、电子或电子对的运动情况,它并不代表电子真实的运动情况;电子推动概念可明确指出独立的化学键和孤对电子在反应前后的排列情况[7]:

2.2.2 电子源
电子推动箭号起始于电子源,终止于电子穴。电子源通常由一些带有孤对电子的杂原子组成,这些杂原子可以是负电性的也可以是电中性的。负离子的电子源包括烷氧基负离子、氨基负离子、氢氧化物和硫醇盐等;电中性的电子源主要有醇、水、胺、硫醇等。通常情况下,C-C σ键不能成为电子源,因为这些轨道中的电子能量太低,无法参与常见的化学反应。高张力的σ键有可能成为电子源,如:环丙烷分子。当σ键高度极化时,碳上会有部分或全部负电荷,此时也能成为电子源,如:有机锂试剂和Grignard试剂。烯烃、炔烃、共轭烯烃、丙二烯的简单π键以及芳香环都可以成为电子源[7]。
2.2.3 电子穴
电子穴通常是带正电荷或带空轨道的位置。碳正离子、Lewis酸、金属正离子都是很好的电子穴;H+以及一对杂原子间弱的单键也可成为电子穴;极性键带部分正电荷一端的原子通常是电子穴,如:羰基、氰基、共轭受体以及酰卤中的碳原子。电子穴通常是箭号箭头终止之处。当电子穴是杂原子或亲电性原子时,可将箭头放置于杂原子近旁。当电子穴有新键产生时,可以将箭头画在即将形成新键的两个原子中间,也可以将箭头指向即将成键的原子[7]。
3 作为一个问题提出
化学反应机理是反应过程各步基元反应的集成,每个基元反应都是电子的有序运动或有序转移过程。然而,迄今为止,有机化学教材中仍有一些例子未能标注电子转移过程。例如:烯烃与硫酸的亲电加成反应,教材上的反应机理普遍解析为[8]:
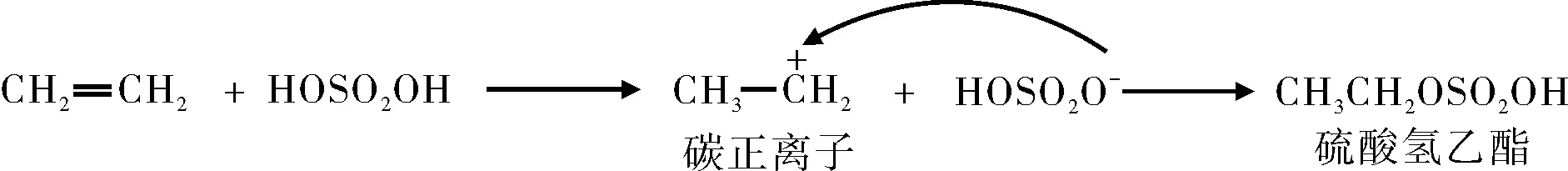
在上述第一步反应过程中,电子转移显然是客观存在的,但为什么没有用单向双箭头箭号将电子转移过程标注出来呢?又比如,在芳香烃的亲电取代反应中,教材将反应机理解析为[8]:
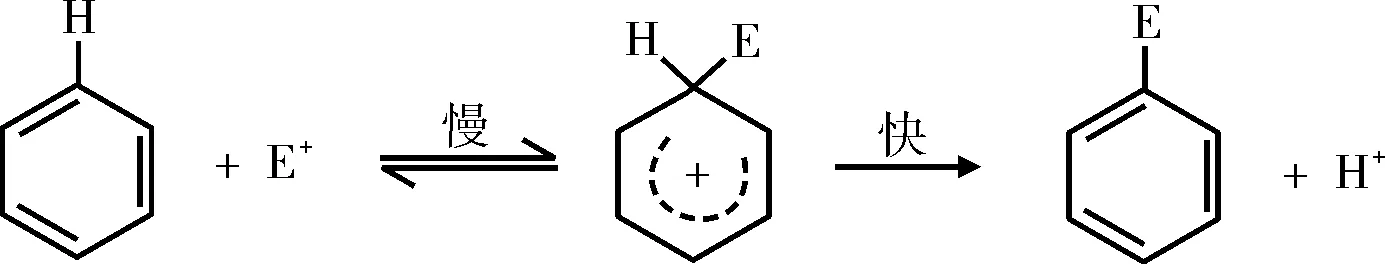
其中,第一步反应亦未用单向双箭头箭号将电子转移过程标注出来。原因何在?这些未用单向双箭头箭号将电子转移过程标注出来的例子有一个共同特点,即:进攻试剂为电子穴而底物为电子源。由1.5、1.6可知,亲电反应是电子穴亲电试剂进攻电子源底物。按此定义,单向双箭头箭号起始点位于电子穴亲电试剂,终点指向电子源底物。但是,电子穴亲电试剂缺电子或没有电子而电子源底物是富电子的,显然,这样的机理是不合理的。符合电子转移客观事实的应该是单向双箭头箭号起始点位于电子源底物,终点指向电子穴亲电试剂。这种电子转移画法虽然符合客观事实,但与亲电反应概念相互矛盾。由此可见,亲电反应电子转移方向无法画或省略画的根源在于人为地把有机反应机理电子转移与亲电反应概念绑架。
4 放飞想象的翅膀,提出普适性机理
碳原子为四价,最多只能连接四个基团,一个基团进来必然要有一个基团出去。孤对电子是一种微观物质,假如我们把轨道与电子想象成一种特殊的“基团”,那么,碳原子将均处于连接四个“基团”的“饱和状态”。这样,所有极性反应实质上就是碳原子上一个或多个弱电子源“基团”被其他强电子源“基团”取代的过程,也就是说,可以把每一个基元反应看作一个简单的取代反应:
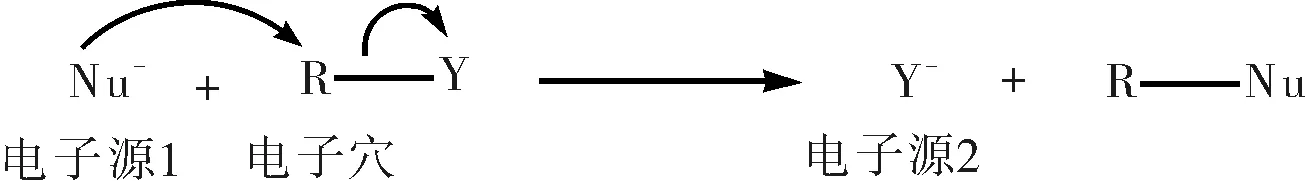
这样,烯烃与氢卤酸的亲电加成反应机理可写成:
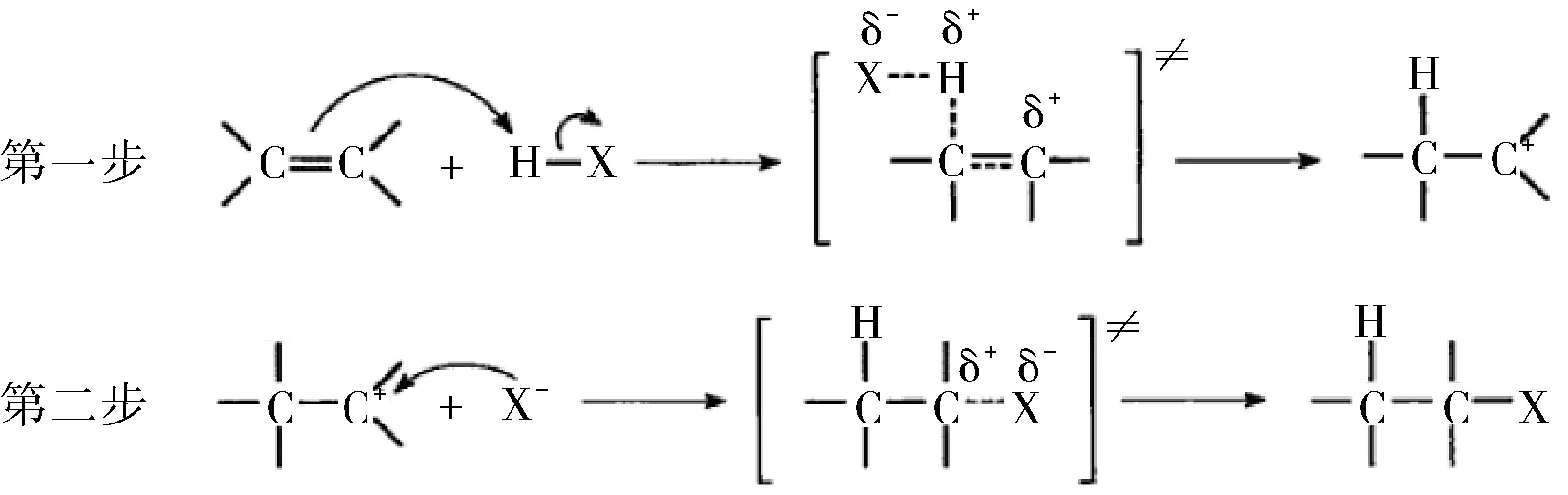
该反应机理每一步都清楚地表示出电子的转移方向。按此观点,芳香烃的亲电取代反应亦可清楚地画出每一步反应的电子转移方向,这里不再赘述。
5 结 语
有机化学反应的过程就是旧键的断裂与新键的形成过程,一根化学键代表一对电子,电子的转移无一不是从电子源转移到电子穴,只要找准电子源与电子穴定可准确而清晰地表述出电子的转移方向。电子源是Lewis碱,电子穴是Lewis酸。从某种意义上讲,有机反应的每一个基元反应均可看作电子源与电子源之间的置换反应,即:由强的电子源置换出弱的电子源。

