P62-ASC泛素化介导自噬对NLRP3炎症小体调节的机制研究*
张 雷,朱稀雯,何 堃,龚建平,彭自力△
(1.重庆市奉节县人民医院肝胆外科 404600;2.重庆医科大学附属第二医院肝胆外科 400010)
含NLR家族Pyrin域蛋白3(NLRP3)是由NLRP3、凋亡相关点样蛋白(ASC)和pro-半胱氨酸天冬氨酸酶-1(caspase-1)组成的蛋白复合体,是NLR家族中目前研究最明确的成员。它能被多种分子、细菌或病毒激活,促进白细胞介素(IL)-18、IL-1β等炎性因子的成熟与分泌,与痛风、2型糖尿病、阿尔茨海默病、非酒精性脂肪肝等炎性疾病有关[1]。
自噬对机体的正常运转必不可少,其参与了机体免疫应答并对炎性反应进行调节。有研究证实,在棕榈酸(PA)导致的肝细胞凋亡中,自噬可对细胞起保护作用[2]。还有报道称自噬可以通过降解NLRP3炎症小体抑制IL-1β的产生[3]。P62是自噬最主要的结合蛋白,它含有TRAF6结合域(TB),LC3互相作用区域(LIR)及泛素结合区域(UBA)。因此,其可以和多聚泛素化链结合,识别泛素化底物并运至自噬体[4]。
在非酒精性脂肪肝中P62是否可以介导并识别ASC的泛素化,从而促进NLRP3炎症小体降解还有待证实。因此,本实验将检测PA刺激Kupffer细胞(KCs)后,P62与ASC的互相作用及泛素化水平,探讨自噬体对炎症小体蛋白的调控机制,现报道如下。
1 材料与方法
1.1 材料
NLRP3、ASC和β-actin抗体(武汉三鹰公司产品),LC3抗体(美国Cell Signaling公司产品),P62/SQSTM1、Beclin-1抗体(美国Abcam公司产品),Anti-Ubiquitin抗体(美国Millipore公司产品)。蛋白提取试剂盒、BCA蛋白浓度测定试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳试剂盒(上海碧云天生物技术有限公司)。IL-1β ELISA检测试剂盒(武汉博士德生物工程有限公司)。
1.2 方法
1.2.1小鼠肝脏KCs的分离及处理
小鼠异氟烷吸入麻醉,消毒后逐层开腹,显露肝脏及门静脉,无菌磷酸盐缓冲液(PBS)5 mL由门静脉灌注肝脏至黄褐色。小心取下肝脏转入0.15%Ⅳ型胶原酶中,碎肝、过滤后进行梯度离心和选择性贴壁培养,得到纯化KCs[5]。KCs培养48 h后分为对照组、PA组、渥曼青霉素组、雷帕霉素组。对照组:常规培养基;PA组:检测时间点前12 h向培养基中加入PA,终浓度为0.5 mmol/L;渥曼青霉素组:50 μmol/L 渥曼青霉素预处理4 h,更换培养基后,再用0.5 mmol/L PA刺激12 h;雷帕霉素组:50 μmol/L雷帕霉素预处理4 h,更换培养基后,再用0.5 mmol/L PA刺激12 h。
1.2.2Western blot检测
按照总蛋白提取试剂盒说明书的方法提取各处理组小鼠KCs总蛋白,BCA蛋白浓度测定试剂盒检测各组KCs总蛋白浓度并计算上样量。煮沸变性后按30 μg总蛋白上样。进行SDS-PAGE电泳,并转膜至聚偏氟乙烯(PVDF)膜上,用5% 脱脂牛奶室温下封闭PVDF膜1 h。TBST洗涤3次,每次5 min,再置于4 ℃下,一抗(抗LC3、NLRP3、ASC、caspase-1、Beclin-1)孵育过夜。PVDF膜在室温下漂洗3次,置于稀释之后的二抗中,室温孵育2 h。取出PVDF膜轻轻漂洗后放入干净培养皿,将1∶1配制的电化学发光(ECL)显色液均匀涂抹于PVDF膜上,在Bio-Rad曝光仪中曝光、采图。
1.2.3IL-1β测定
用ELISA检测KCs上清液中IL-1β表达水平,按试剂盒说明操作。
1.2.4激光共聚焦检测P62和ASC及P62和LC3的共表达
将提取自小鼠的KCs接种于激光共聚焦专用培养皿中,给予相应处理因素。弃去培养基,用PBS洗干净后加入10%甲醛室温固定30 min。0.2%Trion-100打孔,37 ℃ 5 min,PBS洗涤3次。山羊血清滴于细胞上,37 ℃孵箱封闭1 h。滴加按比例稀释的一抗(ASC和P62),4 ℃冰箱过夜。弃去一抗,PBS漂洗3次后加入相应二抗,37 ℃暗盒中孵育2 h。PBS漂洗后,滴加DAPI染液,37 ℃暗盒中孵育5 min。漂洗晾干后滴加防猝灭剂封片,激光共聚焦显微镜采图。
1.2.5免疫共沉淀检测KCs中ASC与P62结合情况
细胞用冰PBS洗涤后,加入RIPA裂解液,4 ℃,12 000 r/min离心15 min。保留上清液,用BCA试剂盒检测每组蛋白水平并标化。将标化的蛋白裂解液加入装有磁珠的EP管中,4 ℃摩天轮旋转混匀孵育1 h,去除已经存在的抗原抗体复合物。每组上清液分为两管,分别加入抗ASC一抗和IgG抗体,均于摩天轮上4 ℃孵育过夜。然后将孵育过夜的蛋白裂解液转移至装有磁珠的EP管中,4 ℃摩天轮孵育2 h。将上述EP管置于磁力架上,吸去上清液,剩余即为磁珠-抗原抗体复合物。PBST和dilute buffer洗涤后,加入loading buffer开水煮沸8~10 min,再置于磁力架上,将上清液转入新EP管中,即为所需抗原抗体复合物。下步分析同Western blot检测。
1.3 统计学处理
2 结 果
2.1 各组KCs中LC3、Beclin-1及NLRP3炎症小体相关蛋白的相对表达水平
与对照组比较,PA组LC3Ⅱ/LC3Ⅰ转化明显增加,且NLRP3、ASC、Beclin-1和caspase-1蛋白的表达水平也明显升高(P<0.05)。渥曼青霉素组LC3Ⅱ/LC3Ⅰ较PA组低,且NLRP3、ASC、capase-1表达水平增加(P<0.05)。雷帕霉素组LC3Ⅱ/LC3Ⅰ较PA组增加,NLRP3、ASC和caspase-1表达水平较PA组下降(P<0.05),见图1。
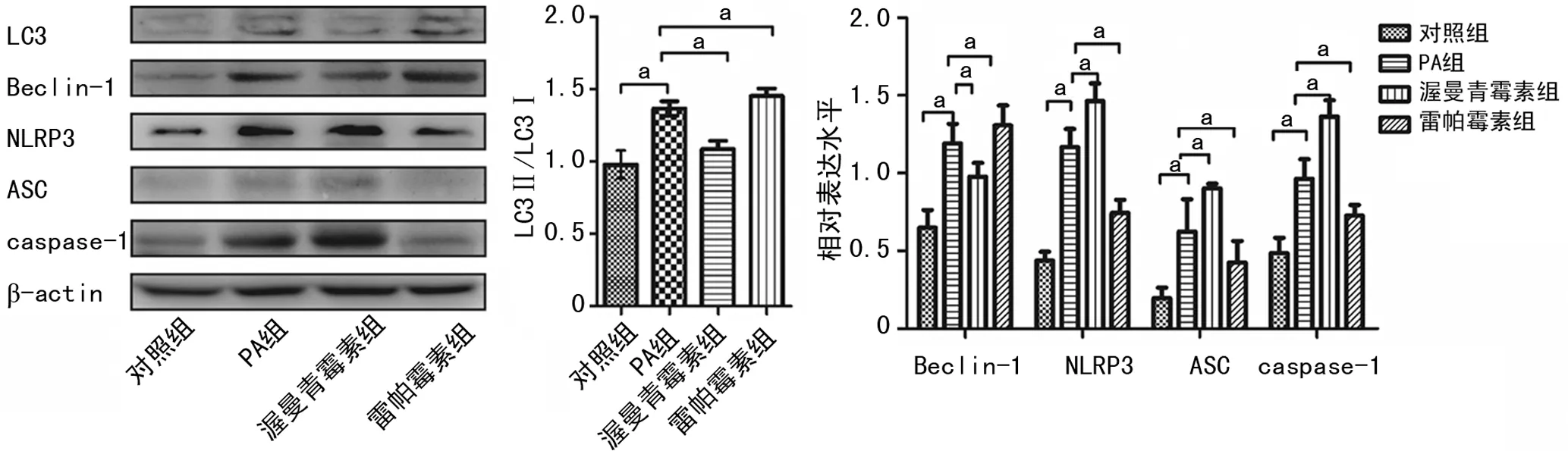
a:P<0.05。
2.2 各组KCs上清液IL-1β的表达水平
与对照组比较,PA组IL-1β水平明显升高(P<0.05)。渥曼青霉素组IL-1β水平较PA组进一步升高(P<0.05);而雷帕霉素组IL-1β水平较PA组明显降低(P<0.05),见图2。
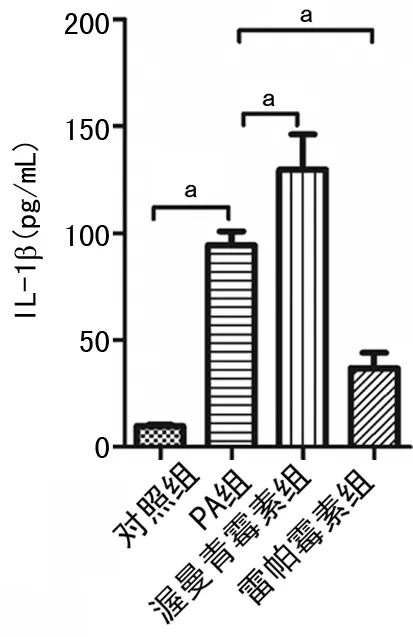
a:P<0.05。
2.3 P62与ASC共定位表达
绿色荧光抗体标记ASC;红色荧光抗体标记P62,激光共聚焦显微镜观察各组KCs中P62、ASC的表达。PA组P62和ASC表达水平均较对照组均明显增加。P62与ASC存在共定位表达,且PA组共定位关系增强,见图3。
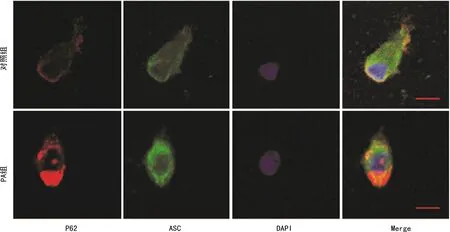
标尺:10 μm。
2.4 LC3与P62共定位表达
绿色荧光抗体标记LC3;红色荧光抗体标记P62,激光共聚焦显微镜观察各组KCs中P62和LC3的表达。PA组P62和LC3表达水平均较对照组均明显增加。P62与LC3存在共定位表达,且PA组共定位关系增强,见图4。
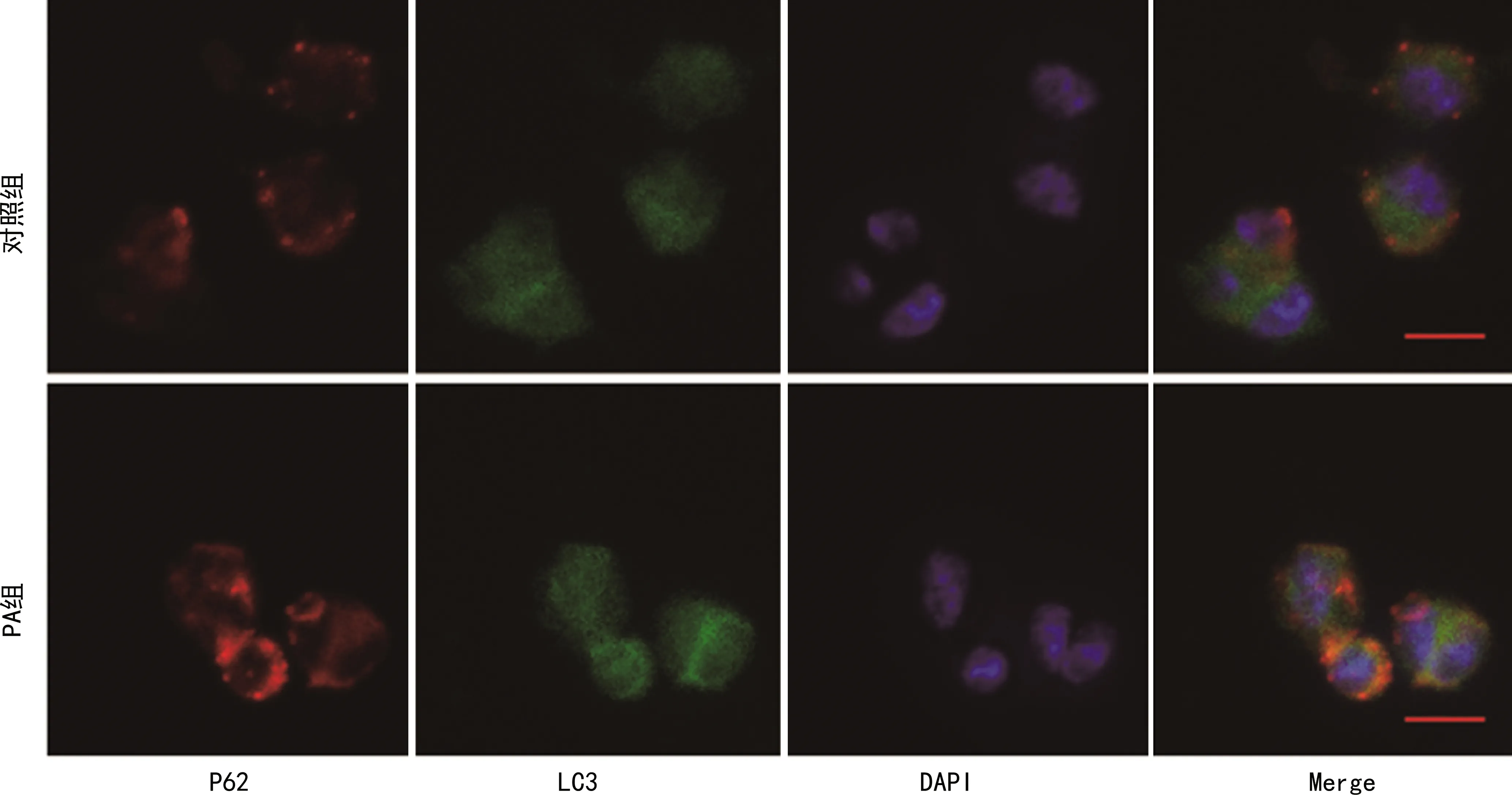
标尺:10 μm。
2.5 免疫共沉淀检测小鼠KCs中LC3、P62和ASC的结合情况
PA刺激的KCs中ASC表达较对照组明显增多,同时,与ASC结合的蛋白复合体中LC3和P62表达水平也明显增多,见图5。

图5 免疫共沉淀检测小鼠KCs中LC3、P62和ASC的结合情况
2.6 PA刺激前后ASC蛋白复合物总泛素化水平的变化
由于ASC-P62-LC3具有相互作用,P62具有识别泛素化蛋白的能力,因此进一步研究ASC的泛素化水平。Western blot 检测ASC泛素化水平结果发现PA能明显诱导ASC总蛋白增加,同时泛素化ASC也明显升高,见图6。

图6 PA刺激前后ASC蛋白复合物总泛素化水平的变化
3 讨 论
近年来,自噬和NLRP3炎症小体间的相互作用受到广泛关注。实验中,激光共聚焦显微镜证实KCs中ASC与P62、LC3存在共定位,且在PA刺激后,ASC与P62、LC3的共定位颗粒数增加,提示P62在自噬和NLRP3炎症小体的链接中起重要作用。免疫共沉淀的结果显示ASC与LC3、P62确有互相作用,且在PA刺激下其形成的蛋白复合体数量增多,这进一步证实P62介导ASC与LC3的连接。
P62是一种由应激产生的蛋白,参与多种信号通路,且在细胞增殖、分化中发挥作用[6]。同时,它也是维持线粒体形态和功能的关键分子,参与糖尿病、肥胖、肿瘤等多种疾病发生、发展过程[7]。P62还是雷帕霉素靶蛋白(mTOR)的组成部分,其对S6K1磷酸化,是调节氨基酸激活的mTOR信号所必需的[8]。作为一种泛素结合蛋白,P62是自噬体最重要的结合蛋白。在自噬过程中,P62识别并结合泛素化蛋白,与LC3Ⅱ形成复合体,再将受损细胞器、错误折叠蛋白等在自噬溶酶体内被降解。当细胞自噬受到抑制后,常发生P62的蓄积。因此,P62被认为是反映细胞自噬活性的标志物之一[9]。
在细胞质中,P62能通过PB结构域,形成P62-泛素化结合蛋白聚合体,为进一步在自噬溶酶体中降解发挥作用[10]。本研究发现在PA刺激KCs的过程中,增强自噬能减少NLRP3炎症小体蛋白。LC3泛素化修饰系统在自噬小体形成和成熟的过程中非常重要[11]。进一步探讨泛素化修饰在NLRP3炎症小体降解中的作用发现,PA刺激下P62、LC3与ASC形成复合物增多;同时,检测ASC的泛素化水平发现,ASC的泛素化水平在PA刺激后也明显增加。因此,推测自噬体能降解NLRP3炎症小体水平,这一过程是通过P62识别和结合炎症小体中泛素化的ASC分子而实现的。
近年来,有研究表明蛋白的两种降解机制——泛素化-蛋白酶体系统和自噬是存在联系的,而不是完全独立的系统。当蛋白酶体系统受抑制,自噬水平将增高,表明这两个系统可能是相互支持的[12]。作为重要的选择性自噬结合蛋白,P62通过UBA、LIR及PB1结构域将泛素化蛋白送入自噬溶酶体中降解;同时P62也可将泛素化蛋白送入蛋白酶体降解,将蛋白降解的两种机制联系起来[13-14]。P62的TB结构域可与TRAF6结合,TRAF6是一种经典多功能的E3连接酶,而P62-TRAF6还可通过调节受体转运参与细胞信号的调节[15-16]。在P62-ASC介导的自噬对NLRP3炎症小体的降解中TRAF6是否扮演角色还有待进一步实验。
综上所述,在PA刺激KCs后,自噬体与NLRP3炎症小体的表达增加且互相作用增强,P62也同步升高,P62-ASC泛素化促进P62将NLRP3炎症小体转运至自噬体,在自噬调节NLRP3炎症小体降解的机制中有重要作用。
——雷帕霉素

