脱氧血红蛋白与吸入氧气浓度乘积对神经重症患者发生低氧血症的诊断价值研究
李国歌,杨中华,史一君,钱玲烨,Rasha Alsamani Osman,杨 波,张长青,刘丽萍,张国军△
首都医科大学附属北京天坛医院:1.实验诊断中心;2.神经重症医学科,北京 100070
脑卒中是一种常见的高发病率、高致残率和高病死率的脑部疾病[1]。缺氧已被证明是卒中后痴呆的独立临床危险因素[2],因此密切监测脑卒中患者的血氧状态,维持其血氧平衡对脑卒中患者至关重要。血氧分压(PaO2)及血氧饱和度(SaO2)的下降是临床医生判断低氧血症的主要依据[3]。然而当患者低氧血症合并贫血时,虽然SaO2结果正常,但患者却可能已经存在一定程度的缺氧,因此引入血红蛋白相关指标,可以更加全面地对低氧血症进行诊断。 本研究使用的血气分析仪相比传统血气分析仪增加了血红蛋白的相关指标,不仅可以反映患者是否存在酸碱平衡失调,还可以提供总血红蛋白(tHb)水平及各类血红蛋白所占的比例,从而有助于医生对患者是否存在低氧血症做出综合判断,而且也进一步分析了在贫血状态下,血红蛋白相关的指标对低氧血症是否具有良好的诊断效能。
1 资料与方法
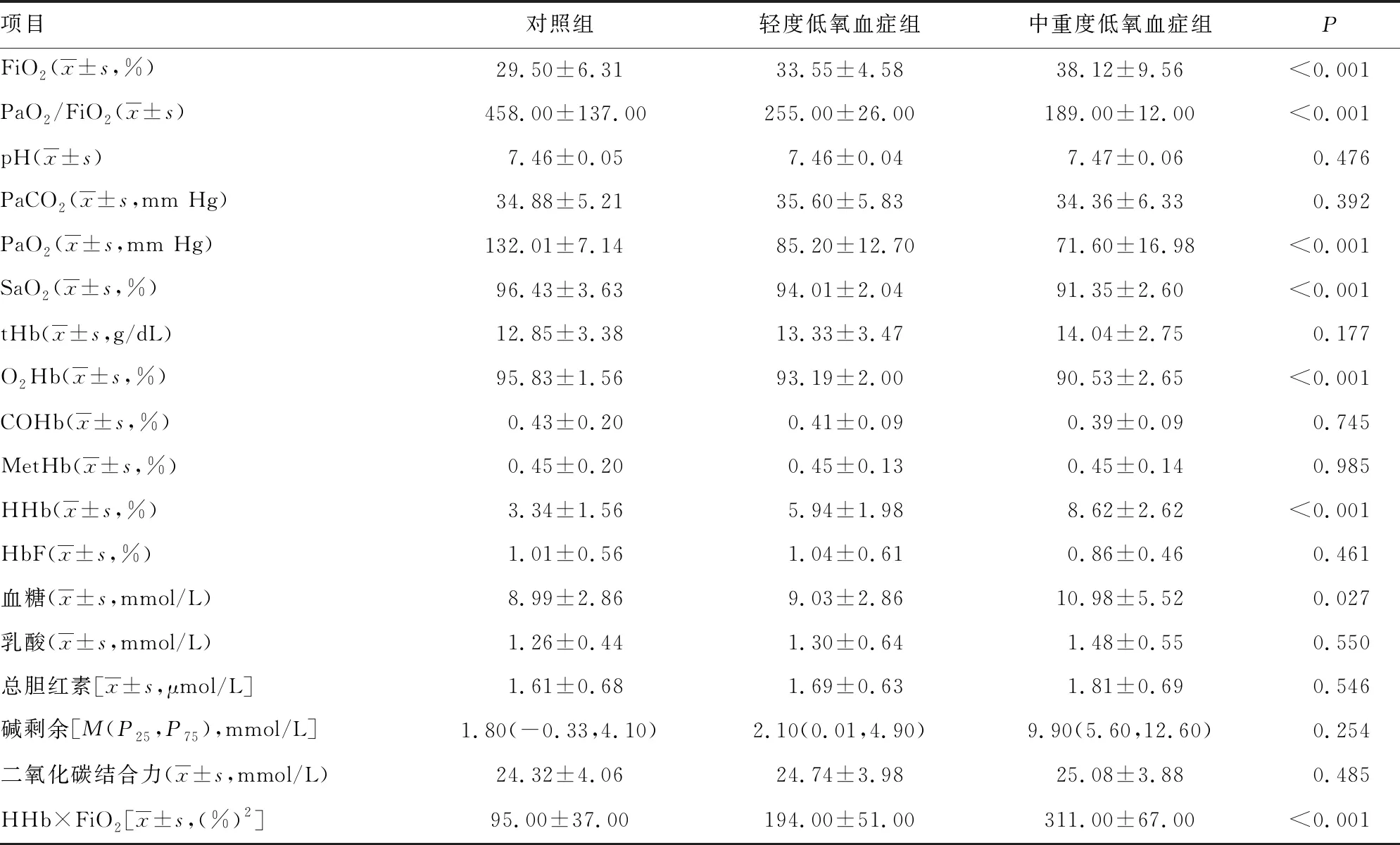
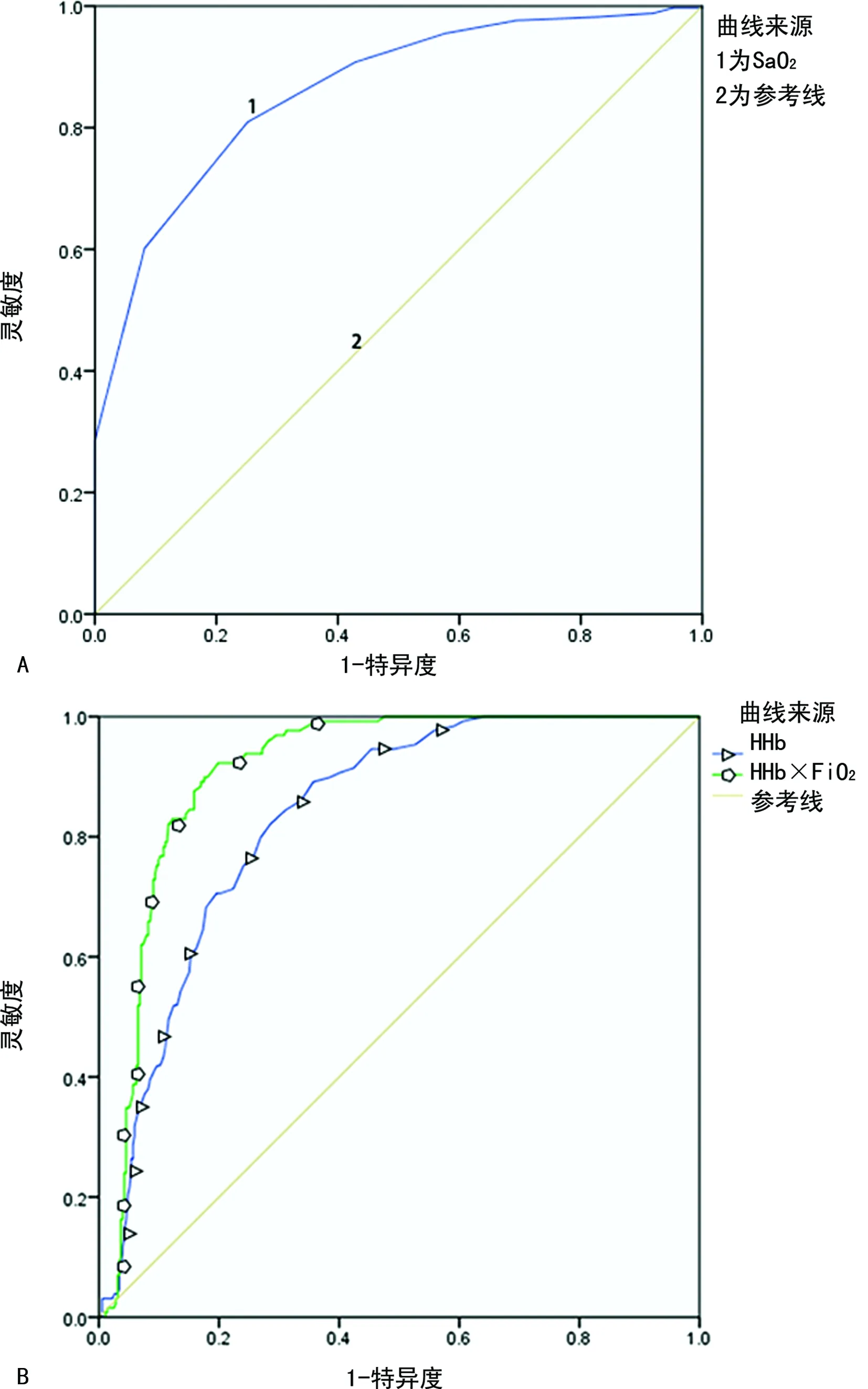
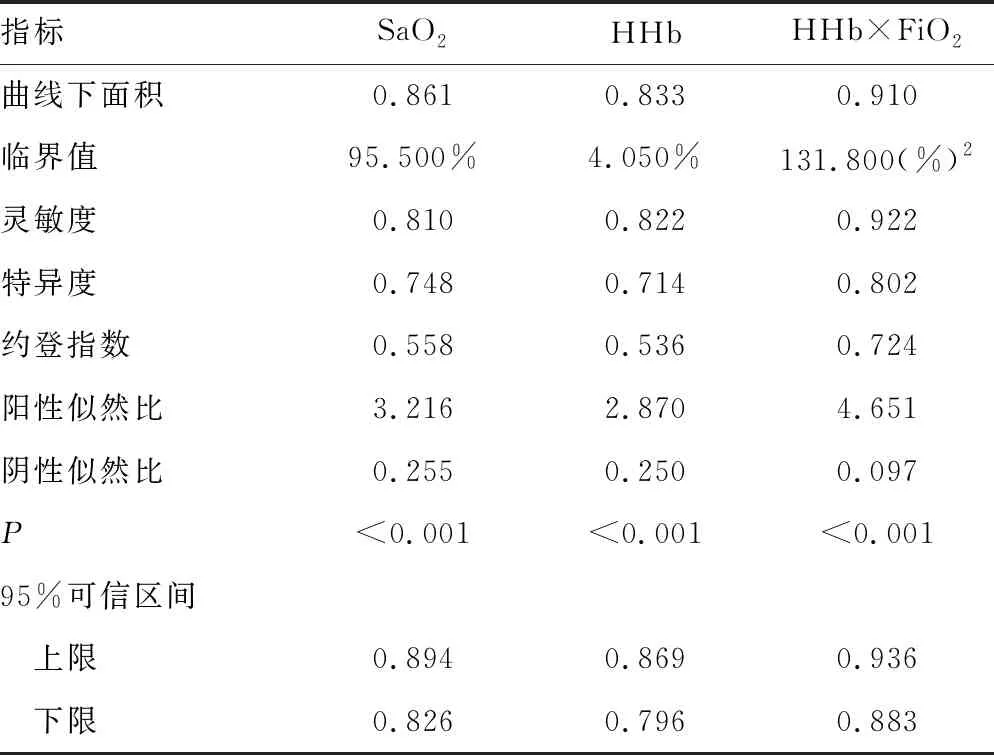
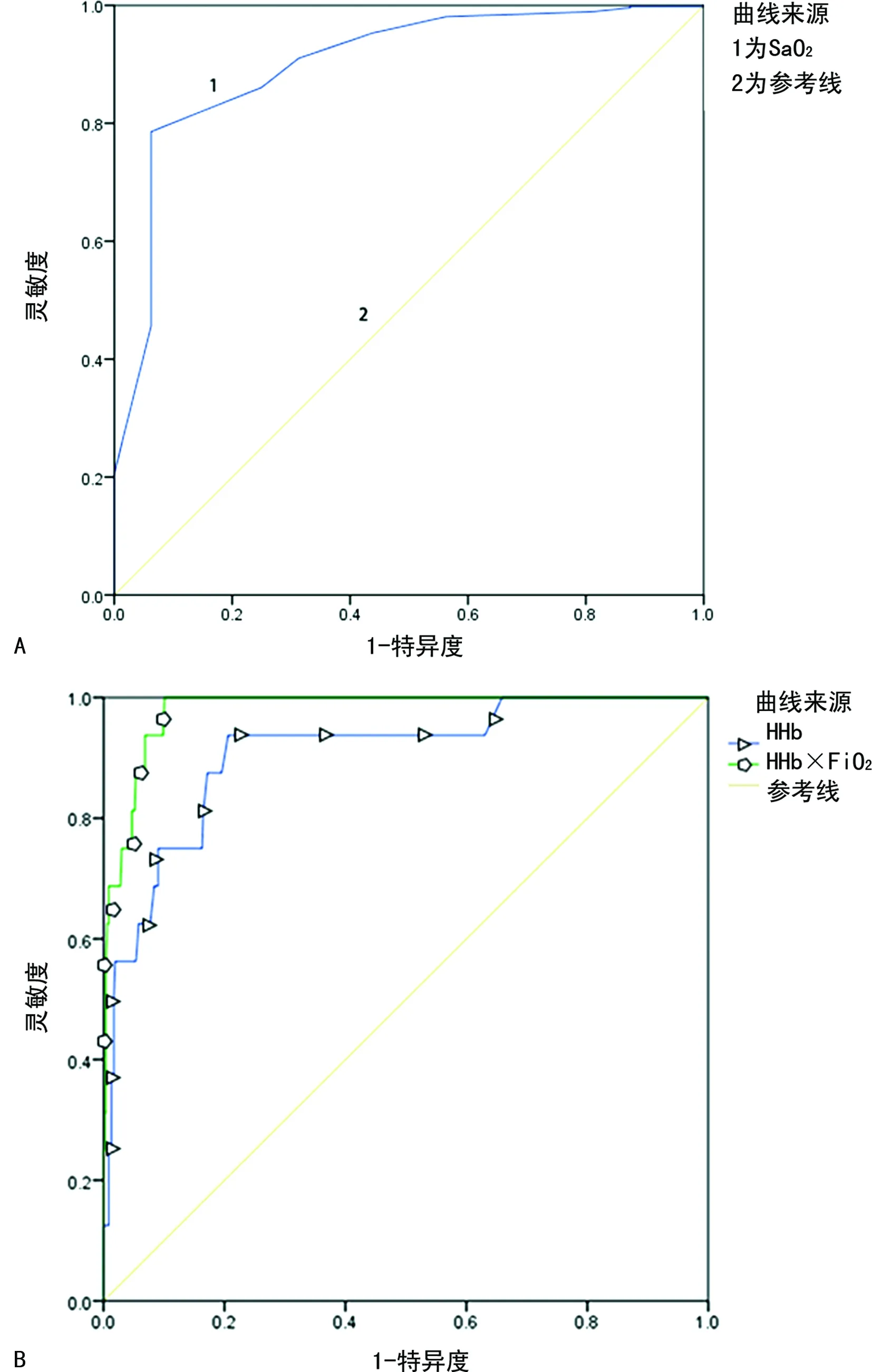
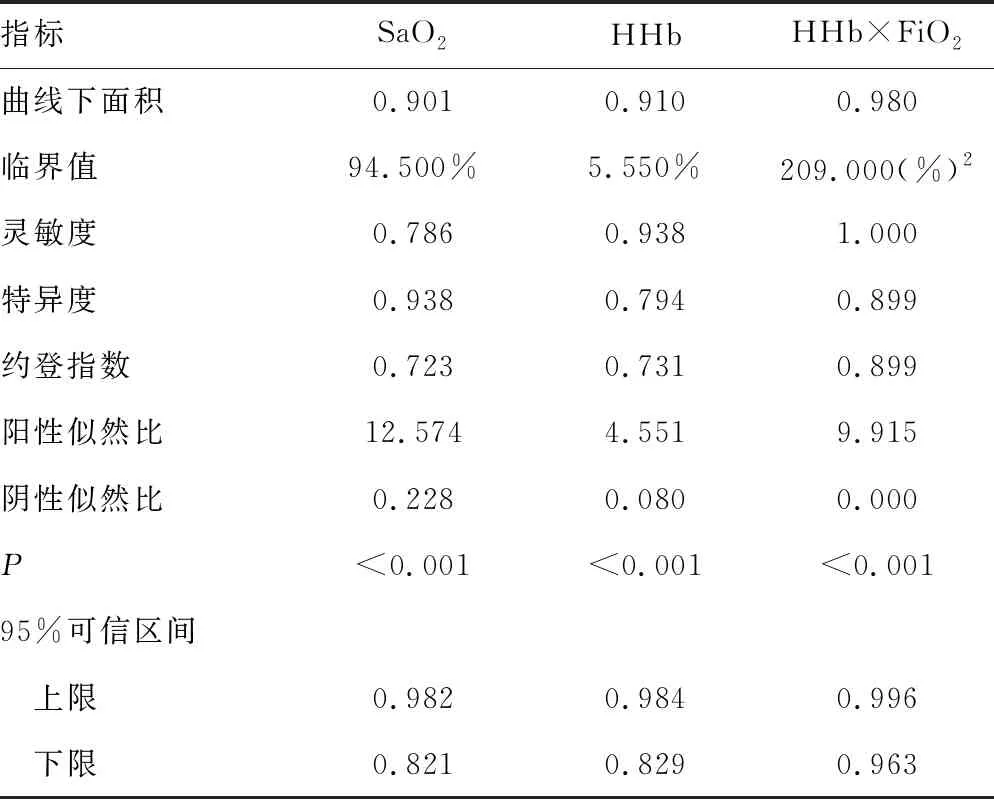
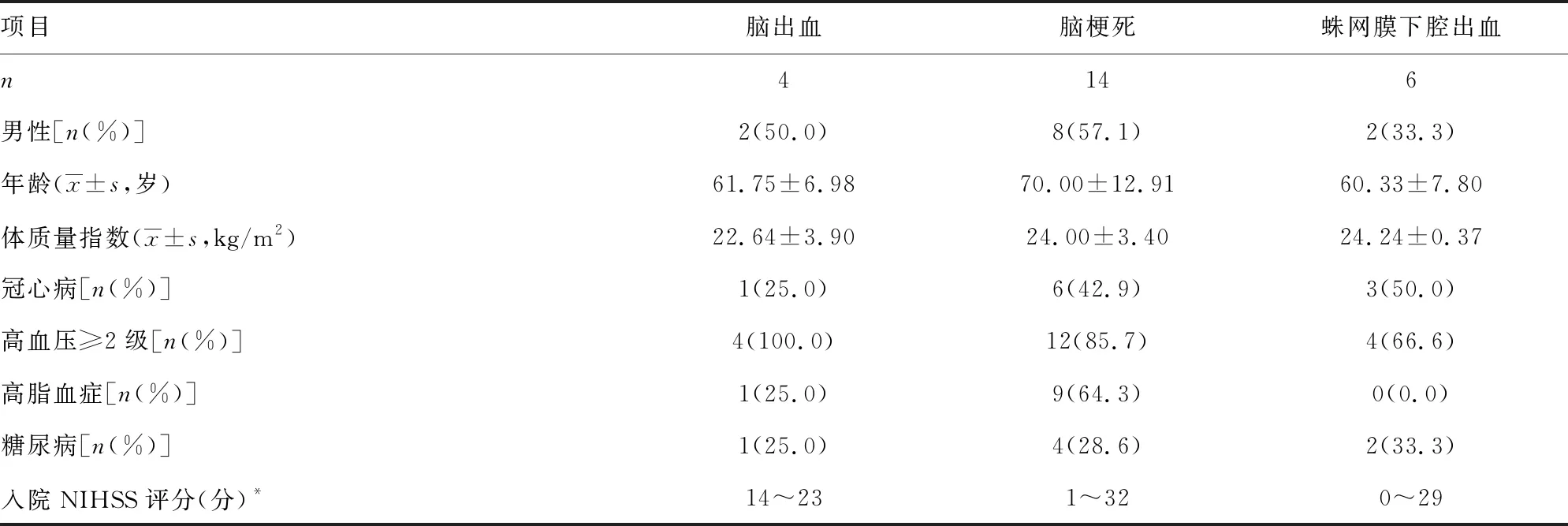
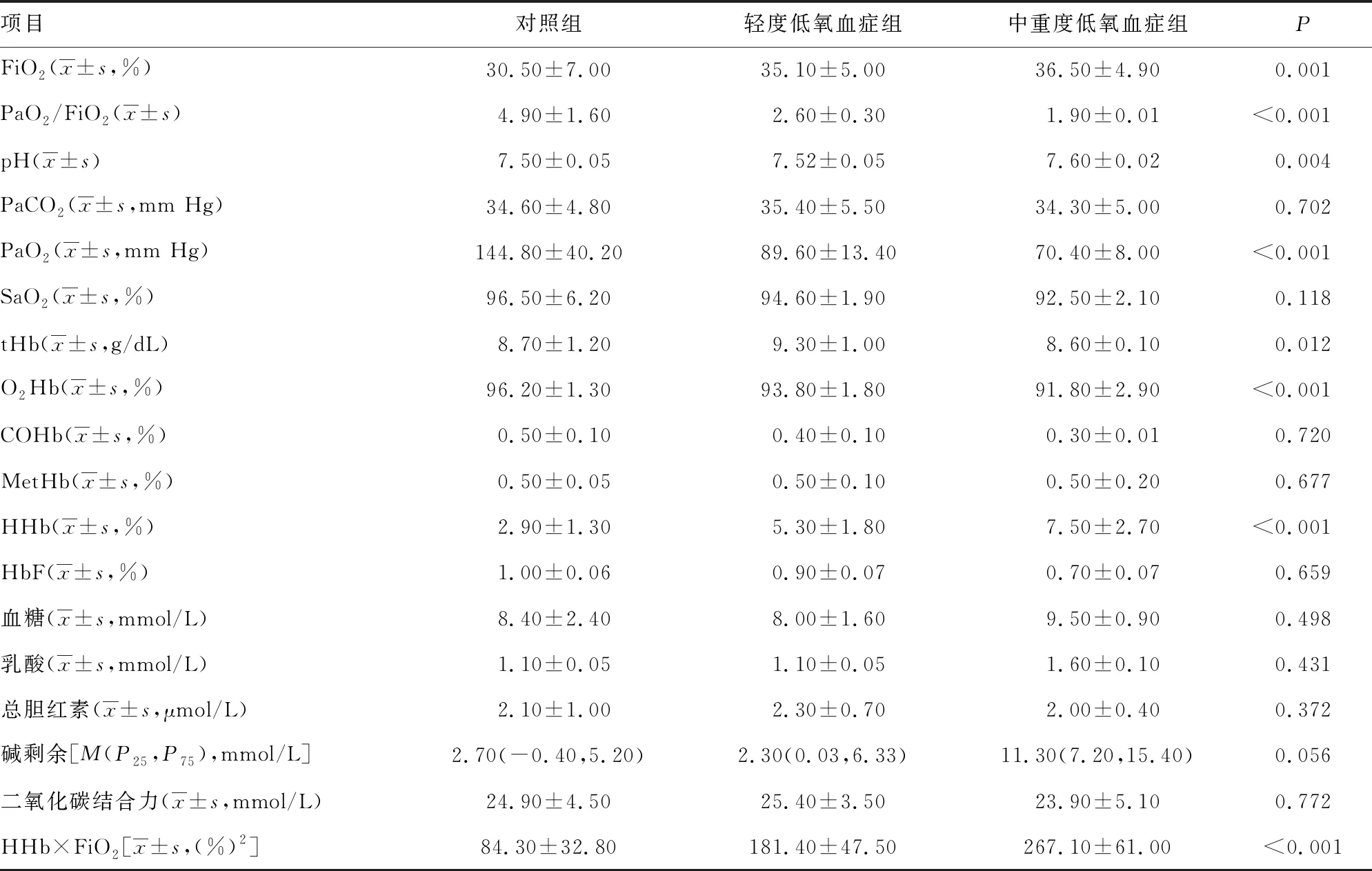
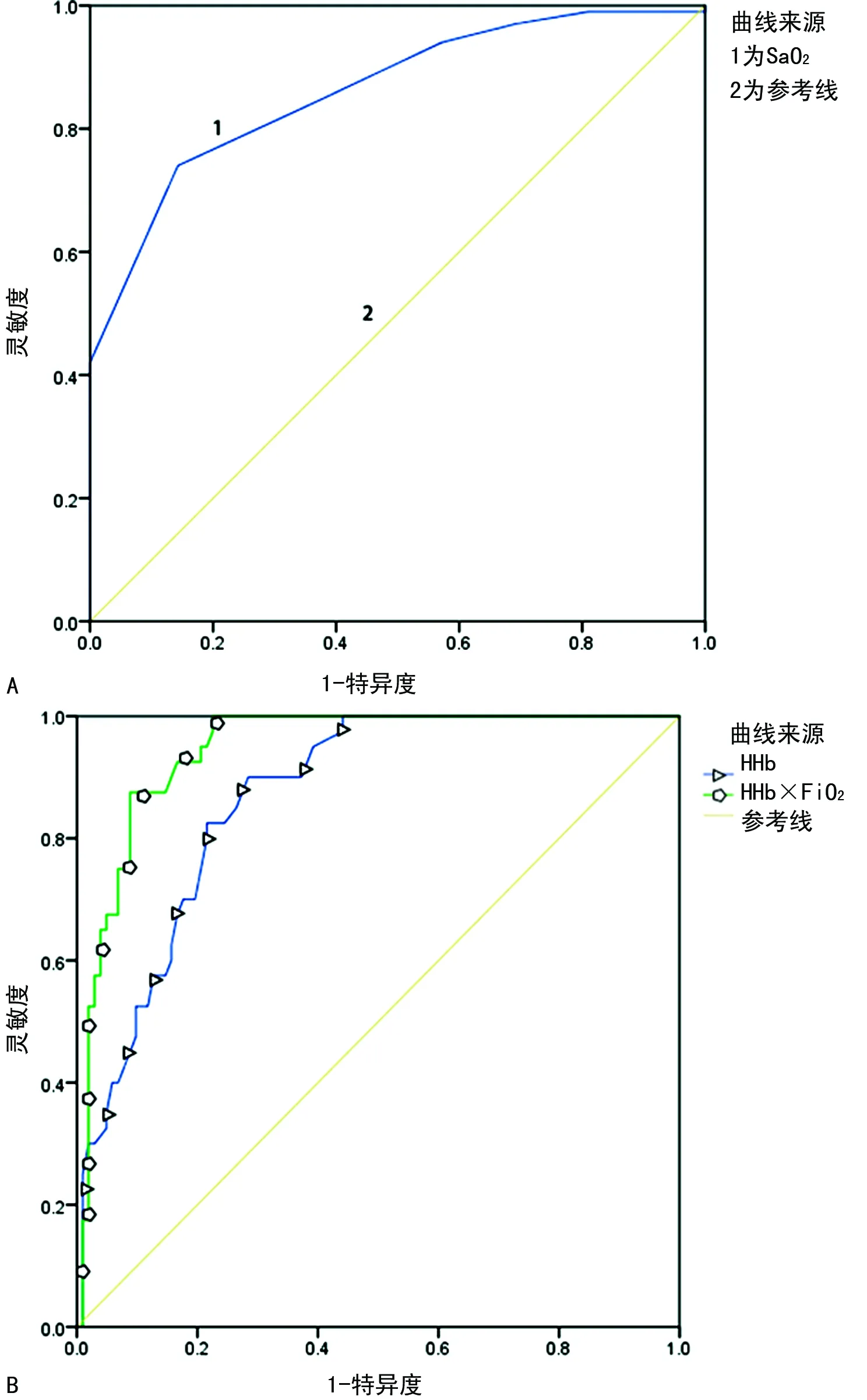
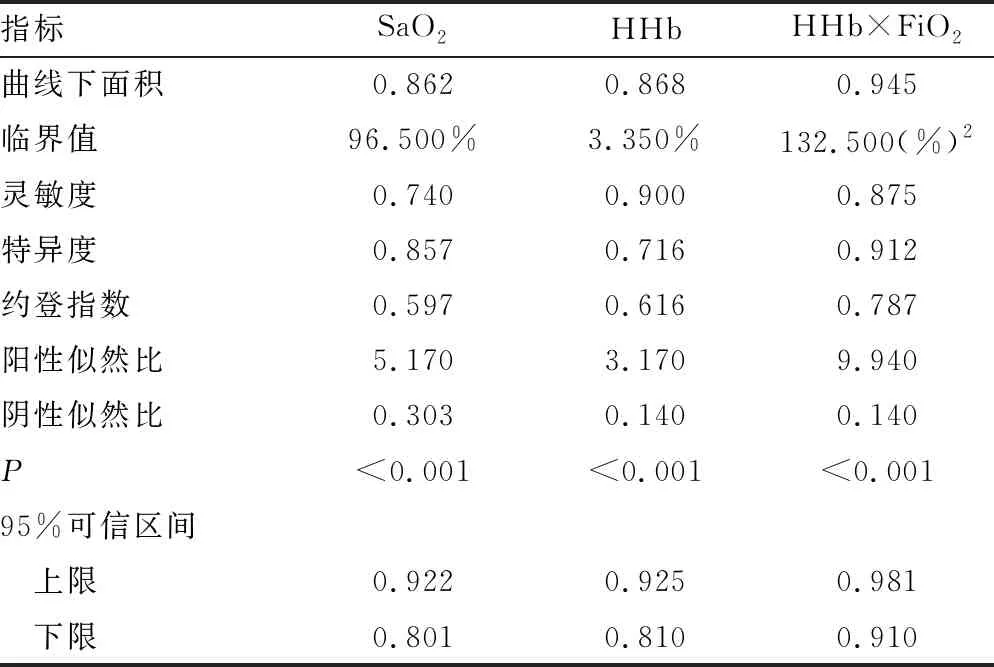
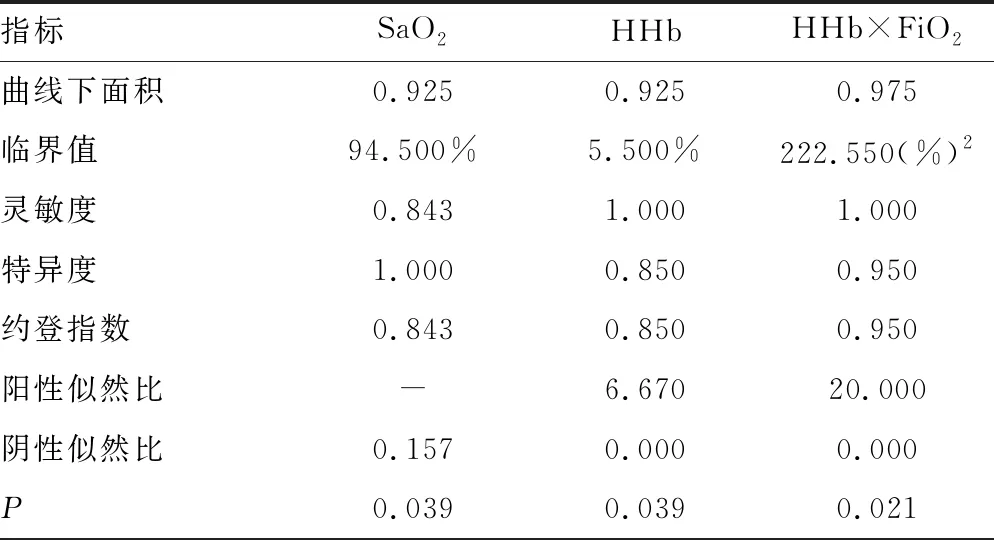
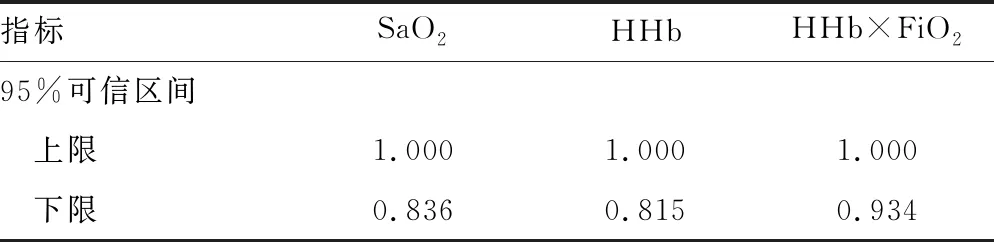
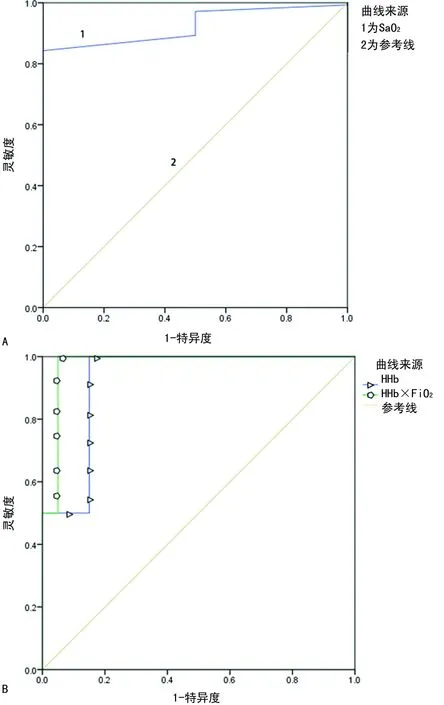
1.1一般资料 选取本院2018年6—9月神经重症医学科收治的77例脑卒中患者作为研究对象,其中脑梗死45例,脑出血、蛛网膜下腔出血各16例;77例脑卒中患者共有24例出现贫血,其中脑梗死14例,脑出血4例,蛛网膜下腔出血6例,上述患者均经专业医生根据影像结果和临床表现确诊。排除对象:(1)病史显示脑卒中前已发生酸碱平衡紊乱的患者;(2)糖尿病酮症酸中毒患者。纳入标准:吸氧条件下,PaO2>60 mm Hg,二氧化碳分压(PaCO2)<50 mm Hg。分组标准如下:氧合指数=PaO2/吸入氧浓度(FiO2)>300 mm Hg 为对照组;200 mm Hg 1.2方法 上午8:00-9:00使用一次性动脉血气针于桡动脉采集约2 mL的动脉血标本,应用Prime Plus血气分析仪(美国 Nova Biomedical 公司,Waltham,MA)分析患者的血气指标,并读取结果。收集患者住院期间血气指标pH、PaO2、PaCO2、SaO2、tHb、氧合血红蛋白(O2Hb)、脱氧血红蛋白(HHb)、高铁血红蛋白(MetHb)、碳氧血红蛋白(COHb)、胎儿血红蛋白(HbF)及乳酸、血糖、总胆红素等检验结果。 2.13组血气指标水平比较 对照组、轻度低氧血症组和中重度低氧血症组pH、PaCO2、tHb、COHb、MetHb、HbF、乳酸、总胆红素、碱剩余、二氧化碳结合力比较,差异无统计学意义(P>0.05)。随着低氧血症出现及缺氧程度的增加,PaO2、SaO2、O2Hb水平均呈下降趋势。而对照组、轻度低氧血症组、中重度低氧血症组HHb、血糖、HHb×FiO2水平比较,差异有统计学意义(P<0.05)。轻度低氧血症组和中重度低氧血症组SaO2、O2Hb均低于其参考值下限94%、92%;乳酸及葡萄糖均高于其参考值上限1.6 mmol/L、6.11 mmol/L。见表1。 表1 3组血气指标水平比较 2.2SaO2、HHb、HHb×FiO2对低氧血症的诊断 HHb×FiO2等指标对低氧血症的诊断水平见表2。SaO2、HHb、HHb×FiO2分别取95.500%、4.050%、131.800(%)2时,ROC曲线下面积为0.861、0.833、0.910,其中HHb×FiO2的ROC曲线下面积最大,而且该指标的灵敏度和特异度(分别是0.922、0.802)高于SaO2的灵敏度和特异度(分别是0.810、0.748),见图1。患者HHb×FiO2的值越大,发生低氧血症的风险越大。 注:A为SaO2判断低氧血症的ROC曲线;B为HHb、HHb×FiO2判断低氧血症的ROC曲线。 表2 SaO2、HHb、HHb×FiO2对低氧血症的诊断效能 2.3SaO2、HHb、HHb×FiO2对中重度低氧血症的诊断 通过ROC曲线分析显示,3种指标诊断中重度低氧血症的ROC曲线下面积由大到小为HHb×FiO2、HHb、SaO2。其中HHb×FiO2在临界值209.000(%)2时诊断中重度低氧血症的灵敏度为1.000,优于SaO2的灵敏度0.786,但是特异度较SaO2稍弱。见图2、表3。 注:A为SaO2判断中重度低氧血症的ROC曲线; B为HHb、HHb×FiO2判断中重度低氧血症的ROC曲线。 表3 SaO2、HHb、HHb×FiO2对中重度低氧血症的诊断效能 2.4贫血患者的血气结果分析 贫血患者的一般资料比较见表4。从表5与表1数据比较可以看出,不论是在贫血患者或者不考虑贫血情况,PaO2、O2Hb、 HHb、HHb×FiO2指标都可以良好的区分患者是否存在低氧状态。在贫血患者中各组SaO2比较,差异无统计学意义(P>0.05)。 2.5SaO2、HHb、HHb×FiO2对贫血患者低氧血症的诊断效能 HHb×FiO2等指标对贫血患者低氧血症的诊断水平见表6。SaO2、HHb、HHb×FiO2分别取96.500%、3.350%、132.500(%)2时,ROC诊断的曲线下面积为0.862、0.868、0.945,其中HHb×FiO2的曲线下面积最大,而且该指标的灵敏度和特异度分别是0.875、0.912,高于SaO2的灵敏度和特异度,分别是0.740、0.857。见图3。与诊断所有患者相比,HHb×FiO2对贫血患者低氧血症的诊断效能明显增加,曲线下面积为0.945,高于在诊断所有患者时的曲线下面积。以上结果表明,HHb×FiO2诊断低氧血症的能力在贫血患者中较好。 表4 贫血患者的一般资料比较 表5 贫血患者各指标在不同组间比较 2.6SaO2、HHb、HHb×FiO2对贫血患者中重度低氧血症的诊断效能 通过ROC曲线分析,3种血气指标诊断贫血患者中重度低氧血症的曲线下面积由大到小依次为HHb×FiO2、HHb、SaO2。HHb×FiO2在贫血患者中诊断中重度低氧血症的灵敏度为1.000,特异度为0.950。见图4、表7。 注:A为SaO2判断贫血患者低氧血症的ROC曲线;图B为HHb、HHb×FiO2判断贫血患者低氧血症的ROC曲线。 表6 SaO2、HHb、HHb×FiO2对贫血患者低氧血症的诊断效能 表7 SaO2、HHb、HHb×FiO2对贫血患者中重度低氧血症的诊断效能 续表7 SaO2、HHb、HHb×FiO2对贫血患者中重度低氧血症的诊断效能 注:A为 SaO2判断贫血患者中重度低氧血症的ROC曲线;B为HHb、HHb×FiO2判断贫血患者中重度低氧血症的ROC曲线。 缺氧是脑卒中患者常见的临床表现,脑卒中后低氧血症的发生会增加患者的住院时间、住院病死率及残疾的严重程度[5]。因为大脑需要大量的氧气来高效产出三磷酸腺苷(ATP),用于维持神经元信号连续传递的电活性状态[6],完全快速的破坏脑血流的疾病(如脑卒中)会导致脑组织缺氧、低血糖状态,并通过多种机制最终导致细胞死亡[7],所以低氧血症会严重影响脑卒中患者的预后,导致患者出现致残或致死的结局。有研究显示tHb水平的变化也可能会影响缺血性脑卒中患者的预后[8-10]。 目前临床对低氧血症的诊断主要依靠SaO2,然而SaO2不仅受到PaO2的影响,还受到有效血红蛋白总量的限制,当患者合并贫血时,仅凭SaO2难以反映患者体内氧利用的真实情况,因此在血气中纳入血红蛋白等相关指标是十分有必要的。 本研究发现,O2Hb和HHb在不同的低氧血症分组比较,差异有统计学意义(P<0.05),采用O2Hb/ FiO2或HHb×FiO2的形式,消除FiO2对O2Hb或HHb的影响。结果发现,HHb与HHb×FiO2都随着低氧血症的加重而增加,且HHb×FiO2具有更好的诊断效能。相关研究表明[11],在脑颈内动脉严重狭窄后,灌注压降低可能会上调脑组织的氧气摄取,因此血液中HHb水平会提高。闭合性颅脑损伤小鼠模型的研究中发现[12],由于颅脑损伤后大脑的氧气输送减少,受伤部位的血液供应也减少,因此O2Hb和组织氧饱和度(StO2)在观察期间均有所下降。还有研究发现随着神经组织的代谢需求增加,O2Hb会发生暂时解耦(即O2Hb水平可以降低,而HHb水平升高),这种变化可能是由于神经组织对氧气的需求速率超过了血管的氧气输送能力[13]。以上证据都表明大脑低氧状态与HHb的升高直接相关。 有关血红蛋白与脑缺氧的机制研究[13-14],主要提出3种主要机制用于解释这种低氧条件下红细胞依赖性的脑血管舒张[7],包括:(1)ATP释放和内皮细胞一氧化氮合酶(eNOS)的后续激活;(2)HHb介导亚硝酸盐还原为NO;(3)亚硝基血红蛋白(SNOHb)介导的生物活性。目前第2种机制被广泛接受,该理论认为,在机体缺氧时,脑血管舒张依赖于HHb介导的一氧化氮和ATP的释放,进而调节脑血管的舒张,以缓解脑缺氧状态。因此,低氧血症越严重,需要越多的HHb介导亚硝酸盐还原为NO促进脑血管舒张,即低氧血症是脑缺氧的原因,HHb增高是机体为抵抗缺氧产生的结果。 但是也有研究表明,O2Hb是诱导腺苷、二磷酸腺苷和ATP局部堆积的关键因素,进而控制脑血管的舒张反应[15]。该理论认为HHb升高导致O2Hb减少,从而不能堆积足够的ATP,不能有效的刺激大脑舒张,进而引发了脑组织缺氧。即HHb的升高是原因,脑组织缺氧是结果。 不论在大脑血管舒张中起到主导作用的物质是HHb还是O2Hb,两种理论都支持在低氧血症时HHb会升高,这与本研究结果一致。更加值得关注的是,HHb×FiO2在贫血患者中诊断低氧血症的诊断效能与其在所有患者中诊断低氧血症的诊断效能相比ROC曲线下面积更高,且明显高于传统指标SaO2,证明HHb×FiO2不仅在诊断效能高于传统指标SaO2,而且在贫血患者中具有独特的诊断优越性。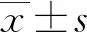
2 结 果
3 讨 论

