PD-L1在NSCLC组织中的表达及对患者预后影响的多因素分析
曾雪华, 吴 刚, 祁永健
(江苏省中医院南院呼吸科,江苏省南京市 210029)
肺癌是临床常见的胸部恶性肿瘤,占到所有癌症新发病例的17%,也是肿瘤远处转移和患者死亡的首要原因。近年来肺癌发病率呈现逐年升高的趋势,非小细胞肺癌(non-small cell lung cancer,NSCLC)占到原发性肺癌总数的80%~85%,其中近三分之二患者确诊时已处于中晚期,因此早期诊断和尽早治疗成为改善肺癌患者预后的重中之重[1]。研究显示协同刺激因子和相关调节网络在免疫应答反应过程中具有重要作用,表达异常则与肿瘤免疫逃逸之间关系密切,程序性死亡配体-1(programmed death ligand-1,PD-L1)属于协同刺激分子超家族主要成员,会造成人体免疫抑制微环境抑制T、B淋巴细胞功能,造成肿瘤细胞恶性增殖[2]。本研究分析了PD-L1在NSCLC组织中表达特点及其与肿瘤发生发展及预后的相关性,以期为临床提供依据,现报道如下。
1 资料和方法
1.1 一般资料
回顾性选取本院病理科收集的2016年1月—2017年1月90例NSCLC组织(NSCLC组)、40例癌旁正常肺组织作为癌旁正常组。NSCLC组,男56例、女34例,年龄41~78岁,平均(62.7±10.8)岁,90例NSCLC患者病理学分期依据国际抗癌联盟第8版肿瘤淋巴结转移(tumor node metastasis,TNM)分期标准:Ⅰ期患者20例、Ⅱ期患者27例、Ⅲ期患者30例、Ⅳ期患者13例;发生淋巴结转移60例;肿瘤直径≥5 cm 17例。癌旁正常组,男23例、女17例,年龄44~75岁,平均(60.8±11.8)岁。
1.2 纳入和排除标准
纳入标准:①NSCLC患者的诊断依据《外科学》人民卫生出版社第八版;②患者年龄19~79岁;③肺癌组织均经过病理学检查证实;④本研究获得医学伦理委员会的批准。排除标准:①转移性肺癌;②术后复发性肺癌;③获取癌组织标本前具有放化疗病史;④临床资料、病历资料缺失,难以纳入统计分析。
1.3 免疫组化染色
制作石蜡切片、烤片待用,常规二甲苯脱蜡并水化,阻断灭活内源性过氧化酶,随后进行抗原修复,采用柠檬酸缓冲液作为抗原修复液,在切片加入10%正常山羊血清封闭,清除血清后甩去缓冲液,加入0.04%二氨基联苯胺、0.03%过氧化氢溶液显色,采用双蒸馏水冲洗终止染色,苏木精复染30 s后使用双蒸馏水冲洗脱水透明,显微镜下进行观察。PD-L1试剂盒由上海润裕生物科技有限公司提供,克隆号22C3。
1.4 免疫组化结果判定
免疫组化染色切片的结果判定:PD-L1蛋白主要在NSCLC癌细胞的细胞膜、细胞质中表达。①依据染色深浅程度进行评分:0分、1分、2分、3分分别对应无着色、淡黄色、棕黄色、褐色甚至黑色;②依据染色细胞的占比情况进行评分:阳性染色细胞占比≤10%则评为1分、染色细胞比例范围10%~50%评为2分、染色细胞占比范围50%~75%评为3分、当染色细胞占比>75%评分为4分。蛋白染色深浅评分及染色细胞占比评分相乘为免疫组化染色的总分,<3分为阴性“-”;3~5分为阳性“+”;6~9分为较强阳性“++”;>9分为强阳性“+++”。
1.5 PD-L1蛋白阳性判定及随访
分析NSCLC病灶组织标本中的PD-L1蛋白表达与相关参数的关系,NSCLC组织中PD-L1蛋白阳性表达与患者预后的关系。对所有患者进行电话联系,跟踪随访,随访周期3年。
1.6 统计学方法
2 结 果
2.1 PD-L1蛋白阳性表达率情况
90例NSCLC中PD-L1蛋白表达阳性72例为PD-L1阳性组,表达阴性18例为PD-L1阴性组。NSCLC组标本中PD-L1蛋白阳性表达率80.00%,癌旁正常组阳性表达率5.00%,NSCLC组高于癌旁正常组(χ2=63.526,P<0.05,表1,图1)。

表1 PD-L1蛋白阳性表达率情况对比 单位:例(%)
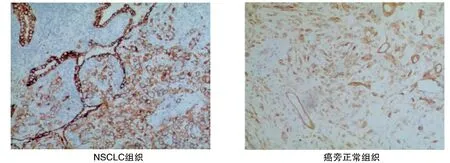
图1 PD-L1蛋白免疫组化染色结果(SP,100×)
2.2 NSCLC病灶组织标本中的PD-L1蛋白表达与临床病理学因素的关系
肺癌组织学分化程度、是否发生淋巴结转移、不同临床分期的NSCLC患者PD-L1蛋白阳性表达率组间比较,差异均有统计学意义(P<0.05);在不同年龄、性别、病灶直径大小的NSCLC患者中,PD-L1蛋白阳性表达率间差异无统计学意义(P>0.05,表2)。
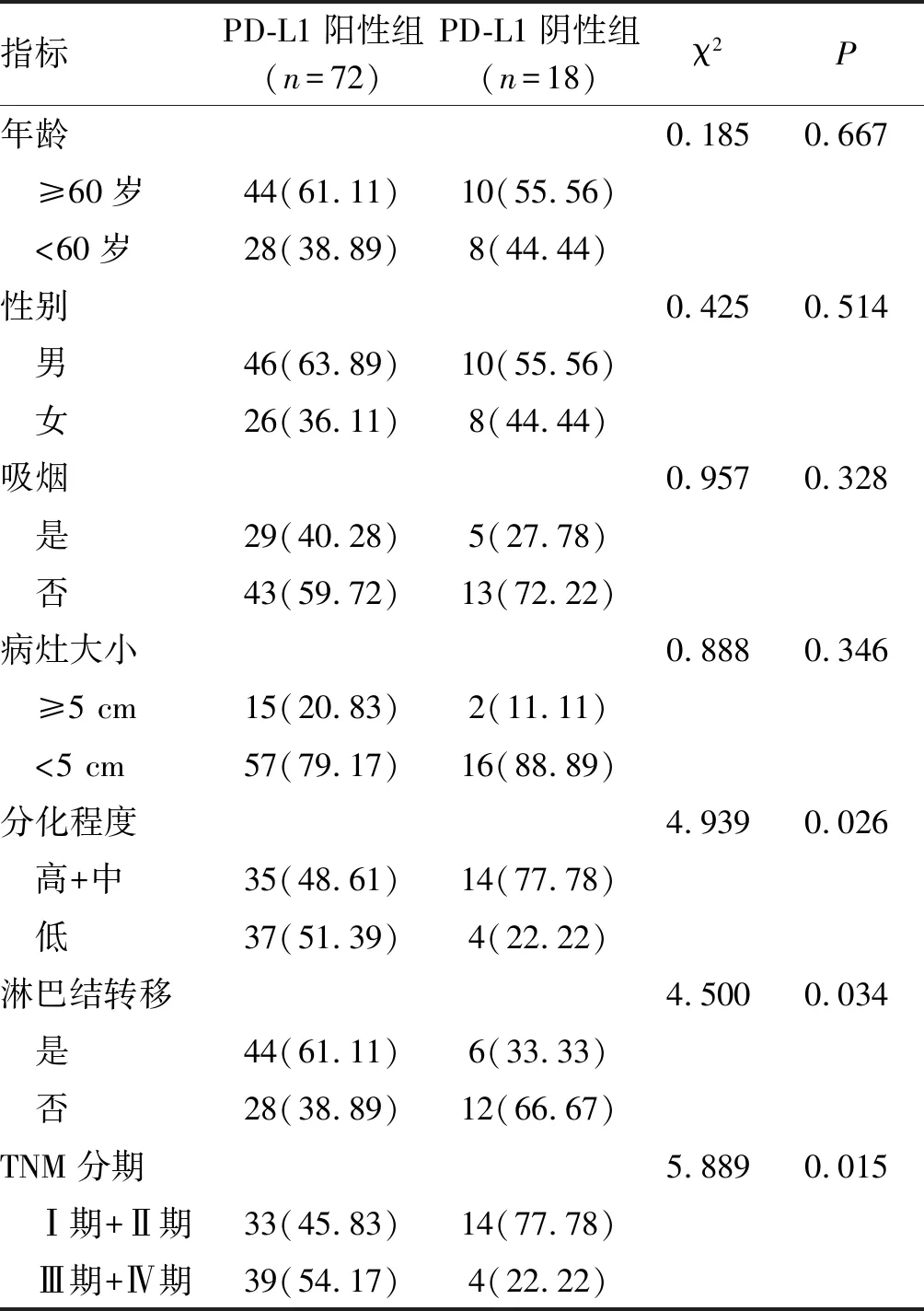
表2 NSCLC病灶组织标本中的PD-L1表达与相关参数的关系 单位:例(%)
2.3 NSCLC组织中PD-L1蛋白阳性表达与患者预后的关系
所有患者得到随访,其中PD-L1阳性组失访6例(8.33%),PD-L1阴性组失访1例(5.56%)。PD-L1蛋白阳性表达的NSCLC患者3年生存率(19.70%)显著低于阴性患者的52.94%(P<0.05)。PD-L1蛋白阳性表达患者的中位生存时间21.0月,阴性表达患者中位生存时间28.0月,两组比较差异有统计学意义(Log Rank (Mantel-Cox)=6.019,P=0.014;图2)。
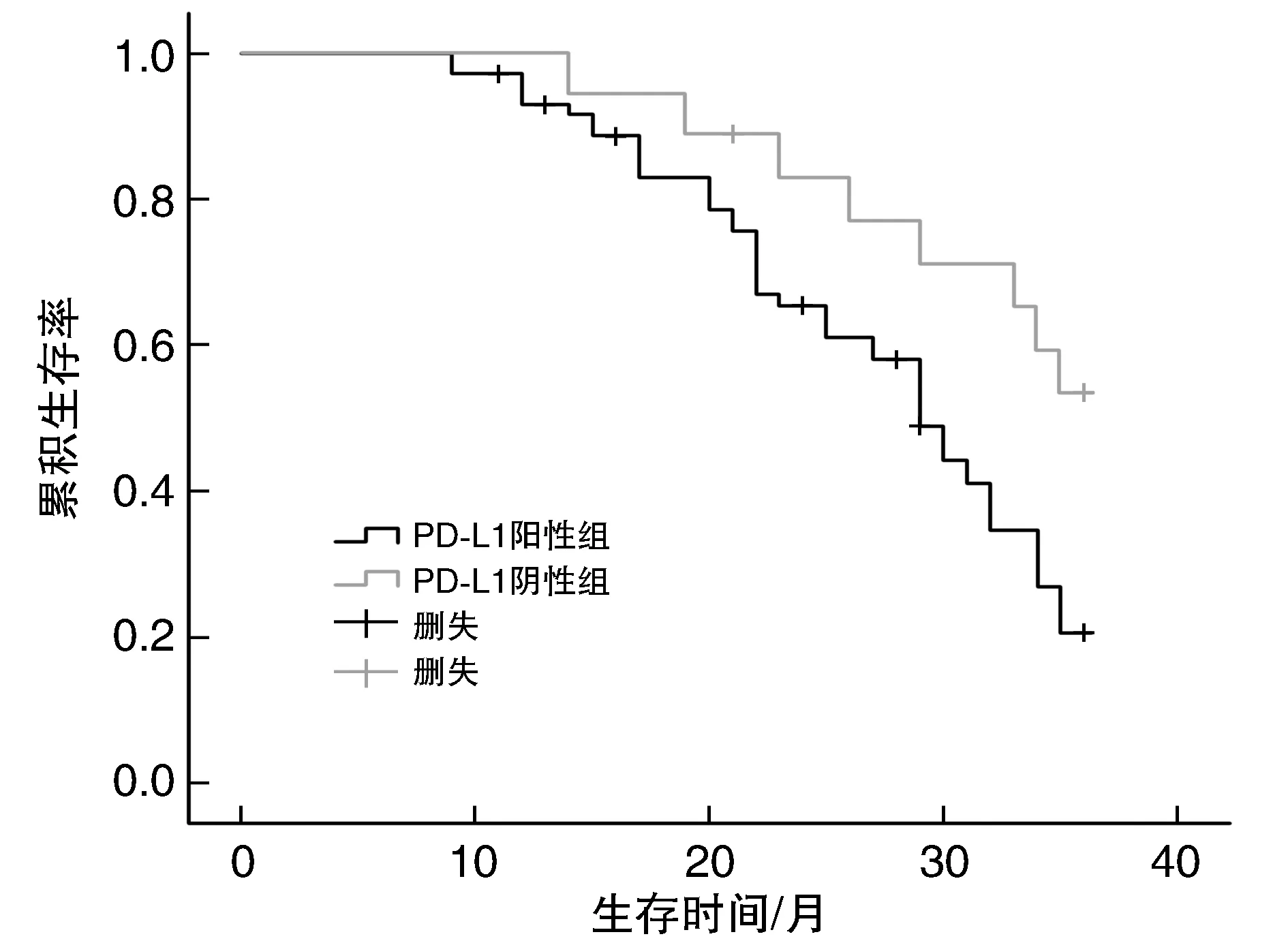
图2 NSCLC组织中PD-L1蛋白表达与患者远期预后关系函数图
2.4 多因素分析结果
以患者的3年生存率作为因变量,TNM分期、分化程度、淋巴结转移、PD-L1蛋白表达作为自变量,采用非条件Logistic回归分析,结果显示:TNM分期增高、发生淋巴结转移、PD-L1蛋白阳性表达是NSCLC患者不良预后的独立危险因素(P<0.05);分化程度对NSCLC患者的预后影响不明显(P>0.05,表3)。
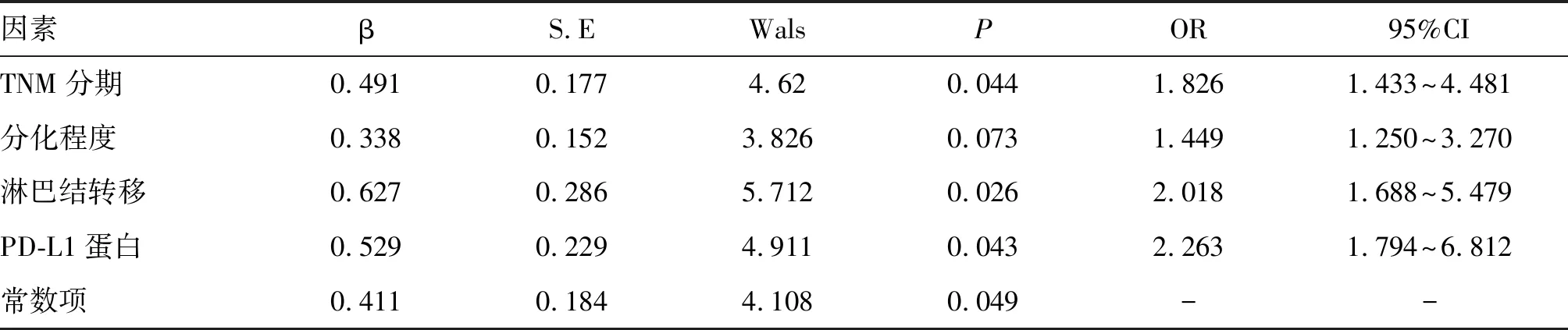
表3 多因素分析结果
3 讨 论
肺癌属于全球范围内发病率和死亡率位居首位的恶性肿瘤,近年来发病率逐年提升,在中国,空气环境污染、工业化加速以及人口老龄化等多种因素导致肺癌的发病风险越来越高。早期肺癌病灶十分隐匿,虽然CT检查在诊断肺癌中的地位越来越重要,但是潜在的辐射诱发癌变风险和检查费用高昂导致部分患者无法接受,而其他诸如超声内镜引导支气管黏膜活检术等诊断方式的准确性较高,但操作复杂,无法在临床普及,因此多数肺癌患者就诊时已处于晚期,失去了最佳的手术时机[3-4]。另一方面,目前采取全身化疗方法虽然可以适度延长患者生存期,但是传统的细胞毒药物疗效已经达到平台期,肿瘤对临床使用的化疗药物存在一定的耐药性,而且对患者正常组织与细胞也会产生杀伤作用,需要寻求新的抗肿瘤靶点以提升患者临床治疗效果[5-6]。肿瘤细胞侵犯后集体动态平衡被打破,免疫细胞具有识别、清除非己抗原作用,然后恶性肿瘤能够建立适应自身生长的微环境,而且建立时间段,人体免疫监视出现漏洞,肿瘤细胞会继续增殖并发生转移。肿瘤的微环境一般是多种细胞、细胞外基质以及各种细胞因子构成,能够对细胞的生长、分化、成熟、凋亡以及细胞表面相关因子的分泌、表达进行调节,这样人体免疫系统可以正常发挥作用[7-9]。
本文观察了程序性死亡配体-1(PD-L1)变化在非小细胞肺癌中的变化,该因子是I型跨膜糖蛋白,一级结构具有290个氨基酸,主要包括胞外区、疏水跨膜一级尾部胞质区既可以表达在活化T细胞、B细胞等细胞中,也可以在多种恶性肿瘤细胞表面进行表达[10-12]。研究发现PD-1/PD-L1属于CD28/B7家族中重要负性协同刺激分子通路,这一通路激活后会促进T细胞凋亡过程,同时抑制效应性T细胞活化,因此能够参与肿瘤细胞免疫逃逸过程[13]。此外,PD-L1同非小细胞肺癌的分期以及淋巴结转移之间密切相关,表达程度同肿瘤的负荷与累计范围之间关系密切,PD-1与PD-L1结合后可以促进T细胞衰竭与凋亡,肿瘤细胞可以免受免疫细胞杀伤,造成肿瘤细胞增殖加速,肿瘤负荷加重,肿瘤出现局部侵犯和远处转移[14-15]。有学者应用免疫组织化学法检测了20例PC石蜡包埋组织标本中PD-1和PD-L1的蛋白表达情况发现,PD-1和PD-L1的表达在40%左右的PC患者中呈阳性,其中,吸烟类患者肿瘤组织中PD-l的阳性表达率明显高于不吸烟患者,结果提示PD-1和PD-L1的阳性表达可能与PC的发生、发展存在一定的相关性,与本研究结果相似[15]。
本研究显示PD-L1在NSCLC组织中呈现高表达,NSCLC组织中的PD-L1阳性表达与患者临床分期、肿瘤分化程度、发生淋巴结转移具有显著的相关性,说明NSCLC可能利用PD-L1肿瘤抑制性通路发生免疫逃逸,此通路可能成为NSCLC治疗的新靶点。采用非条件Logistic回归分析,TNM分期增高、发生淋巴结转移、PD-L1阳性表达是NSCLC患者不良预后的独立危险因素,说明上述因素同非小细胞肺癌患者预后具有密切关联性,可以作为评定患者预后的重要指标。本研究优势在于证实了PD-L1表达同NSCLC发生发展具有密不可分关系,有望成为治疗的新靶标以及预后的独立预测指标,但是本研究属于回顾性分析,由于病理类型选择以及患者数量不一致可能导致本实验结果产生偏倚,有待进一步开展深入研究。
综上所述,PD-L1在NSCLC组织中表达程度上调,并且与患者肿瘤发生、不良预后具有显著的关系。

