γ-氨基丁酸和2-乙酰-1-吡咯啉代谢通路在水稻籽粒发育过程中的变化分析
潘阳阳 陈宜波 王重荣 李宏 黄道强 周德贵 王志东 赵雷 龚蓉 周少川
γ-氨基丁酸和2-乙酰-1-吡咯啉代谢通路在水稻籽粒发育过程中的变化分析
潘阳阳 陈宜波 王重荣 李宏 黄道强 周德贵 王志东 赵雷 龚蓉 周少川*
(广东省农业科学院 水稻研究所/广东省水稻育种新技术重点实验室, 广州 510640;*通信联系人, E-mail: xxs123@163.com)
结合代谢组和转录组技术,分析香稻和非香稻不同发育时期籽粒中γ-氨基丁酸(GABA)和2-乙酰-1-吡咯啉(2AP)代谢通路主要化合物和基因的动态变化,为高含量GABA和2AP的水稻育种提供理论依据。本研究收集优质香籼稻美香占2号和优质籼稻黄华占花后8 d(乳熟期)、花后15 d(蜡熟期)、30 d(完熟期)的脱壳籽粒和花后40 d收获的籽粒的精米,对各样本采用LC-MS/MS和RNA-seq技术进行代谢产物检测和转录表达分析,分析两个水稻品种GABA和2AP代谢通路相关化合物的空间分布以及含量变化特征。代谢组数据PCA分析表明两个水稻品种乳熟期籽粒和花后40 d收获的籽粒的精米明显分离,蜡熟期和完熟期籽粒分离不明显。代谢组共鉴定出623种代谢物,四个时期差异代谢物合计161个。GABA和2AP通路中9个代谢物被检出,两个水稻品种的相关代谢物变化趋势相似,其中腐胺主要定位于籽粒的糊粉层,而亚精胺在内胚乳特异累积。转录组共检出3.3万个左右基因,其中检出GABA通路18个酶中的14个酶对应的基因有较高的表达水平,除外其他基因均不是差异表达基因,同一基因在两份水稻材料中的表达水平和变化趋势相似,、、和在相应同源基因中表达水平较高。黄华占籽粒中-精氨酸和腐胺的代谢在蜡熟期已基本结束,美香占2号在籽粒整个发育期具有持续较强的多胺降解水平。美香占2号籽粒具有合成2AP的物质基础,多胺降解途径和谷氨酸-脯氨酸转化通路同时有助于2AP的积累。水稻籽粒GABA代谢以降解为主,和共同调控GABA的降解。GABA相关代谢物主要集中在糊粉层,黄华占籽粒中代谢物分布和基因表达特征与美香占2号相似,美香占2号籽粒成熟过程中具有持续较高的线粒体活性。
γ-氨基丁酸;2-乙酰-1-吡咯啉;籽粒发育;香稻;代谢组学
水稻是我国重要的粮食作物,随着农业供给侧结构性改革的推进,在确保口粮安全的前提下,“重点发展优质稻米产业”已成为水稻产业长期发展的必然选择,培育功能性水稻、优质香稻等特色水稻将成为重要的育种方向。
γ-氨基丁酸(GABA)是一种重要的非蛋白氨基酸,参与植物体的逆境胁迫、信号传递和碳氮平衡等多种生理生化反应[1-3]。哺乳动物GABA主要分布在中枢神经细胞,作为重要的抑制性神经递质,具有抑制神经传递、调节血压、提高免疫力和预防癌症等功效[4-6]。稻米GABA开发重要材料之一,巨胚水稻、胚芽米已作为一种GABA富集功能食品被推入市场[7-8]。2-乙酰-1-吡咯啉(2AP)是香稻的特征香味物质[9-10],香味已成为评价优质米的一项重要指标,而我国香米在国际高档香米市场缺乏品牌竞争力。GABA和2AP主要在籽粒的糊粉层和胚中富集,而在人们通常食用的精米(内胚乳)中两种物质的含量较糙米分别下降40%[11-12]和70%左右[13],研究开发内胚乳GABA、2AP高含量水稻品种,对GABA功能水稻和香稻产业发展具有促进作用。
深入研究GABA和2AP生物合成途径,对水稻育种过程中实现两者的定向改良具有重要意义。通过查阅两个代谢通路相关文献[2,14-17],以及对精氨酸、脯氨酸和谷氨酸的KEGG通路分析发现,谷氨酸和4-氨基丁醛是GABA和2AP生物合成的共同前体物质,进一步绘制两个代谢通路关联图(图1):GABA和2AP代谢通路共涉及15种代谢物和18种酶,其中,GABA代谢通路主要包括GABA支路和多胺降解途径,前者由谷氨酸脱羧酶直接催化谷氨酸生成GABA,后者由多胺物质经多个酶促反应生成4-氨基丁醛,在甜菜碱醛脱氢酶(BADH2)催化下合成GABA[18],而香稻通常由于BADH2功能失活,导致4-氨基丁醛能够环化生成1-吡咯啉,再与乙酰基团结合自发生成2AP[19-20],而非香稻不产生2AP;也有研究报道谷氨酸-脯氨酸相互转化过程中的中间物1-吡咯啉-5-羧酸(P5C)能够生成1-吡咯啉[21-22]。
GABA和2AP在水稻籽粒发育过程中动态代谢和积累的机制尚不明确,由于代谢通路涉及的代谢物和同源基因较多,难以通过基因克隆等方式对通路进行系统研究,多层组学为复杂通路的解析提供了行之有效的研究方法。本研究以优质稻黄华占和广东省丝苗米代表性品种香稻美香占2号为研究对象,收集四个发育时期籽粒,利用代谢组和转录组联合分析方法,分别评价非香稻和香稻籽粒发育过程中GABA和2AP代谢通路相关化合物的动态变化,揭示关键化合物的空间分布和代谢特征;重点分析香稻中GABA和2AP在籽粒发育中的积累机制;进一步提出利用基因编辑等生物技术提高籽粒中GABA和2AP含量的策略,为GABA功能性香稻育种提供理论依据。
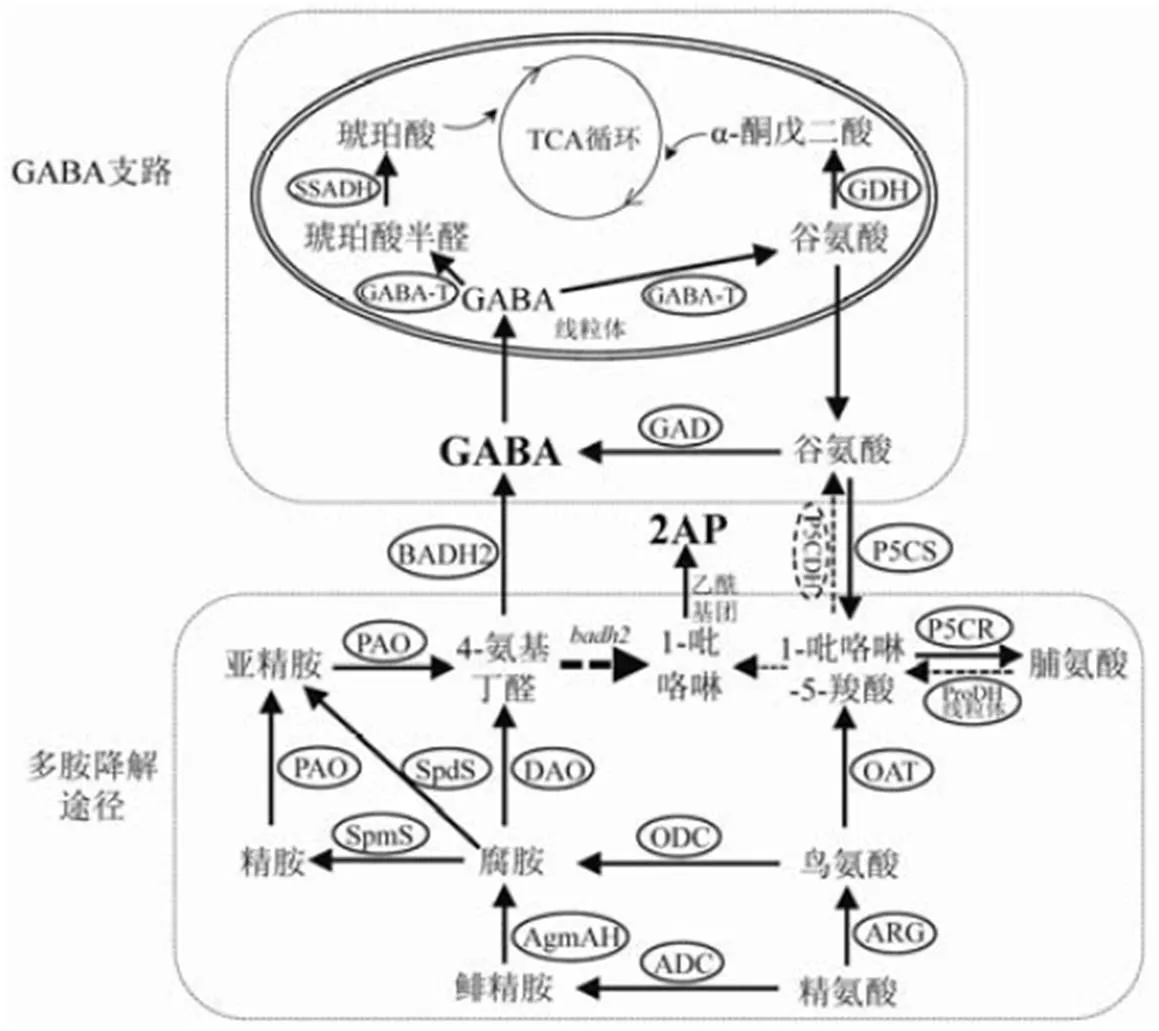
ADC—精氨酸脱羧酶;AgmAH—鲱精胺酶;ARG—精氨酸酶;BADH2—甜菜碱醛脱氢酶2;DAO—二胺氧化酶;GABA-T—氨基丁酸转氨酶;GAD—谷氨酸脱羧酶;GDH—谷氨酸脱氢酶;OAT—鸟氨酸转氨酶;ODC—鸟氨酸脱羧酶;P5CDH—吡咯啉-5-羧酸脱氢酶;P5CR—吡咯啉-5-羧酸还原酶;P5CS—吡咯啉-5-羧酸合成酶;PAO—多胺氧化酶;ProDH—脯氨酸脱氢酶;SpdS—亚精胺合成酶;SpmS—精胺合成酶;SSADH—琥珀酸半醛脱氢酶。
1 材料与方法
1.1 水稻材料
以本研究室培育出的黄华占和美香占2号为材料(黄华占是我国南方稻区推广面积最大的优质常规籼稻品种,美香占2号于2018−2020年连续三届获得全国优质籼稻品种食味品质鉴评金奖),于2018年晚季在广东省农业科学院水稻研究所育种基地(广州)种植,采用常规种植和管理方式。分别在花后8 d(乳熟期)、15 d(蜡熟期)、30 d(完熟期,糙米)[23]收集9~12株水稻籽粒,在液氮条件下脱壳,同时对开花后40 d的籽粒用碾米机获得精米,所有样品于−80 ℃冰箱中保存。
1.2 方法
收集的各组水稻籽粒样品委托武汉迈特维尔生物科技有限公司进行代谢组和转录组后续处理,每组样品3个生物学重复。
1.2.1 代谢组分析方法
水稻籽粒样品真空冷冻干燥,经Retsch MM 400研磨仪研磨呈粉末状,称取100 mg粉末样品,溶于1 mL提取液中(70%甲醇-水溶液);溶解后的样品4 ℃下过夜,期间涡旋3次,提高提取率;10 000下离心10 min,吸取上清液,用0.22 μm微孔滤膜过滤样品,保存于进样瓶中,用超高效液相色谱(UPLC,仪器型号Shim-pack UFLC SHIMADZU CBM30A)和串联质谱(MS/MS,仪器型号Applied Biosystems 6500 QTRAP)进行分析。质控样本(QC)由样本提取物混合制备而成,在仪器分析过程中,每10个检测分析样本中插入一个质控样品,用于监测样本在相同的处理方法下的重复性。
液相条件:色谱柱选用Waters ACQUITY UPLC HSS T3 C18 1.8 μm,2.1 mm×100 mm;流动相水相为超纯水(加0.04%乙酸),有机相为乙腈(加0.04%乙酸),流动相A:乙腈∶甲醇=3∶1,加0.01%BHT;流动相B:甲基叔丁基醚加0.01%BHT,洗针液为甲醇;洗脱梯度:0 min为95∶5(水相/有机相,/),11 min为5∶95(/),12 min为5∶95(/),12.1 min为95∶5(/),15 min为95∶5(/);流速0.4 mL/min,进样量2 μL,柱温40 ℃。
质谱条件:电喷雾离子源(ESI)温度500 ℃,质谱电压5500 V,帘气(CUR)25 psi,碰撞诱导电离(CAD)参数设置为高。在三重四级杆(QQQ)中,每个离子对根据优化的去簇电压(DP)和碰撞能(CE)进行扫描检测。
1.2.2 转录组分析方法
用Trizol 法提取样本总RNA(40D样本不进行转录组分析),完成cDNA文库构建后,使用Illumina Hiseq4000 高通量测序平台对cDNA 文库进行测序,得到原始数据。
1.3 数据分析
1.3.1 代谢组数据分析
利用软件Analyst 1.6.3处理质谱数据,检测器中获得特征离子的信号强度(CPS),用MultiaQuant软件打开样本质谱文件,进行色谱峰的积分和校正。每个色谱峰的峰面积(Area)代表对应物质相对含量。根据不同样本中对应代谢物的保留时间和峰型信息,校正相应代谢物。
利用SIMCA-P 13.0软件包,进行无监督的主成分分析(PCA)、偏最小二乘法判别分析(PLS-DA)以及正交偏最小二乘法判别分析(OPLS-DA),差异代谢物筛选标准为变量权重值(VIP)>1且(corr)绝对值≥0.6。
1.3.2 转录组数据分析
利用FPKM(每百万Reads中来自比对到某一基因每千碱基长度的Reads数目)值表示表达丰度,差异表达基因筛选通过DEseq2软件包完成,将FDR≤0.05且两样品间log2的绝对值≥1的基因定义为差异表达基因,其中,表示两样品表达量的比值。
1.3.3 常规数据处理
常规数据利用Excel 2013和SPSS 24进行数据分析。
2 结果与分析
2.1 代谢组数据的统计分析
对代谢组数据进行无监督的PCA分析(图2),结果显示每组样品的三个生物学样品具有较好重复性,其中黄华占和美香占2号花后8 d籽粒沿主成分1明显分离,表明该时期代谢物组成较其他时期差异明显;两个品种花后15 d和花后30 d样品未明显分离;花后40 d籽粒的精米样品高度重叠且与其他三个时期样品分离明显,表明两个水稻品种精米具有相似的代谢物。

PC1:主成分1解释总变异的42.9%;PC2:主成分2解释总变异的21.9%。8D, 15D,30D和40D分别代表花后8 d(乳熟期)、15 d(蜡熟期)、30 d(完熟期,糙米)脱壳籽粒,花后40 d籽粒碾成的精米。
代谢组共定性出623种代谢物,相同时期籽粒鉴定出的代谢物数量相近(图3):花后15 d和花后30 d籽粒鉴定出的代谢物最多(600个左右);花后8 d籽粒的代谢物数量次之,美香占2号较黄华占多56个;花后40 d籽粒的精米样品检出代谢物数量最少。差异代谢物分析表明四个时期差异代谢物合计161个,占总代谢物的25.8%,差异代谢物类别排名前三位的是氨基酸类(32种)、脂类(27种)和有机酸类(21种),占总差异代谢物的49.7%。两个水稻品种在花后8 d籽粒差异代谢物最多为101个,而花后40 d籽粒的精米样品差异代谢物最少为49个。
2.2 GABA相关代谢物的动态变化特征
代谢组鉴定出GABA代谢通路中的9个代谢物,分别为γ-氨基丁酸、-谷氨酸、α-酮戊二酸、琥珀酸、-脯氨酸、-精氨酸、腐胺、精胺和亚精胺(图4),其中美香占2号花后15 d籽粒中GABA含量显著高于同时期黄华占,同时,该时期GABA支路中的琥珀酸、多胺降解途径中的脯氨酸和精胺含量均显著高于同时期的黄华占。

图3 黄华占(HHZ)和美香占2号(MXZ)四个时期籽粒代谢物数量分布
两个水稻品种的GABA相关代谢物变化趋势相似,随籽粒成熟9个代谢物含量均降低,表明籽粒发育过程中GABA代谢活动旺盛。从代谢物的空间分布来看,除亚精胺外的其他8个代谢物在花后30 d籽粒中含量均明显高于精米,说明GABA代谢过程主要集中在糊粉层和胚等组织,其中腐胺在两个品种的精米中均未检出,表明籽粒中的腐胺定位于糊粉层,而亚精胺特异分布在内胚乳。
2.3 GABA代谢通路相关基因的表达特性
转录组约检出3.3万个基因具有一定的表达水平,GABA通路相关18种酶对应基因的表达水平如表1所示,其中有14个酶对应的基因均有较高水平的表达,进一步表明籽粒在完全成熟之前具有活跃的GABA代谢进程。
从表达水平分析,同一基因在两份水稻材料中的表达水平和变化趋势相近,除为差异表达基因外,其他基因均不是差异表达基因,表明这些基因在籽粒发育中具有较强的保守性。同源基因之间仅个别基因高表达,如、、和在相应同源基因中表达水平较高,说明同源基因具有明显的组织表达特异性。
2.4 多胺降解途径代谢物的变化特性
两个水稻品种在多胺降解途径的速率表现出明显差异(图4):黄华占花后15 d籽粒的-精氨酸和腐胺被迅速降解至最低值,表明在花后15 d籽粒中两个化合物的代谢已基本结束,而亚精胺含量在各个时期均高于美香占2号,这与黄华占的、、和活性持续较高密切相关;美香占2号籽粒在花后15 d至30 d发育过程中精氨酸、精胺和腐胺含量均明显降低,表明美香占2号在籽粒形成期多胺代谢水平低于黄华占,但在成熟过程中具有持续较强的多胺降解水平。

*表示差异代谢物。
2.5 香稻籽粒中2AP代谢通路分析
美香占2号籽粒在发育成熟前具备多胺降解的物质基础,且能够持续实现多胺降解,有利于籽粒2AP的积累。同时,谷氨酸-脯氨酸相互转化通路中,在美香占2号花后15 d和成熟期籽粒中、和均具有较高表达水平,而基因几乎不表达(表1),这种表达特性有利于1-吡咯啉-5-羧酸的积累。
3 讨论
3.1 多组学联合分析在籽粒发育中的应用
多组学技术能够得到生物体的代谢物、蛋白组和基因表达等信息,在挖掘关键基因[24]、逆境生理代谢[25-26]和分析水稻品种间营养差异物质[27]等领域已得到广泛应用;同时,多组学联合分析方法能够针对特定代谢物获得相对完整的遗传信息,加速对感兴趣通路的整体认识。GABA代谢过程复杂,其GABA支路中和分别有5个和4个同源基因[28-30],对各个基因的定位研究较少;而多胺代谢物能够广泛地参与植物发育过程[14,31],但在水稻籽粒发育过程中的动态变化未见深入研究,主要受制于代谢通路复杂和同源基因表达的差异性。本研究运用代谢组和转录组分析技术,对籽粒的四个发育时期进行研究,能够在宏观上把握GABA相关代谢物和基因的分布和变化特性。

表1 黄华占和美香占2号籽粒三个发育时期GABA通路相关基因表达量
*表示差异表达基因,N/A表示该基因转录本未检出,加粗基因表示重点关注的基因。
* Represents differentially expressed gene; N/A represents the gene transcript was not detected; The bold sections represent the genes of interest.

*表示差异表达基因,* Represents differentially expressed gene
3.2 籽粒GABA含量变化分析
研究表明,GABA降解在线粒体进行[3,30],谷氨酸脱羧反应是GABA合成的主要通路[1,32],一定胁迫条件下多胺代谢通路能够进行GABA的生物合成[2,16]。本研究发现籽粒发育过程中GABA代谢活跃,其中和具有较高表达水平,且GABA含量在籽粒发育中呈下降趋势,提示GABA降解水平高于其合成水平。GABA降解产物琥珀酸和α-酮戊二酸进入三羧酸循环,而美香占2号花后15 d—30 d籽粒中两个代谢物含量降幅明显高于黄华占,进一步发现美香占2号籽粒中6个线粒体标志酶的表达水平均高于黄华占(图5),推断美香占2号籽粒糊粉层线粒体具有持续较高的生理活性。
3.3 籽粒中2AP积累的机制探讨
2AP是一种极易挥发、脂溶性的化合物[33],Yoshihashi 等[34]研究推断精米中2AP与淀粉颗粒复合体紧密结合;Hinge等[17]对Basmati-370和Ambemohar-157两个香稻品种四个发育时期的籽粒进行2AP含量检测,推测籽粒2AP由叶片转运而来,但籽粒能否自身合成2AP尚不确定。另外,Christophersen和Struve[35]研究证实4-氨基丁醛在碱性条件下能够自身环化为1-吡咯啉,但尚未发现1-吡咯啉-5羧酸转变为1-吡咯啉的直接证据[36]。本研究发现2AP代谢所需的前体物质(如脯氨酸、谷氨酸、精氨酸和腐胺)在各个发育时期的籽粒中含量较高,同时相关基因、和等具有较高表达水平,证实籽粒存在合成2AP的物质基础。
3.4 籽粒GABA和2AP积累水平提高的策略分析
周露等[37]通过RNA干扰对进行基因敲低发现籽粒中GABA含量提高;Akama等[38]在水稻中过表达截短C末端的,使叶片GABA含量提高43倍,但导致植株不育;Akama等[39]对基因的钙调域进行基因编辑,籽粒GABA含量提高7倍;利用基因编辑敲除创制香稻应用较多[40-42],但如何精确调控胚乳GABA和2AP积累需深入研究。
本研究发现籽粒GABA以降解为主,利用基因编辑技术对籽粒中特异表达的进行编辑能够提高籽粒GABA含量;同时,对和的C末端进行靶向编辑,提高相应GAD活性,有利于提高籽粒GABA的生物合成;在非香稻中过表达将特异提高胚乳GABA含量。另外,对香稻进行基因编辑,有利于揭示脯氨酸代谢影响2AP积累的分子机制;在香稻中过表达基能够提高糊粉层中2AP含量;籽粒中特异提高表达水平,将有利于胚乳2AP的积累。
[1] Narayan V S, Nair P M. Metabolism, enzymology and possible roles of 4-aminobutyrate in higher plants[J]., 1990, 29: 367-375.
[2] Fait A, Fromm H, Walther D. Highway or byway: The metabolic role of GABA shunt in plants[J]., 2007, 13: 1380-1385.
[3] Shelp B J, Bown A W, Zarei A. 4-aminobutyrate (GABA): A metabolite and signal with practical significance[J]., 2017, 95: 1015-1032.
[4] Zhang S J, Jckson M B. GABA-activated chloride channels in secretory nerve endings[J]., 1993, 259: 531-534.
[5] Inoue K, Shirai T, Ochiai H, Kasao M, Hayakawa K, Kimura M. Blood-pressure-lowering effect of a novel fermented milk containing gamma-aminobutyric acid (GABA) in mild hypertensives[J]., 2003, 57: 490-495.
[6] Hayakawa K, Kimura M, Kasaha K, Matsumoto K, Sansawa h, Yamori Y. Effect of a gamma-aminobutyric acid-enriched dairy product on the blood pressure of spontaneously hypertensive and normotensive Wistar- Kyoto rats[J]., 2004, 92: 411-417.
[7] 张光恒, 曾大力, 郭龙彪, 刘慧娟, 胡江, 高振宇, 华志华, 钱前. 葡萄糖焦磷酸酶基因与巨胚基因聚合创建营养功能稻[J]. 中国水稻科学, 2007, 21(6): 567-572.
Zhang G H, Zeng D L, Guo L B, Liu H J, Hu J, Gao Z Y, Hua Z H, Qian Q. Nutrition-functional rice created by polymerizing ADP-glucorse pyrophosphorylase and giant embryo genes[J]., 2007, 21(6): 567-572. (in Chinese with English abstract)
[8] 马文领, 景军, 耿文叶. 胚芽大米的营养特性及营养支持作用[J]. 中国食物与营养, 2018, 24(1): 55-58.
Ma W L, Jing J, Geng W Y. Nutritional characteristics and nutritional support of germ rice[J]., 2018, 24(1): 55-58. (in Chinese with English abstract)
[9] Buttery R G, Ling L C, Juliano B O. 2-acetyl-1-pyrroline: An important aroma component of cooked rice[J]., 1982, 12: 958-959.
[10] Chen S H, Yang Y, Shi W W, Ji Q, He F, Zhang Z D, Cheng Z K, Liu X N, Xu M L., encoding betaine aldehyde dehydrogenase, inhibits the biosynthesis of 2-acetyl-1-pyrroline, a major component in rice fragrance[J]., 2008, 20: 1850-1861.
[11] 罗曦, 曾亚文, 杨树明, 杜娟, 普晓英, 吴殿星. 不同发芽时间下发芽稻谷和糙米不同部位γ-氨基丁酸含量差异[J]. 食品科学, 2009, 30(13): 124-128.
Luo X, Zeng Y W, Yang S M, Du J, Pu X Y, Wu D X. Changes in gamma-aminobutyric acid content in different parts of rice and brown rice during germination[J]., 2009, 30(13): 124–128. (in Chinese with English abstract)
[12] 姚森, 杨特武, 赵莉君, 熊善柏. 发芽糙米中γ-氨基丁酸含量的品种基因型差异分析[J]. 中国农业科学, 2008, 41(12): 3974-3982.
Yao S, Yang T W, Zhao L J, Xiong S B. The variation of γ-aminobutyric acid content in germinated brown rice among different cultivars[J]., 2008, 41(12): 3974-3982. (in Chinese with English abstract)
[13] Wei X, Handoko D D, Pather L, Methven L, Elmore J S. Evaluation of 2-acetyl-1-pyrroline in foods, with an emphasis on rice flavour[J]., 2017, 232: 531-544.
[14] Kakkar R K, Sawhney V K. Polyamine research in plants: A changing perspective[J]., 2002, 116: 281-292.
[15] Shelp B J, Bozzo G G, Trobacher C P, Zarei A, Deyman K L, Brikis C J. Hypothesis/review: contribution of putrescine to γ-aminobutyrate (GABA) production in response to abiotic stress[J]., 2012, 193: 130-135.
[16] Shelp B J, Bozzo G G, Trobacher C P, Chiu G, Bajwa V S. Strategies and tools for studying the metabolism and function of γ-aminobutyrate in plants: I. Pathway structure[J]., 2012, 90(9): 651-668.
[17] Hinge V R, Patil H B, Nadaf A B. Aroma volatile analyses and 2AP characterization at various developmental stages in Basmati and non-Basmati scented rice cultivars[J]., 2016, 9: 38.
[18] 苏国兴,刘友良. 高等植物体内的多胺分解代谢及其主要产物的生理作用[J]. 植物学通报, 2005, 22(4): 408-418.
Su G X, Liu Y L. Function of polyamine catabolism and its main catabolic products in higher plants[J]., 2005, 22(4): 408-418. (in Chinese with English abstract)
[19] Bradbury L M T, Fitzgerald T L, Henry R J, Jin Q, Waters D L E. The gene for fragrance in rice[J]., 2005, 3: 363-370.
[20] Bradbury L M T, Gillies S A, Brushett D J, Waters D L E, Henry R J. Inactivation of an aminoaldehyde dehydrogenase is responsible for fragrance in rice[J]., 2008, 68: 439-449.
[21] Huang T C, Huang Y W, Hung H J, Ho C T, Wu M L. Delta (1)-Pyrroline-5-carboxylic acid formed by proline dehydrogenase from thessp.expressed inas a precursor for 2-acetyl-1-pyrroline[J]., 2007, 55(13): 5097-5102.
[22] Huang T C, Teng C S, Chang J L, Chuang H S, Ho C T , Wu M L. Biosynthetic mechanism of 2-acetyl-1-pyrroline and its relationship with delta (1)-pyrroline-5-carboxylic acid and methylglyoxal in aromatic rice (L.) callus[J]., 2008, 56(16): 7399-7404.
[23] 王忠. 水稻的开花与结实: 水稻生殖器官发育图谱[M]. 北京: 科学出版社, 2015: 124-143.
Wang Z. Rice Flowering and Fruiting: Atlas of Rice Reproductive Organ Development[M]. Beijing: Science Press, 2015: 124-143. (in Chinese)
[24] Urbanczyk-Wochniak E, Luedemann A, Kopka J, Selbig J, Roessner-Tunali U, Willmitzer L, Fernie A R. Parallel analysis of transcript and metabolic profiles: A new approach in systems biology[J]., 2003, 4(10): 989-993.
[25] Sana T R, Fischer S, Wohlgemuth G, Katrekar A, Jung K, Ronald P C, Fiehn O. Metabolomic and transcriptomic analysis of the rice response to the bacterial blight pathogenpv.[J]., 2010, 6: 451-465.
[26] Hoefgen R, Nikiforova V J. Metabolomics integrated with transcriptomics: Assessing systems response to sulfur-deficiency stress[J]., 2008, 132(2): 190-198.
[27] 沈枫, 蒋洪波, 刘博, 张秀茹, 刘军, 解文孝, 姚继攀, 马亮. 优质食味粳稻辽粳433 和越光糙米代谢产物差异分析[J]. 中国水稻科学, 2020, 34(4): 359-367.
Shen F, Jiang H B, Liu B, Zhang X R, Liu J, Xie W X, Yao J P, Ma L. Difference of metabolites in brown rice between Liaojing 433 and Koshihikari with good eating quality[J]., 2020, 34(4): 359-367. (in Chinese with English abstract)
[28] Shelp B J, Bown A W, McLean M D. Metabolism and functions of gamma-aminobutyric acid[J]., 1999, 4(11): 446-452.
[29] Akama K, Akihiro T, Kitagawa M, Takaiwa F. Rice() contains a novel isoform of glutamate decarboxylase that lacks an authentic calmodulin-binding domain at the C-terminus[J]., 2001, 1522: 143-150.
[30] Bouché N, Fromm H. GABA in plants: Just a metabolite?[J], 2004, 9(3): 110-115.
[31] Pal B H, Ravishankar G A. Role of polyamines in the ontogeny of plants and their biotechnological applications[J]., 2002, 69: 1-34.
[32] Shelp B J, Bozzo G G, Zarei A, Simpson J P, Trobacher C P, Allan W L. Strategies and tools for studying the metabolism and function of γ-aminobutyrate in plants: Ⅱ. Integrated analysis[J]., 2012, 90(9): 781-793.
[33] Buttery R G, Ling L C, Juliano B O, Turnbaugh J G. Cooked rice aroma and 2-acetyl-1-pyrroline[J]., 1983, 31(4): 823-826.
[34] Yoshihashi T, Huong N T T, Surojanametakul V, Tungtrakul P, Varanyanond W. Effect of storage conditions on 2-acetyl-1-pyrroline content in aromatic rice variety, Khao Dawk Mali 105[J]., 2005, 70(1): S34-S37.
[35] Christophersen C, Struve C. Structural equilibrium and ring-chain tautomerism of aqueous solutions of 4-aminobutyraldehyde[J]., 2003, 60: 1907-1914.
[36] Keyghobad K, Kad T D, Zanan R L, Nadaf A B. 2-Acetyl-1-pyrroline augmentation in scented indica rice (L.) varieties through 1-pyrroline- 5-carboxylate synthetase () gene transformation[J]., 2015, 177: 1466-1479.
[37] 周露, 沈贝贝, 白苏阳, 刘喜, 江玲, 翟虎渠, 万建民. 以RNA干扰γ-氨基丁酸转氨酶1基因()表达提高稻米γ-氨基丁酸(GABA)含量[J]. 作物学报, 2015, 41(9): 1305-1312.
Zhou L, Shen B B, Bai S Y, Liu X, Jiang L, Zhai H Q, Wan J M. RNA interference ofgene expression induced GABA accumulation in rice grain[J]., 2015, 41(9): 1305-1312. (in Chinese with English abstract)
[38] Akama K, Takaiwa F. C-terminal extension of rice glutamate decarboxylase (OsGAD2) functions as an autoinhibitory domain and overexpression of a truncated mutant results in the accumulation of extremely high levels of GABA in plant cells[J]., 2007, 58: 2699-2707.
[39] Akama K, Akter N, Endo H, Kanesaki M, Endo M, Toki S. Antargeted deletion of the calmodulin-binding domain from rice glutamate decarboxylase 3 () increases γ-aminobutyric acid content in grains[J]., 2020, 13: 20.
[40] Shan Q W, Zhang Y, Chen K L, Zhang K, Gao C X. Creation of fragrant rice by targeted knockout of thegene using TALEN technology[J]., 2015, 13: 791-800.
[41] 邵高能, 谢黎虹, 焦桂爱, 魏祥进, 圣忠华, 唐绍清, 胡培松. 利用CRISPR/CAS9 技术编辑水稻香味基因[J]. 中国水稻科学, 2017, 31(2): 216-222.
Shao G N, Xie L H, Jiao G A, Wei X J, Sheng Z H, Tang S Q, Hu P S. CRISPR/CAS9-mediated editing of the fragrant genein rice[J]., 2017, 31(2): 216-222. (in Chinese with English abstract)
[42] 祁永斌, 张礼霞, 王林友, 宋建, 王建军. 利用CRISPR/Cas9 技术编辑水稻香味基因[J]. 中国农业科学, 2020, 53(8): 1501-1509.
Qi Y B, Zhang L X, Wang L Y, Song J, Wang J J. CRISPR/CAS9 targeted editing for the fragrant genein rice[J]., 2020, 53(8): 1501-1509. (in Chinese with English abstract)
Metabolism of γ-aminobutyrate and 2-acetyl-1-pyrroline Analyses at Various Grain Developmental Stages in Rice (L.)
PAN Yangyang, CHEN Yibo, WANG Chongrong, LI Hong, HUANG Daoqiang, ZHOU Degui, WANG Zhidong, ZHAO Lei, GONG Rong, ZHOU Shaochuan*
(Rice Research Institute, Guangdong Academy of Agricultural Sciences / Guangdong Provincial Key Laboratory of New Technology in Rice Breeding, Guangzhou 510640, China;*Corresponding author, E-mail: xxs123@163.com)
It is important to reveal the dynamic changes of metabolites and genes involved in γ-aminobutyric acid (GABA) and 2-acetyl-1-pyrroline (2AP) metabolic pathways at various grain developmental stages in scented and non-scented rice cultivars by metabolomes and transcriptomes. The purpose of this study is to lay a theoretical basis for high GABA and 2AP rice breeding.The metabolomics and transcriptomics of grains including milky grains (8D, 8 days after flowering), dough grains (15D), mature grains (30D) and milled rice (40D) of scented rice cultivar Meixiangzhan 2(MXZ) along with non-scented rice cultivar Huanghuazhan (HHZ) were performed by LC-MS/MS and RNA-seq, respectively. Finally, the metabolites and transcript profiles of GABA and 2AP metabolic pathways were analyzed.The LC-MS/MS-based metabolic PCA analysis illustrated that the 8D and 40D grains of both varieties were dispersedly distributed, while 15D and 30D grains were concentrated in a relatively narrow area. In a total of 623 metabolites were detected in all samples, among which 161 were different metabolites. The contents of nine metabolites, detected in the GABA and 2AP pathways, followed a similar changing trend in all samples. We found that putrescine was located in embryo and aleurone layer, while spermidine was specifically accumulated in the endosperm. About 33 000 genes were identified through thegene expression analysis, among which 14 genes involved in GABA pathway showed high transcriptional levels. These related genes had similar abundance patterns between two varieties, while thewas the only differentially expressed gene.andshowed higher expression levels as compared with respective homologous genes. The-arginine and putrescine profiles minimized in HHZ 5D grains, while the polyamine degradation had strong activity in whole MXZ grain development. There were all metabolites required for the 2AP synthesis in the grains, and both polyamine degradation pathway and the glutamate-proline pathway contributed to the accumulation of 2AP in grains.The GABA metabolite was mainly degraded, andandwere responsible for GABA degradation. The metabolites involved in GABA pathway were mainly concentrated in the aleurone layer, and the metabolites and gene expression profiles had similar patterns in both rice varieties. A higher mitochondria activity was found in MXZ grains than HHZ.
γ-aminobutyric acid; 2-acetyl-1-pyrroline; grain development; fragrant rice; metabolomics
10.16819/j.1001-7216.2021.0805
2020-08-05;
2020-09-16。
广东省应用型科技研发专项重点项目(2015B020231001);广东省农业科学院“十三五”学科团队建设项目(201621TD)。

