一份水稻OsWOX3B基因敲除突变体的鉴定
郑亚莉 余林闯 安肖肖 程心乐 任丽君 苏子龙 郑小雅 兰涛, 2, 3, *
一份水稻基因敲除突变体的鉴定
郑亚莉1余林闯1安肖肖1程心乐1任丽君1苏子龙1郑小雅1兰涛1, 2, 3, *
(1福建农林大学 作物遗传育种与综合利用省部共建教育部重点实验室, 福州 350002;2福建农林大学 作物应用遗传学福建省高校重点实验室, 福州 350002;3福建农林大学 福建省作物设计育种重点实验室, 福州 350002;*通信联系人, E-mail: tlan@fafu.edu.cn)
水稻基因调控叶片形态和表皮毛发育,根据表型被命名为、、和等。深入了解基因对水稻发育调控的功能具有重要意义。利用CRISPR/Cas9基因编辑技术对籼稻品种R401的进行基因敲除。对所获材料进行突变位点分析和表型分析,同时进行相关基因的表达分析。所获材料的基因的编码区第341位碱基由T变为C,第395-397位碱基缺失,其叶片和颖壳光滑,与突变体、、的表型相同,可确认其为突变体。除了与已报道的的功能缺失突变表型相关外,突变体也有新表型出现。与野生型R401相比,突变体表现为生育期延长、分蘖数减少、叶片变宽、稻穗变长和每穗粒数增多。同时,突变体的剑叶维管束增多,小维管束间距增大,2个水稻侧生器官发育相关基因在突变体中的表达变化也与其表型变化一致。鉴定了一个新的水稻基因突变体,其影响水稻侧生器官发育。
水稻;侧生器官;维管束;生育期
水稻(L.)作为世界上最重要的粮食作物之一,为全球半数以上人口提供粮食来源。水稻产量是评价水稻品种优良的主要指标,为了进一步提高品种的产量潜力,育种家提出了理想株型的概念,其重要特征是分蘖减少,没有无效分蘖,穗粒数多,茎秆粗壮和根系发达等[1]。而叶型、分蘖、穗分支等侧生器官则是塑造水稻理想株型的重要性状。因此,对控制叶型、分蘖、穗分支等侧生器官发育的基因及其调控机理研究可为超高产育种提供新的材料基础和理论基础。
WUSCHEL相关的同源异型盒(WUSCHEL- related homeobox,WOX)家族是植物特有的一类转录因子家族,拟南芥中有15个成员,水稻中有13个成员[2]。在植物茎和根顶端分生区建成、侧生器官发育、花器官形成和胚发育等方面发挥作用,尤其是在细胞增殖和分化较为旺盛区域发挥重要调控作用[3]。目前,已经报道了多个水稻基因的功能。是水稻不定根生长发育的关键调节因子,功能缺失导致主根变小、冠根数目减少甚至没有,突变体未成熟就已经死亡。的过量表达使冠根提早产生、数目增加,同时在高位茎节甚至花序基部产生冠根[4-6]。()基因编码一个新的类WUS 同源异型蛋白,参与水稻茎尖分生组织和根顶端分生组织干细胞的分化和维持[7-8]。()是控制水稻分蘖平衡生长所必需,突变体表现为主茎高度正常且穗较大、分蘖矮小且穗较小,分蘖节间缩短,节间细胞数目减少且细胞不伸长,且的活性和GA信号转导有直接或间接的关系[9]。()对水稻腋芽的形成是必需的,其功能缺失突变体的分蘖芽在发育过程中遭受破坏,不能形成分蘖,且的表达受细胞分裂素诱导[10]。可能通过调控细胞分裂素的合成影响水稻叶片维管束的分化和茎尖分生组织的维持,从而影响水稻叶片的早期发育[11]。和是横向同源物,编码相同的OsWOX3A转录因子,是赤霉素合成的负反馈调节因子,对水稻叶片维管束形成、小穗内外稃形态建成、分蘖和侧根发育等多方面起重要作用[12-13]。OsWOX3A是的转录抑制因子,干扰后叶片卷曲纠结,缺少正常的叶舌、叶耳,可能参与水稻叶片的细胞生长和分化[14]。
水稻基因的功能已有报道,根据表型其被命名为[15-16]、[17]、[18]和[19]等。基因的内含子插入一个大片段后产生突变体,其叶片的横向发育不正常,主要有两种表型,一种是窄叶,一种是略宽的分叉叶。前者是由于叶片的一半部分消失甚至全部消失,后者是由于叶片有两个中脉,类似于两片叶片发育时合并在一起[15]。此外,突变体还表现为多分蘖和半矮秆表型,其雌、雄配子体发育不正常,导致不育[15-16]。突变体、和都表现出叶片和种子颖壳上的表皮毛缺失[17-19]。另有报道,控制表皮毛起始,调控表皮毛延伸,OsWOX3B和HL6存在物理互作,且影响的转录,从而调控水稻表皮毛发育[20]。为了深入研究的功能,本研究利用基因编辑技术获得突变体,所获突变体的表型与以前报道的相关,但也有未报道的新表型。本研究丰富了水稻基因的功能,为进一步研究其调控水稻生长发育奠定基础。
1 材料与方法
1.1 供试材料
籼稻品种R401及以R401为背景的基因敲除株系作为试验材料。
1.2 水稻OsWOX3B基因敲除载体构建、转化和靶标位点修饰分析
采用CRISPR/Cas9基因编辑系统对进行基因敲除。首先从水稻数据库网站(http://rice. plant biology.msu.edu)下载基因的CDS序列,根据基因敲除靶点序列设计原则,在其第1外显子中间进行2个gRNA靶点序列的设计与合成。将溶解稀释至10 µmol/L的gRNA靶点序列复性形成oligo二聚体后连接至Cas9/gRNA载体(北京唯尚立德公司,VK005-01),转化至大肠杆菌感受态细胞DH5α中。挑取阳性单克隆,利用特定SQ 引物测序验证,同时用Ⅰ和Ⅰ双酶切验证敲除载体构建是否成功。以籼稻品种R401为受体材料,利用农杆菌介导法进行双靶标编辑载体的转化试验,该工作由武汉伯远生物公司完成。
所获T0代转基因幼苗在光照培养箱炼苗7 d后移栽至塑料盒的泥土中。待植株长势正常时取幼嫩叶片用SDS法抽提基因组DNA,以潮霉素引物Hyg566: 5′-GTGATTTCATATGCGCGATTGCTG-3′和5′-ACGAGTGCTGGGCGTCGGTTTCC-3′进行PCR扩增检测。在两靶点位置前后设计一对特异性引物5′-GCCACCGACGACACAAGAAAAC-3′和5′-GCCACGCGACATGATCGATTA-3′进行PCR扩增和测序,根据测序结果分析靶点修饰类型。
1.3 田间种植与表型鉴定
在福建农林大学水稻试验田里种植纯合的敲除突变体的T1代植株,以野生型R401为对照。在抽穗7 d左右剑叶平展后,选择小区中间10株水稻,测量剑叶、倒2叶和倒3叶的叶长和叶宽,并观测剑叶大维管束、小维管束以及大维管束间小维管束的数目。在成熟期,选择小区中间10株水稻,调查分蘖数、株高、有效穗数、穗长、一次枝梗数、二次枝梗数、每穗粒数、结实率和千粒重等性状。

表1 水稻OsWOX3B基因敲除T0代株系分子鉴定结果
1.4 扫描电镜分析
将样品放入现配的2.5%戊二醛溶液中,4 ℃下固定过夜。用0.1 mol/L的磷酸缓冲液(pH=7.2)漂洗样品3次,每次15 min;用1%的锇酸溶液(溶于0.1 mol/L的磷酸缓冲液)固定1.5 h;倒掉固定液,用0.1 mol/L的磷酸缓冲液(pH=7.2)漂洗样品3次,每次15 min;用30%、50%、70%、80%、90%和95%的乙醇对样品进行脱水置换,每种浓度处理15 min,再用100%的乙醇处理两次,每次20 min;用乙醇/醋酸异戊酯混合液(=1/l)处理样品30 min,再用纯醋酸异戊酯处理样品1.5 h;将样品浸泡在50%﹑75%﹑90%叔丁醇溶液中各10 min。将样品浸泡在100%叔丁醇中3次,每次10 min。将处理好的样品放在金属烧杯中,利用VFD-21S t-BuOH Freeze Dryer冷冻干燥仪干燥样品。在Hitachi公司TM Plus-3030扫描电镜上进行样品的显微观察。
1.5 qRT-PCR分析
野生型R401和突变体各40株种植于育秧盘中,常规田间管理。2周后各供试材料选取长势相近的6株,对叶片进行RNA提取和逆转录,3次生物学重复。利用Primer designing tool设计qRT-PCR引物,序列分别为:(5′-CAGCTCAC TACCACGTCCTT-3′,5′-CACCGTGCATAAGTGT AGCAA-3′)和:(5′-GAGCCTAATGAACCC GAACAGG-3′,5′-CTCTGCCGC TTCTCTGAAGT -3′)。以水稻基因为内参进行荧光定量PCR扩增,所得数据分析基因的相对表达量。
2 结果与分析
2.1 水稻OsWOX3B基因敲除突变体的获得
运用CRISPR/Cas9基因编辑技术对进行双靶标敲除载体构建。选择第一外显子的两段序列作为靶点序列,分别为5′-AGATGTACAGGGGAGGGCT-3′和5′-CGACC GCCAGAAGCTCCGCC-3′,以北京唯尚立德公司的VK005-01载体为框架载体,经过复性、连接、转化、测序和酶切等步骤,成功构建了基因的双靶标编辑载体。
将基因的双靶标编辑载体送至武汉伯远生物公司转化,受体材料为籼稻品种R401。获得18株转化苗,潮霉素检测结果均为阳性。对第1外显子测序分析,结果显示T0代中有12株发生编辑,其中2株为纯合体,命名为(表1)。测序结果表明,两株突变体的突变一致,其编码区第341个碱基由T变为C,导致一个丙氨酸变成缬氨酸;第395-397处发生了3个碱基的缺失,导致一个丝氨酸的缺失,后续氨基酸序列依然正常(图1)。这两个突变位点都在靶标序列之后,产生的原因有待进一步深入研究。以R401为对照,在体式显微镜和扫描电镜下观察分蘖期突变体近轴面叶中部表皮毛,同时在体式显微镜下观察突变体成熟种子。结果显示,突变体的叶边缘刺突缺失(图2-B),近轴面叶中部几乎无表皮毛分布(图2-D),观察的3个视野中宏毛数目为0(图2-E)。突变体成熟种子颖壳的细绒毛退化消失(图2-F)。叶片和颖壳表型与突变体//表型类似[18-20]。序列分析和表皮毛观察说明该转基因植株的确是的突变体。我们用该突变体来研究的突变对水稻的有关影响。

方框表示外显子,线段表示内含子,箭头表示突变位点和结构域。

A、B和E表示野生型R401和纯合突变株分蘖期叶片及成熟种子体式显微镜观察结果;C、D表示野生型R401和纯合突变株分蘖期叶片扫描电镜观察结果,箭头所指为宏毛。F−R401和oswox3b近轴面叶中部宏毛数目统计结果。柱形图上的数据点为平均值±标准差(n=3)。*表示突变体在P<0.05水平差异显著。
2.2 水稻OsWOX3B基因通过调控维管束发育而影响叶宽
在田间栽培条件下,突变体的叶片比野生型R401的叶片宽且短(图3-A~C)。抽穗期测量野生型和突变体的剑叶、倒2叶和倒3叶的叶宽和叶长。结果显示,突变体的剑叶、倒2叶和倒3叶的叶宽分别为2.4 cm、2.2 cm和1.9 cm,而野生型R401的相应叶宽分别为1.6 cm、1.3 cm和1.1 cm,突变体皆显著宽于野生型(图3-D)。突变体的剑叶、倒2叶和倒3叶的叶长分别为31.9 cm、44.7 cm和50.01 cm,而野生型R401的相应叶长分别为50.4 cm、57.6 cm和52.42 cm,突变体的剑叶和倒2叶显著短于野生型,倒3叶的叶长差异不显著(图3-E)。
抽穗期对野生型R401与突变体叶片进行扫描电镜观察(图4-A~B)。结果显示,突变体的剑叶、倒2叶和倒3叶的大维管束数目为12.7、11.0和9.4,而野生型R401的相应叶片的大维管束数目为9.6、7.9和6.7,突变体皆显著多于野生型(图4-C)。突变体的剑叶中相邻两个大维管束之间小维管束的数目为6.3,而野生型R401为5.6,突变体剑叶中小维管束总数为73.8,而野生型R401为54.2,两者差异均显著(图4-D~E);与野生型R401相比,突变体的剑叶中相邻两个小维管束之间的距离较大,差异显著(图4-A~B、F)。
由上可知,突变体叶片变宽是由于叶片维管束数目增多引起的。为进一步验证的叶片变宽是由维管束发育引起的,我们用qRT- PCR做了相关基因的表达分析。在维管束发育和叶片形成中发挥重要作用,可作为叶片维管束发育的分子标记物[21];对植物侧生组织的形成和分生组织的功能行使有着重要作用[22]。结果显示,在突变体中,这些基因的表达量约为野生型R401的两倍左右,差异显著(图5)。

A、B−抽穗期野生型(A)与突变体(B)叶片大维管束之间小维管束扫描电镜观察结果,白色三角形代表小维管束;C−抽穗期大维管束数目统计分析;D−抽穗期剑叶大维管束之间小维管束数目;E−抽穗期剑叶小维管束总数;F−抽穗期剑叶小维管束间的距离。柱形图上的数据点为平均值±标准差(n=10);*表示突变体在P<0.05水平差异显著。

柱形图上的数据点为平均值±标准差(n=3),*表示突变体在P<0.05水平差异显著。
2.3 水稻OsWOX3B基因影响了生育期、分蘖数和穗型
与野生型R401相比,突变体表现出生长缓慢和抽穗延迟的特点(图6)。在芽期(催芽5 d后),突变体的芽长与根长明显短于野生型R401(图6-A、C);在幼苗期,野生型R401处于3叶1心期时,而突变体为2叶1心期,且株高低于野生型R401(图6-B~C);正常田间管理条件下,野生型R401在播种后56 d时进入抽穗期,而突变体在播种后71 d时进入抽穗期,突变体开始抽穗时,野生型R401已处于灌浆后期(图6-D)。
在抽穗期,与野生型R401相比,突变体的分蘖数显著减少(图7-A、C),突变体的总分蘖数和有效分蘖数分别为2.9和2.5,而野生型R401分别为7.9和6.6,突变体皆显著少于野生型(图7-C)。在成熟期对野生型R401和突变体的穗型和千粒重等性状进行调查和统计分析。结果表明,突变体的穗长为27.5 cm,而野生型R401为21.2 cm,突变体显著长于野生型(图7-B、D);突变体的一次枝梗数为15,二次枝梗数为59,每穗粒数为238,而野生型R401分别为12、51和186,突变体皆显著多于野生型(图7-E~G)。
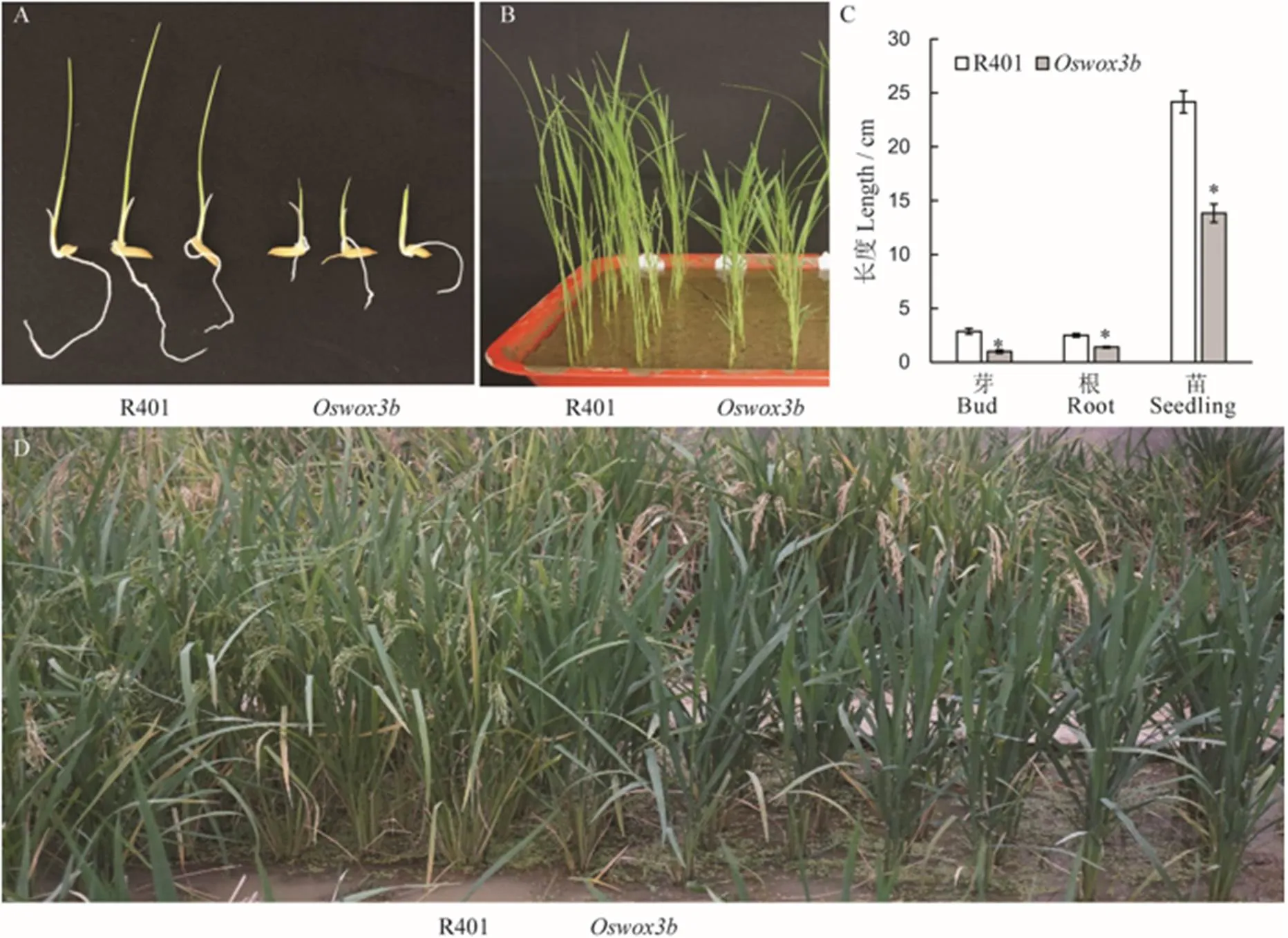
A和B分别表示芽期和幼苗期野生型与突变体;C−芽长、根长和幼苗株高;D−抽穗期野生型与突变体植株的田间表型。柱形图上的数据点为平均值±标准差(n=10),*表示突变体在P<0.05水平差异显著。
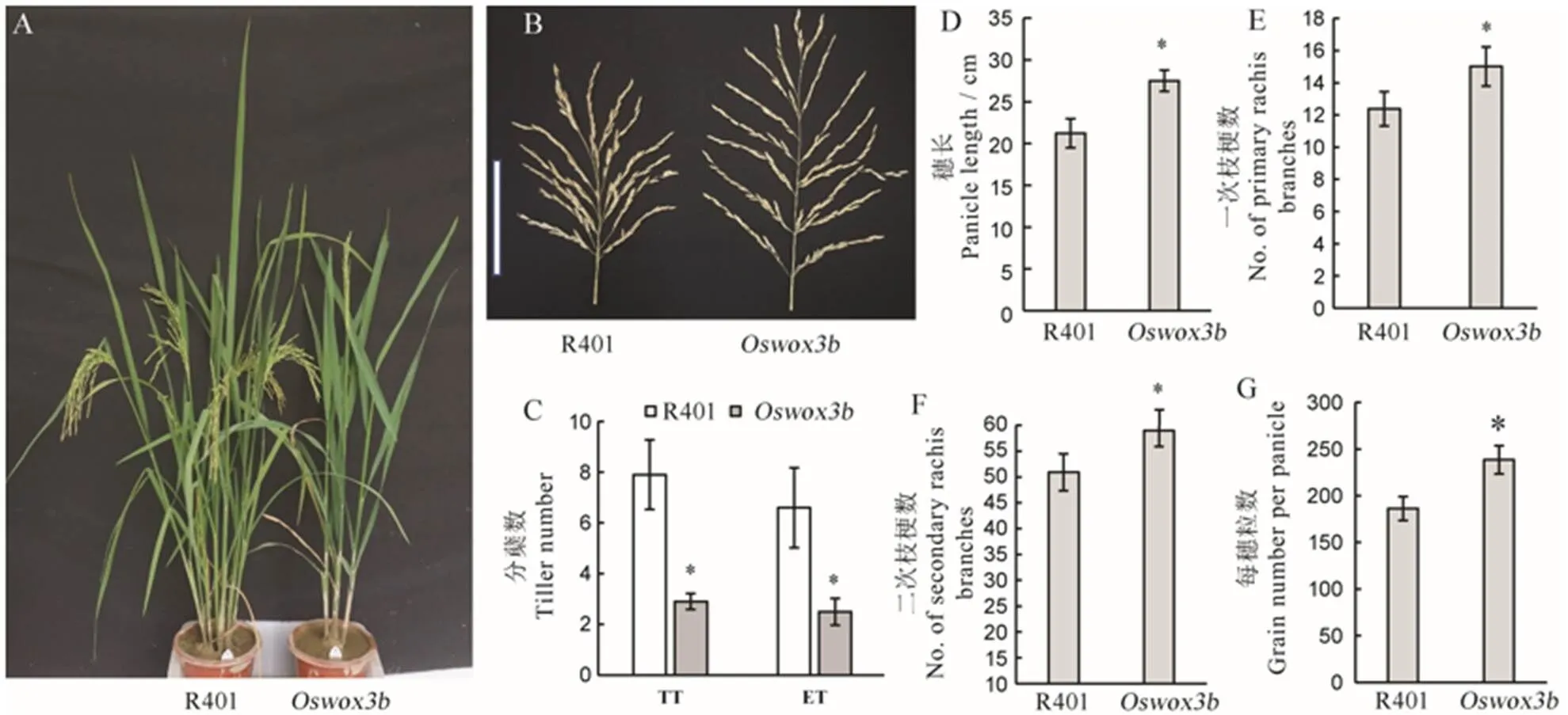
A−抽穗期野生型R401与突变体Oswox3b的植株表型;B−野生型R401与突变体Oswox3b穗形比较(比例尺为15 cm);C−抽穗期野生型R401与突变体Oswox3b分蘖数目和株高,B中TT为总分蘖数,ET为有效分蘖数;D~G分别为野生型与突变体穗长,一次枝梗数,二次枝梗数和每穗总粒数的统计分析。柱形图上的数据点为平均值±标准差(n=10),*表示突变体在P<0.05水平差异显著。
3 讨论
基因的功能已有报道,根据表型特征其被命名为[15-16]、[17]、[18]和[19]等。本研究利用CRISPR/Cas9基因编辑技术对籼稻品种R401的进行基因敲除,导致其编码区第341个碱基由T变为C,第395-397个碱基缺失(图1)。在抽穗期,突变体的剑叶和倒2叶的叶长显著短于野生型,而突变体的剑叶、倒2叶和倒3叶的叶宽皆显著宽于野生型(图3)。以前报道的基因的突变体在叶片方面有两种主要表型,一种是窄叶,一种是略宽的分叉叶(bifurcated leaf)。前者是由于叶片的一半部分消失甚至全部消失,后者是由于叶片有两个中脉,类似于两片叶片发育时合并在一起,总之都属于叶片的横向生长发育不正常[15]。经图位克隆发现突变是由于基因的内含子有一个大片段插入[16]。本研究突变体的叶宽只有变宽一种表型,且是由于叶片的维管束数目增多和维管束之间距离增大引起的(图4)。和的叶片表型虽略有差异,但都属于叶片的横向生长发育不正常。
其他性状方面,突变体与的表型也略有不同。在抽穗期,突变体的分蘖数与野生型R401相比显著减少,株高未发生显著改变(图7),而突变体表现为多分蘖和半矮秆[15]。突变体表现出生长缓慢,导致生育期延长(图6),且结实率与野生型无异,而突变体与其野生型的生长速度一致,但其雌、雄配子体发育不正常,表现为不育[15-16]。在成熟期,突变体的穗长显著长于野生型,突变体的一次枝梗数、二次枝梗数和每穗粒数皆多于野生型(图7)。综上所述,突变体与都属于基因的突变体,突变位点和类型不同,应该属于等位基因,表型有相似之处,也有不同存在。这种表型相关却有所差异的现象也许和基因家族功能的复杂性有关。例如突变体的不同植株之间的表型也有所差异[15],的同源基因过量表达也会出现不同表型,有的出现扭曲、打结的叶片,同时无叶耳和叶舌[14];有的表现为叶脉数增多导致的叶片变宽[23];有的表型为叶片变短且宽,同时株高显著降低[12]。另外,这种表型相关却有所差异的现象也许和基因组背景(品种)不同有关,比如[17]、[18]和[19]等基因都被确认为基因,而它们只报道了叶片和颖壳光滑一种表型。所以,基因调控水稻叶片和其他性状发育的机制应该比较复杂,值得进一步深入研究。
水稻中维管束的发育和分布会影响叶宽[24-25]。水稻的反义转基因植株叶片变窄,其通过调控维管束发育在水稻叶片形成中发挥重要作用[21]。水稻突变后小花的分生组织提前终止,其调控水稻侧生器官发育和分生组织保持,在穗发育方面扮演重要角色[22]。本研究中,这2个基因在突变体中的表达量约为野生型R401的两倍左右,突变体的表型与这2个正调控基因的表达量变化趋势一致。本研究中突变体叶片变宽主要是由于叶片中大、小维管束数目增多,且小维管束间的距离变宽导致。推测是通过调控维管束发育从而影响水稻叶宽,同时也对分蘖、穗型等侧生器官发育产生影响。
也被称为,水稻基因家族中与序列相似性最高的是[26]。基因包括两个重复基因,分别为第11染色体上的和第12染色体上的,/双突变体表现为狭窄卷曲叶、多分蘖、少侧根、开裂的小穗和窄细籽粒等表型[13, 23],也调控根毛的形成[27]。可见主要调控器官的横向生长和侧生器官的生长,也表现出多效性,且其功能与相似。目前,已在水稻中发现了多个基因,其功能也与侧生器官发育有关,如OsWOX11是水稻不定根生长发育的关键调节因子[4-6],编码一个WOX蛋白家族成员,促进腋芽的形成[10]。
4 结论
本研究利用CRISPR/Cas9基因编辑技术创制了突变体。结果表明,突变体的表型与已有报道相关,但也有新表型出现,其影响了多个侧生器官的发育。本研究创制了基因的一个新的等位突变,为水稻基因调控侧生器官发育的深入研究奠定基础。
[1] 矫永庆. 水稻理想株型基因()的克隆与功能研究[D]. 北京: 中国科学院, 2010.
Jiao Y Q. Cloning and functional study of()[D]. Beijing: Chinese Academy of Sciences, 2010. (in Chinese with English abstract).
[2] 于燕杰, 张大兵, 袁政. WOX蛋白家族调控干细胞发育分子机制的研究进展[J]. 植物学报, 2016, 51(4): 565-574.
Yu Y J, Zhang D B, Yuan Z.Progress in the molecular mechanism of WOX protein family regulating stem cell development[J]., 2016, 51(4): 565-574. (in Chinese with English abstract)
[3] 高丽, 孙祎敏, 邵铁梅, 孔卫娜, 崔润丽, 卢楠, 仵陶. 植物WUSCHEL-related homeobox (WOX) 家族研究进展[J]. 生物技术通报, 2015, 31(5): 7-12.
Gao L, Sun W M, Shao T M, Kong W N, Cui R L, Lu N, Wu T.Research progress of WUSCHEL related homeobox (WOX) family of plants[J]., 2015, 31(5): 7-12. (in Chinese with English abstract)
[4] Zhao Y, Hu Y, Dai M, Huang L, Zhou D X. The WUSCHEL-related homeobox geneis required to activate shoot-borne crown root development in rice[J]., 2009, 21(3): 736-748.
[5] Zhao Y, Cheng S, Song Y, Huang Y, Zhou S, Liu X, Zhou D X. The interaction between riceandpromotes crown root development by regulating gene expression involved in cytokinin signaling[J]., 2015, 27(9): 2469-2483.
[6] Chen G, Feng H, Hu Q, Qu H, Chen A, Yu L, Xu G. Improving rice tolerance to potassium deficiency by enhancing-controlled root development[J]., 2015, 13(6): 833-848.
[7] Kamiya N, Nagasaki H, Morikami A, Sato Y, Matsuoka M. Isolation and characterization of a rice WUSCHEL-type homeobox gene that is specifically expressed in the central cells of a quiescent center in the root apical meristem[J]., 2003, 35(4): 429-441.
[8] Chu H W, Liang W Q, Li J, Hong F, Wu Y F, Wang L K, Wang J, Wu P, Liu C M, Zhang Q F, Xu J, Zhang D B. A CLE–WOX signaling module regulates root meristem maintenance and vascular tissue development in rice[J]., 2013, 64: 5359-5369.
[9] Wang W F, Li G, Zhao J, Chu H W, Lin W H, Zhang D B, Wang Z Y, Liang W Q., a WUSCHEL-related homeobox transcription factor, is required for tiller growth in rice[J/OL]., 2014, 10: e1004154.
[10] Lu Z F, Shao G N, Xiong J S, Jiao Y Q, Wang J, Liu G F, Meng X B, Liang Y, Xiong G S, Wang Y H, Li J Y., an ortholog of WUSCHEL in rice, is required for tiller bud formation[J]., 2015, 42(2): 71-78.
[11] Yasui Y, Ohmori Y, Takebayashi Y, Sakakibara H, Hirano H Y. WUSCHEL-RELATED HOMEOBOX4 acts as a key regulator in early leaf development in rice[J/OL]., 2018, 14: e1007365.
[12] Cho S H, Kang K, Lee S H, Lee I J, Paek N C.is involved in negative feedback regulation of the gibberellic acid biosynthetic pathway in rice ()[J]., 2016, 67(6): 1677-1687.
[13] Cho S H, Yoo S C, Zhang H, Pandeya D, Koh H J, Hwang J Y, Kim G T, Paek N C. The riceandloci encode WUSCHEL-related homeobox 3A () and function in leaf, spikelet, tiller and lateral root development[J]., 2013, 198(4): 1071-1084.
[14] Dai M, Hu Y, Zhao Y, Liu H, Zhou D X. Agene represses agene expression required for rice leaf development[J]., 2007, 144(1): 380-390.
[15] Obara M, Ikeda K, Itoh J I, Nagato Y. Characterization of leaf lateral symmetry 1 mutant[J]., 2004, 54(2): 157-163.
[16] Honda E, Yew C L, Yoshikawa T, Sato Y, Hibara K I, Itoh J I., a member of thegene family, regulates lateral organ development differentially from other paralogs,andin rice[J]., 2018, 59(2): 376-391.
[17] Angeles-Shim R B, Asano K, Takashi T, Shim J, Kuroha T, Ayano M, Ashikari M. A WUSCHEL-related homeobox 3B gene, depilous (), confers glabrousness of rice leaves and glumes[J]., 2012, 5(1): 28.
[18] Zhang H L, Wu K, Wang Y F, Peng Y, Hu F Y, Wen L, Han B, Qian Q, Teng S. A WUSCHEL-like homeobox gene,responses tolocus in rice[J]., 2012, 5(1): 30.
[19] Li J, Yuan Y, Lu Z, Yang L, Gao R, Lu J, Li J, Xiong G., encoding a homeodomain protein, regulates trichome development in rice[J]., 2012, 5(1): 32.
[20] Sun W Q, Gao D W, Xiong Y, Tang X X, Xiao X F, Wang C G, Yu S B., an AP2/ERF transcription factor, interacts withand regulates trichome formation in rice[J]., 2017, 10(11): 1417-1433.
[21] Nishimura A, Ito M, Kamiya N, Sato Y, Matsuoka M.regulates leaf development and maintenance of the shoot apical meristem in rice[J]., 2002, 30(2): 189-201.
[22] Tanaka W, Toriba T, Ohmori Y, Yoshida A, Kawai A, Mayama-Tsuchida T, Ichikawa H, Mitsuda N, Ohme-Takagi M, Hirano H Y. The YABBY geneis involved in lateral organ development and maintenance of meristem organization in the rice spikelet[J]., 2012, 24(1): 80-95.
[23] Ishiwata A, Ozawa M, Nagasaki H, Kato M, Noda Y, Yamaguchi T, Nosaka M, Shimizu-Sato S, Nagasaki A, Maekawa M, Hirano H Y, Sato Y. Two WUSCHEL-related homeobox genes,and, control leaf width in rice[J]., 2013, 54(5): 779-792.
[24] Chen M, Luo J, Shao G, Wei X, Tang S, Sheng Z, Song J, Hu P. Fine mapping of a major QTL for flag leaf width in rice,, which might be caused by alternative splicing of[J]., 2012, 31(5): 863-872.
[25] Qi J, Qian Q, Bu Q, Li S, Chen Q, Sun J, Liang W, Zhou Y, Chu C, Li X, Ren F, Palme K, Zhao B, Chen J, Chen M, Li C. Mutation of the ricegene, which encodes a novel protein, affects vein patterning and polar auxin transport[J]., 2008, 147(4): 1947-1959.
[26] Zhang X, Zong J, Liu J L, Yin J Y, Zhang D B. Genome-wide analysis ofgene family in rice, sorghum, maize,and poplar[J]., 2010, 52(11): 1016-1026.
[27] Yoo S C, Cho S H, Paek N C. Rice WUSCHEL-related homeobox 3A () modulates auxin-transport gene expression in lateral root and root hair development[J/OL]., 2013, 8(10): 10, e25929.
Identification of a Knockout Mutant ofGene in Rice (L.)
ZHENG Yali1, YU Linchuang1, AN Xiaoxiao1, CHENG Xinle1, REN Lijun1, SU Zilong1, ZHENG Xiaoya1,LAN Tao1, 2, 3, *
(1Key Laboratory of Genetics, Breeding and Multiple Utilization of Crops, Ministry of Education, Fujian Agriculture and Forestry University, Fuzhou 350002, China;2Key Laboratory of Applied Genetics of Universities in Fujian Province, Fujian Agriculture and Forestry University, Fuzhou 350002, China;3Fujian Provincial Key Laboratory of Crop Breeding by Design, Fujian Agriculture and Forestry University, Fuzhou 350002, China;*Corresponding author, E-mail: tlan@fafu.edu.cn)
Thegene regulates leaf morphology and trichome development in rice. This study aims to further understand the role ofgene in regulating rice development.In this study,ofrice variety R401 was knocked out by CRISPR/Cas9 gene editing technique. The mutation sites and phenotype of the obtained materials were analyzed as well as the expression levels of related genes.The 341stbase of the coding region ofof the obtained plant was changed from T to C, and the 395th-397th bases were absent, and the leaves and glumes of the mutant were glabrous, the same as the phenotype of//. Therefore, the plant wasmutant. In addition to the reported loss-of-function phenotype of, new phenotypes ofwere found in this study. Compared with wild-type R401, mutantshowed prolonged growth duration, decreased tiller number, wider and shorter leaves, longer panicle and more grains per panicle. At the same time, the mutanthad increased number of vascular bundles in the blade, increased distance between the small vascular bundles. The changes in the expression levels of the two genes related to the development of lateral organs in the mutantwere also consistent with the phenotypic changes.A new mutant of ricegene was identified that affects lateral organ development in rice.
rice (L.); lateral organs; vascular bundle; growth duration
10.16819/j.1001-7216.2021.0602
2020-06-02;
2020-09-04。
国家自然科学基金资助项目(31671668)。

