弥漫硬化型甲状腺乳头状癌1例临床病理分析
焦 娟,孙东瑾,肖莉玲,汪香玉,刘 霞
弥漫硬化型甲状腺乳头状癌(diffuse sclerosing variant of papillary thyroid carcinoma, DSVPTC)是甲状腺乳头状癌(papillary thyroid carcinoma, PTC)的一种罕见特殊类型,1985年由Viekery等首次报道,仅占PTC的0.7%~6.6%[1]。这一罕见亚型好发于20~30岁年轻女性,多以甲状腺弥漫增大(单侧或双侧)为首发症状,腺外侵犯、淋巴结转移率及远处转移率更高,DSVPTC较经典型甲状腺乳头状癌(conventional papillary thyroid carcinoma, CPTC)更具侵袭性。DSVPTC因弥漫性增大,临床及影像学检查极易误诊为桥本甲状腺炎(Hashimoto’s thyroiditis, HT),因此亟需提高对本病的诊断。本文回顾性分析1例DSVPTC的临床病理特征、影像学表现及免疫表型等,并对其进行分子检测,旨在提高对其的认识水平。
1 材料与方法
1.1 临床资料收集广东省深圳市第二人民医院病理科诊断的1例DSVPTC。患者女性,34岁,发现颈前区肿大2个月,于2020年3月29日入院。B超示甲状腺左侧叶上极可见一大小18 mm×10 mm的稍高回声区,边界不清,内部回声不均,内可见散在细小强回声光斑,后方回声无明显改变。入院检测甲状腺功能及降钙素均正常,患者既往有甲亢病史5年,规律药物治疗。患者行左侧甲状腺全切+淋巴结活检术。
1.2 方法手术切除标本经10%中性福尔马林固定,常规脱水、石蜡包埋,HE染色,镜下观察。免疫组化染色采用罗氏公司BenchMark XT全自动免疫组化仪,TTF-1、CK19、Syn、p40、CD56、D2-40一抗均使用单克隆抗体,均购自北京中杉金桥公司。PCR技术检测KRAS、NRAS及BRAF基因,用DNA提取试剂盒(厦门艾德生物公司)提取肿瘤细胞中的DNA,通过人类KRAS突变检测试剂盒、人类NRAS突变检测试剂盒及人类BRAF V600E突变检测试剂盒(厦门艾德生物公司)的荧光定量PCR实验得到突变孔(FAM)信号或内控孔(HEX)信号的Ct值,根据Ct值判读KRAS、NRAS及BRAF基因是否突变。运用Sanger测序法检测TERT启动子基因突变,使用ABI 3500Dx基因分析仪进行分析。FISH检测所用RET基因断裂探针购自广州安必平公司,实验步骤和判读标准均按照试剂说明书进行。
2 结果
2.1 眼观术后送检灰红色组织1块,大小4.5 cm×2.5 cm×2 cm,切面灰白色,质韧,未见明显结节。
2.2 镜检低倍镜下甲状腺组织结构破坏,在淋巴细胞性甲状腺炎背景下可见部分乳头状结构,细胞核具有CPTC核特征:细胞核增大、核拉长、拥挤,呈磨玻璃样,可见核沟及核内包涵体,并可见砂砾体及钙化,局灶可见鳞状上皮化生(图1A、B)。送检六区淋巴结,查见淋巴结7枚,3枚见癌转移。
2.3 免疫表型与CPTC相似,DSVPTC肿瘤细胞TTF-1(图1C)及CK19(图1D)弥漫阳性,CD56阴性,鳞状化生的肿瘤细胞p40阳性(图1E),Syn阴性,疑似癌栓的裂隙D2-40阳性(图1F)。
2.4 基因检测PCR结果显示KRAS、NRAS及BRAF均未检测到突变。Sanger测序结果显示未检测到TERT启动子区突变(图2),RET基因断裂检测未检测到RET分离信号(图3)。
2.5 随访患者手术后未行其他辅助治疗,随访5个月,无复发转移。
3 讨论
PTC是内分泌系统最常见的恶性肿瘤,其发病率呈逐年上升趋势。2018年全球癌症统计数据显示:我国甲状腺癌的发病率位居第7位,在女性中高居第4位,甲状腺癌已成为恶性肿瘤中发病率增长最快的一类肿瘤。外科手术、放射性碘及内分泌治疗能使大部分分化型甲状腺癌(differentiated thyroid carcinoma, DTC)患者获得良好的预后,但仍有约10%的患者表现为高复发率和高病死率的侵袭性生物学行为[2]。
DSVPTC是PTC的一种罕见亚型,WHO(2004)甲状腺及甲状旁腺病理及遗传学分类将其纳入PTC的亚型中,在陆续的报道中,尤其是影像学报道中,常常被误诊为淋巴细胞性甲状腺炎或亚急性肉芽肿性甲状腺炎。因其多见于年轻女性,比CPTC侵袭性强,常常发生颈部淋巴结转移或远处转移,远处转移最常见于肺转移,因此亟需提高对该病的认识。一项荟萃了732例DSVPTC的Meta分析结果显示:DSVPTC表现出比CPTC更具侵略性的临床病理行为(更高的血管侵袭率、更高的甲状腺外累及、淋巴结转移、远处转移以及高复发风险),DSVPTC患者的总生存期较差[3]。
本例患者为年轻女性,颈前区肿大2个月入院,甲状腺功能正常,病理形态较为典型。结合文献报道[4-6],DSVPTC形态特点主要为以下几点:(1)多个不规则而粗短的微乳头形成,细胞核具有PTC核特征;(2)鳞状上皮化生灶;(3)大量砂砾体及钙化;(4)明显的淋巴细胞浸润;(5)明显的间质纤维化。由此可见鳞状上皮化生、砂砾体、间质广泛纤维化及淋巴细胞浸润是DSVPTC重要的组织学形态特征及诊断要点。其免疫表型与CPTC一致,鳞化的病灶也表达CK19,提示DSVPTC与CPTC的起源相同,均起源自甲状腺滤泡上皮[7]。病灶中可见多处脉管内癌栓,这也是DSVPTC易发生转移的原因。

图1 A.鳞状化生的肿瘤细胞呈不规则浸润性生长,间质纤维化;B.典型的乳头状癌核特征伴砂砾体,肿瘤周围淋巴滤泡形成;C.肿瘤细胞TTF-1弥漫阳性,SP法;D.肿瘤细胞CK19弥漫阳性,SP法;E.鳞状上皮化生区域p40阳性,SP法;F.疑似癌栓的裂隙D2-40阳性,SP法

图2 Sanger测序结果显示未检测到TERT启动子区突变
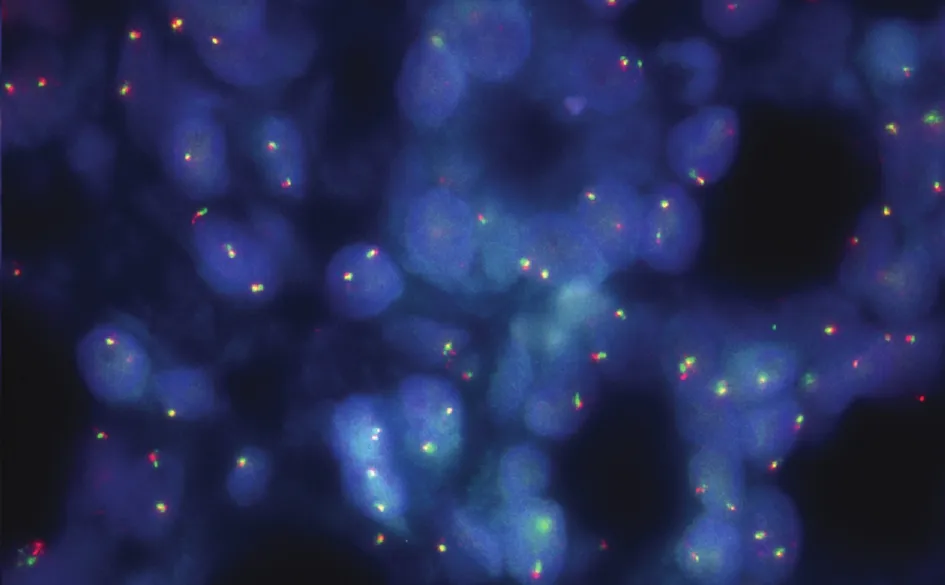
图3 FISH结果显示RET基因未检测到分离信号
甲状腺的发生、发展、侵袭和转移与基因改变、信号转导通路及相关分子功能紊乱密切相关,目前已知的相关基因改变包括:BRAF突变、RAS突变、RET/PTC重排、PAX8/PPARγ重排、TRK重排、TP53突变、CTNNB1突变、PTEN突变,PIK3CA突变等。其中最常见的是BRAF V600E基因突变,其在乳头状癌中的平均突变率约为45%,在低分化癌中突变率为24%,而在甲状腺滤泡状癌和髓样癌及甲状腺良性肿瘤中均未见BRAF V600E突变,表明BRAF V600E基因突变与PTC的发生密切相关。自2013年Liu等[8]初次报道PTC中TERT启动子突变以来,越来越多的研究均一致地发现TERT启动子突变存在于甲状腺癌中,不存在于良性甲状腺肿瘤中,并且在侵袭性甲状腺癌中更常见。本例进行了包括BRAF、KRAS、NRAS、TERT及RET基因的检测,结果均未检测到BRAF、KRAS、NRAS、TERT的突变,与文献报道结果一致,尽管DSVPTC的侵袭性较强,但其分子表现BRAF、KRAS、NRAS、TERT均野生型。美国病理学家学会(CAP)证实PTC患者常发生RET/PTC基因重排,尤其在年轻患者和曾辐射暴露的患者中频发,并且RET基因重排的不同类型使得甲状腺肿瘤细胞有不同的表型特质[7]。本例中未检测到RET基因重排,而一项回顾性分析发现仅在DSVPTC中检测到RET/PTC重排(4/8,50%),RAS基因突变和PAX8/PPARG重排多在甲状腺滤泡癌和PTC滤泡亚型中检测到,BRAF基因突变则多在CPTC中检测到[9],受病例数限制有关RET基因与DSVPTC生物学特性及预后的影响仍需进一步探究。基因微阵列比较基因组杂交技术也显示DSVPTC无染色体异常变化,而CPTC发现1q21.1-q44存在重复变异,9q21.11-q34.13和22q11.21-q13.33存在缺失变异[10]。由此可见即使是同一类型不同亚型的甲状腺癌也存在一些差异,DSVPTC与CPTC的基因不同,多数BRAF、KRAS、NRAS、TERT为野生型,而有关RET/PTC基因重排还需进一步研究。
综上所述,DSVPTC是一组罕见的PTC亚型,好发于年轻女性,比CPTC侵袭性强,常发生颈部淋巴结转移或远处转移,具有特殊的组织学形态及分子亚型表现。正确诊断和分型甲状腺癌,对选择最佳治疗方案和评估患者预后具有重要临床意义。

