安神定志方对阿尔茨海默病大鼠海马组织miR-103a-3p及其介导的Tau蛋白磷酸化的影响
王欣波,赵宇,袁星星
安神定志方对阿尔茨海默病大鼠海马组织miR-103a-3p及其介导的Tau蛋白磷酸化的影响
王欣波1,赵宇1,袁星星2
1.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;2.黑龙江省中医药科学院,黑龙江 哈尔滨 150006
观察安神定志方对阿尔茨海默病(AD)大鼠海马组织miR-103a-3p及其介导的Tau蛋白磷酸化的影响,探讨其相关作用机制。通过GEO数据库筛选AD海马组织差异表达miRNA。50只SD大鼠随机分为空白组、模型组、miR-103a-3p mimic组、安神定志方组和miR-103a-3p mimic+安神定志方组,每组10只,采用Aβ1-42侧脑室注射制备AD大鼠模型。造模后各给药组给予相应药物干预4周。Morris水迷宫实验检测大鼠学习记忆能力,HE染色观察海马组织形态,RT-PCR检测海马组织miR-103a-3p基因的表达,Western blot和免疫组化检测海马组织脑源性神经营养因子(BDNF)及Tau蛋白的表达。通过GEO数据库共筛选出34个差异miRNA,其中17个上调、17个下调。与模型组比较,安神定志方显著增加AD大鼠跨越平台次数和有效停留时间,减少逃避潜伏期,改善海马CA1区组织形态,上调BDNF的表达,抑制miR-103a-3p、p-TauSer396和p-TauThr231的表达,差异均有统计学意义(<0.05)。安神定志方可能通过抑制海马组织miR-103a-3p的表达进而促进BDNF的表达,调控Tau蛋白的磷酸化水平,从而促进AD大鼠学习记忆能力。
安神定志方;阿尔茨海默病;GEO数据库;miR-103a-3p;Tau蛋白磷酸化;大鼠
阿尔茨海默病(Alzheimer disease,AD)是临床常见的神经退行性疾病,约占所有痴呆类型的60%~80%。AD以细胞外β淀粉样蛋白(Aβ)异常沉积形成的老年斑及细胞内Tau蛋白过度磷酸化引起的神经元纤维缠结为主要病理特征。迄今为止,AD发病确切机制尚未被完全诠释,导致治疗存在诸多不足,临床多以对症治疗为主。AD属中医学“健忘”“痴呆”范畴。安神定志方出自《医学心悟》,具有安神定志、化痰镇惊功效。现代药理研究显示,安神定志方活性成分对AD均有一定的治疗作用[1-3]。课题组前期研究发现,安神定志方可通过激活BDNF/TrkB信号通路进而抑制Tau蛋白的磷酸化水平,从而改善AD大鼠学习和记忆的能力[4]。本研究通过检测脑源性神经营养因子(BDNF)上游miR-103a-3p的表达水平,为进一步明确安神定志方的作用机制提供依据。
1 材料与方法
1.1 数据来源
本研究所用芯片数据下载于GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)。获得GSE129053数据集[5],采用GPL18058平台(Exiqon miRCURY LNA microRNA array,7th generation)。数据集以Aβ1-42诱导的AD模型和假手术大鼠海马组织为研究样本,每组3只,共6只。
1.2 数据处理
采用Bioconductor软件的“limma”包对芯片数据进行缺失补全、校正和归一化处理。使用R软件对数据进行贝叶斯检验,以adj<0.05和|LogFC|≤2为条件对差异miRNA进行筛选。
1.3 动物及分组
50只雄性SD大鼠,体质量(214±9)g,购于黑龙江中医药大学动物实验中心,动物质量合格证号SCXK(黑)2015003。饲养于黑龙江中医药大学中西医结合实验室,温度21~24 ℃,相对湿度45%~55%,自由摄食饮水,每日光照时间12 h。适应性饲养1周后随机分为空白组、模型组、miR-103a-3p mimic组、安神定志方组和miR-103a-3p mimic+安神定志方组,每组10只。
1.4 药物及制备
安神定志方(党参15 g,茯苓15 g,茯神15 g,龙齿25 g,远志5 g,石菖蒲5 g),饮片购自黑龙江中医药大学附属第一医院中药房,加水浸泡,煎煮2次,合并药液,过滤,浓缩至含原药材40 mg /mL。
1.5 主要试剂与仪器
miR-103a-3p mimic,上海吉玛制药技术有限公司合成(A0018084),使用前将1 nmol/L的miR-103a-3p mimic溶液置于100 μL PBS,再将70 μL PBS与30 μL Lipofectamine 2000混合液(11668-026)与之混匀;Aβ1-42,美国Sigma公司,批号M2168;HE染色试剂盒,南京建成生物工程研究所,批号20190617;mirVana miRNA试剂盒,美国赛默飞世尔科技公司,货号AM1556;BDNF、Tau、p-TauSer396、p-TauThr231和β-actin一抗兔多克隆抗体,上海碧云天生物技术有限公司,货号分别为P0015A、P0022A、P0023A、P0013、P0025;辣根过氧化物酶(HRP),沈阳万类生物科技有限公司,货号wl0715。脑立体定位仪(KW-DWY-S,南京卡尔文生物科技有限公司),微量注射仪(北京品超思瑞科技有限公司),Morris水迷宫(上海软隆科技发展有限公司),CX23光学显微镜(日本奥林巴斯株式会社),164-5052蛋白电泳和转膜仪(美国伯乐公司),ABI7500荧光定量PCR仪(美国赛默飞世尔科技公司)。
1.6 模型建立及药物干预
采用Aβ1-42侧脑室注射建立AD大鼠模型[6]。大鼠腹腔注射3%戊巴比妥钠麻醉,将其固定于脑立体定位仪,侧脑室定位参照《大鼠脑立体定位图谱》[7]。采用微量注射仪向大鼠侧脑室内缓慢匀速注射浓度为1 g/L Aβ1-42溶液3 μL,空白组注射等体积生理盐水,留针3 min,以1 mm/min速度缓慢退针,牙托粉封孔。术后第3日起大鼠给予相应药物干预,miR-103a-3p mimic组尾静脉注射miR-103a-3p mimic 200 μL,安神定志方组给予安神定志方浓缩液(0.2 g/kg)1 mL灌胃,miR-103a-3p mimic+安神定志方组给予miR-103a-3p mimic 200 μL尾静脉注射联合安神定志方浓缩液(0.2 g/kg)1 mL灌胃,空白组和模型组给予等体积生理盐水灌胃,连续4周。
1.7 指标检测
1.7.1 Morris水迷宫实验
第21日采用Morris水迷宫实验检测大鼠学习记忆能力,包括适应性训练、定位巡航和空间探索3个部分,记录大鼠逃避潜伏期、跨越平台次数和有效停留时间,连续7 d。
1.7.2 HE染色
第29日大鼠腹腔注射3%戊巴比妥钠麻醉,断头取脑,分离海马CA1区,4%多聚甲醛中固定,石蜡包埋,切片,HE染色,镜下观察组织形态。
1.7.3 RT-PCR检测
取部分海马组织,根据试剂盒说明书使用mirVana miRNA试剂盒提取总miRNA,并用非编码miRNA第一链互补DNA合成试剂盒对miRNA进行反转录至cDNA。引物miR-103a-3p:F 5’-ATCCAG TGCGTGTCGTG-3’,R 5’-TGCTAGCAGCATTGTAC AGG-3’,扩增产物长度92 bp;U6:F 5’-GCTTCG GCAGCACATATACTAAAAT-3’,R 5’-CGCTTCACG AATTTGCGTGTCAT-3’,扩增产物长度125 bp。Power SYBR Green PCR预混液混匀后置于ABI7500荧光定量PCR仪进行扩增反应,以U6为内参,采用2-ΔΔCt法计算miR-103a-3p的相对表达量。
1.7.4 Western blot检测
取部分海马组织,加入适量RIPA裂解液冰上裂解,12 000 r/min离心15 min,取上清液,BCA法测定总蛋白浓度。煮沸变性后进行SDS-PAGE电泳,转至PVDF膜。脱脂奶粉封闭,加入稀释的BDNF、Tau、p-TauSer396、p-TauThr231和β-actin一抗,4 ℃孵育过夜,加入HRP标记的二抗,室温孵育1 h。超敏ECL试剂显影,凝胶成像系统拍照,以β-actin作为内参,计算目的蛋白的相对表达量。
1.7.5 免疫组化检测
取海马组织石蜡切片,脱蜡至水。3%H2O2室温封闭10 min,消除内源性过氧化物酶,微波抗原修复后,加入山羊血清封闭15 min。加入稀释的BDNF、Tau、p-TauSer396、p-TauThr231和β-actin一抗,4 ℃孵育过夜,加入HRP标记的二抗,室温孵育1 h,DAB显色,苏木素复染、脱水、封片,光学显微镜下观察。
1.8 统计学方法
2 结果
2.1 差异microRNA筛选结果
GSE129053数据集共筛选出34个差异miRNA,其中17个上调、17个下调。同时,AD模型3个样本中miR-103a-3p的表达均上调。结果见图1、表1。
2.2 安神定志方对模型大鼠学习记忆能力的影响
Morris水迷宫实验结果显示,与空白组比较,模型组大鼠跨越平台次数和有效停留时间明显减少,逃避潜伏期显著增加,差异均有统计学意义(<0.05)。与模型组比较,miR-103a-3p mimic组大鼠跨越平台次数和有效停留时间明显减少,逃避潜伏期显著增加,差异均有统计学意义(<0.05);安神定志方组大鼠跨越平台次数和有效停留时间显著增加,逃避潜伏期显著减少,差异均有统计学意义(<0.05)。而安神定志方对AD治疗作用部分被miR-103a-3p mimic抵消,miR-103a-3p mimic+安神定志方组大鼠逃避潜伏期较安神定志方组增加,跨越平台次数和有效停留时间变化不明显,差异无统计学意义(>0.05)。结果见表2。
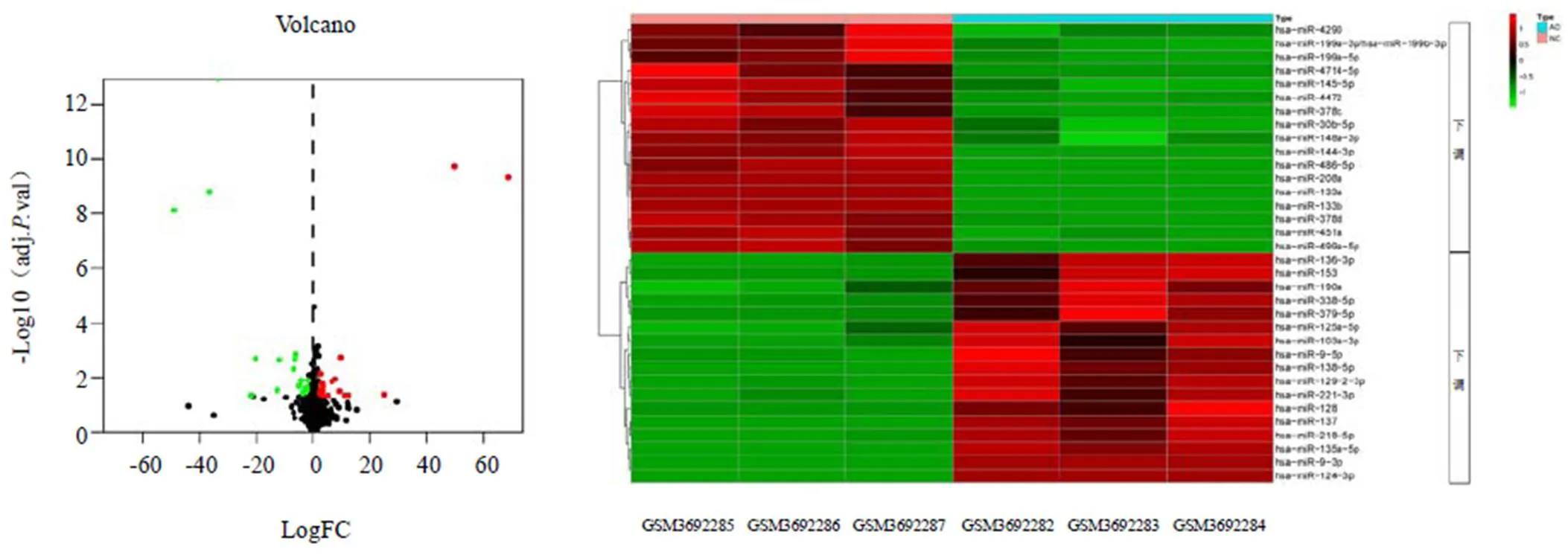
图1 GSE129053数据集中差异表达miRNA的火山图和热图
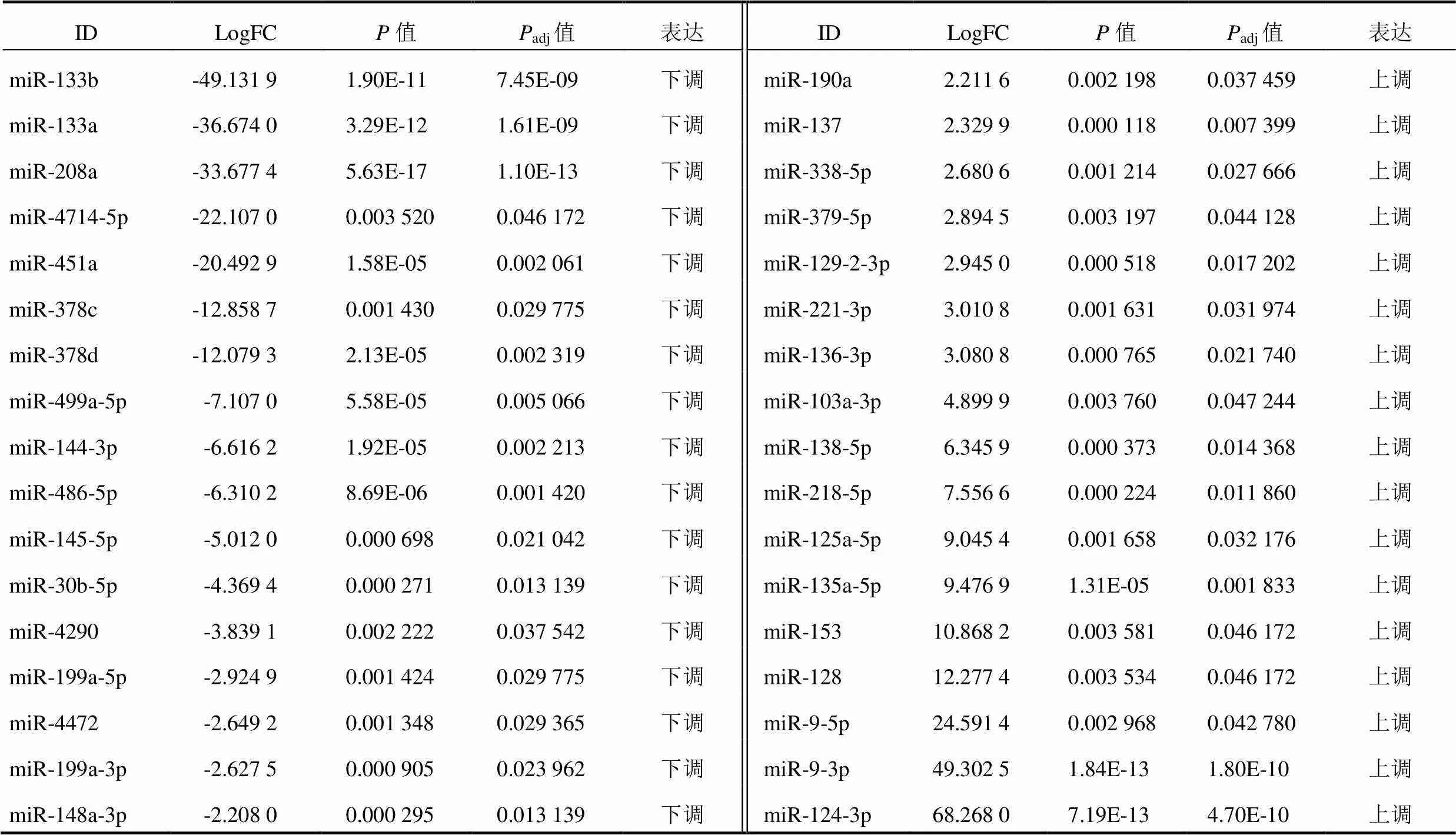
表1 GSE129053数据集中差异表达miRNA
表2 各组大鼠Morris水迷宫实验结果比较(±s)
注:与空白组比较,*<0.05;与模型组比较,#<0.05
2.3 安神定志方对模型大鼠海马CA1区组织形态的影响
HE染色结果显示,空白组大鼠海马CA1区细胞排列整齐,无明显病理改变;模型组大鼠海马CA1区神经元数量减少,细胞排列紊乱,细胞核皱缩、变小;miR-103a-3p mimic组大鼠海马CA1区神经元数量进一步减少,细胞膜与细胞核膜界线消失,胞质染色变深;与模型组比较,安神定志方组大鼠海马CA1区组织形态明显改善;miR-103a-3p mimic+安神定志方组大鼠海马CA1区组织形态未见明显改善。见图2。
2.4 安神定志方对模型大鼠海马组织miR-103a-3p表达的影响
与空白组比较,模型组大鼠海马组织miR-103a-3p表达显著上调,差异有统计学意义(<0.05);与模型组比较,miR-103a-3p mimic组大鼠海马组织miR-103a-3p表达显著上调(<0.05),安神定志方组大鼠海马组织miR-103a-3p表达显著下调(<0.05),miR-103a-3p mimic+安神定志方组大鼠海马组织miR-103a-3p表达略降低,差异无统计学意义(>0.05)。结果见表3。

图2 各组大鼠海马CA1区组织形态(HE染色,×200)
表3 各组大鼠海马组织miR-103a-3p表达比较(±s)
注:与空白组比较,*<0.05;与模型组比较,#<0.05
2.5 安神定志方对模型大鼠海马组织脑源性神经营养因子及Tau蛋白表达的影响
通过TargetScan网站(http://www.targetscan.org)预测miR-103a-3p的潜在靶基因,结果显示,BDNF的3’-UTR与miR-103a-3p存在结合位点。Western blot检测结果显示,与空白组比较,模型组大鼠海马组织BDNF表达显著降低,p-TauSer396和p-TauThr231表达显著升高,差异均有统计学意义(<0.05);与模型组比较,miR-103a-3p mimic组大鼠海马组织BDNF表达显著降低,p-TauSer396和p-TauThr231表达显著升高,差异均有统计学意义(<0.05);安神定志方组大鼠海马组织BDNF表达显著升高,p-TauSer396和p-TauThr231表达显著降低,差异均有统计学意义(<0.05),miR-103a-3p mimic+安神定志方组海马组织BDNF表达略增加,p-TauSer396和p-TauThr231表达略降低,差异无统计学意义(>0.05)。结果见图3、表4。
此外,通过免疫组化染色进一步检测海马组织BNDF及Tau蛋白的表达,通过Image J软件对蛋白的平均光密度(IOD值)进行半定量分析,结果与Western blot趋势相同。同时,各组Tau蛋白表达未见明显差异。结果见图4、表5。

注:1.空白组;2.模型组;3. miR-103a-3p mimic组;4.安神定志方组; 5. miR-103a-3p mimic+安神定志方组
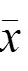
表4 各组大鼠海马组织BNDF及Tau蛋白表达比较(±s)
注:与空白组比较,*<0.05;与模型组比较,#<0.05
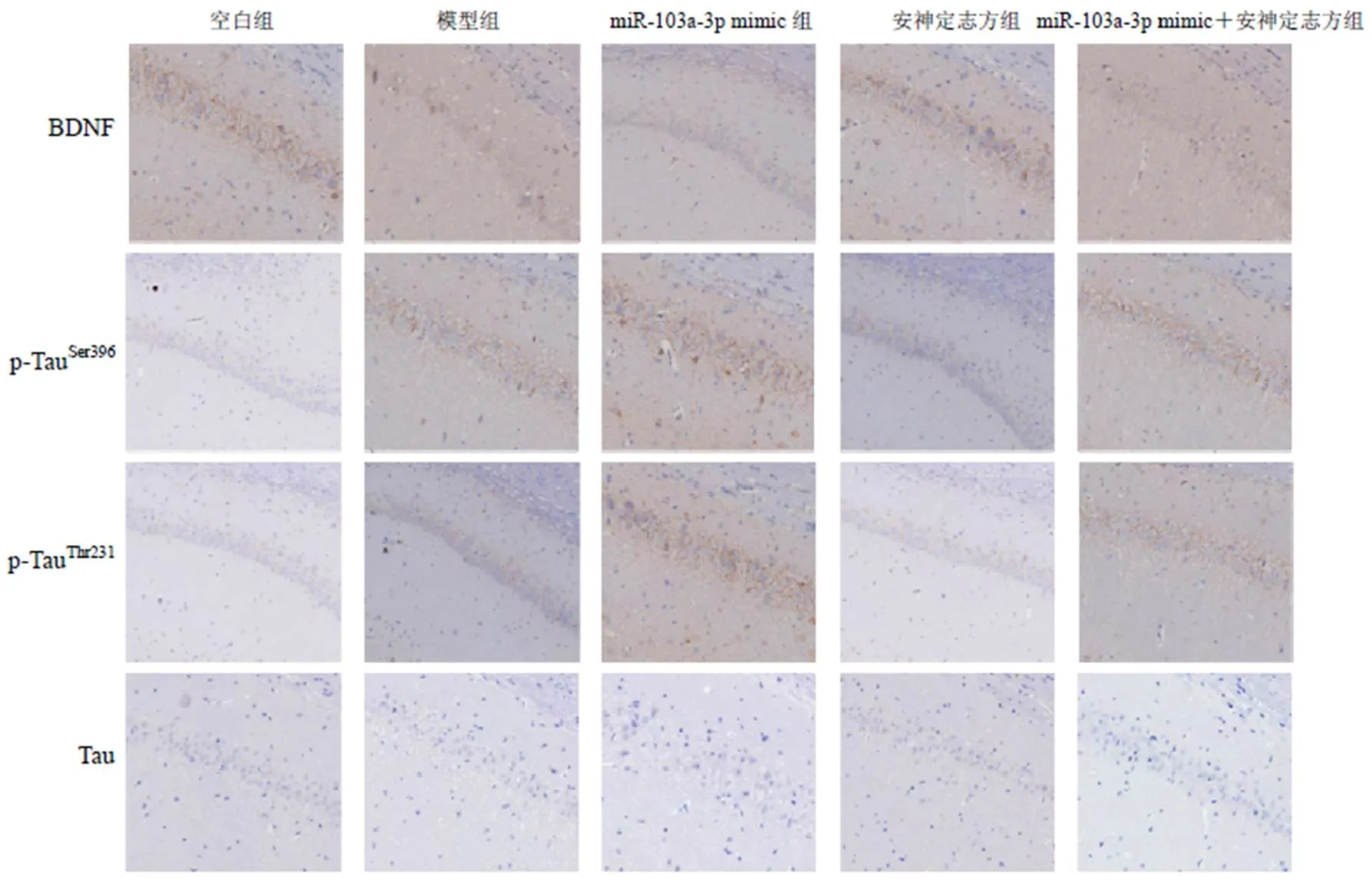
图4 各组大鼠海马组织BNDF及Tau蛋白阳性表达(免疫组化染色,×200)

表5 各组大鼠海马组织BNDF及Tau蛋白表达比较(±s)
注:与空白组比较,*<0.05;与模型组比较,#<0.05
3 讨论
miRNA是一类长度约为19~24个核苷酸的内源性非编码RNA,具有高度的保守性和组织特异性,广泛分布于中枢神经系统,对神经分化和成熟具有重要的调节作用。研究表明,miRNA可直接或间接参与Aβ的代谢、Tau蛋白的磷酸化、神经炎症、胆固醇代谢、氧化应激和轴突可塑性,进而参与AD的发生与发展[8]。随着基因芯片技术和RNA测序技术的飞速发展,基于基因表达数据库的生物信息学分析为发现新的功能性miRNA提供了便利条件。本研究通过GEO数据库获取AD大鼠海马组织中差异表达的miRNA,结果表明AD大鼠34个miRNA存在差异表达。本研究选取miR-103a-3p进行进一步研究。有研究证实,miR-103a-3p在肿瘤和子宫腺肌症发病中发挥着重要作用[9-14],但关于miR-103a-3p在AD中的作用迄今尚未见报道。本研究结果表明,Aβ1-42诱导的AD模型大鼠海马组织miR-103a-3p表达显著上调,这与GSE129053芯片结果一致。本研究结果还表明,miR-103a-3p mimic尾静脉注射可显著升高海马组织miR-103a-3p的表达,Morris水迷宫实验和HE染色结果显示,miR-103a-3p mimic可抑制AD大鼠学习记忆能力,加重海马神经元的损伤。安神定志方能显著抑制海马组织miR-103a-3p的表达,从而促进AD大鼠学习记忆能力和神经元损伤的修复,改善海马组织形态。
BDNF是一种广泛分布于海马组织和大脑皮层的神经营养因子,通过在形态和功能上调控突触的可塑性,进而影响AD大鼠的学习记忆能力[15]。有研究显示,AD患者血清和海马组织BDNF表达显著降低,并且BDNF水平与AD患者病情严重程度呈负相关[16-17]。在神经元中,BDNF通过与酪氨酸蛋白激酶受体B结合,激活MAPK、PI3K/Akt及PLC信号通路,进而促进神经元的增殖、分化与存活[18]。课题组前期研究表明,BDNF是安神定志方治疗AD的有效靶点,其可呈剂量依赖性增加AD大鼠海马组织BNDF的表达。本研究通过TargetScan网站发现BDNF是miR-103a-3p的潜在靶基因。尽管本研究未通过荧光素酶报告基因检测两者之间的结合活性,但结合之前的研究结果发现,miR-103a-3p mimic能显著抑制海马组织BDNF的表达并干扰安神定志方对BDNF的调控作用。
Tau蛋白是一种微管相关蛋白,主要分布于大脑颞叶、内嗅区和海马组织的神经元。Tau蛋白的磷酸化主要发生在苏氨酸和丝氨酸的残基上,并在磷酸酯酶和磷酸激酶的调控下维持磷酸化和去磷酸化的平衡状态[19]。研究表明,Tau蛋白异常磷酸化是AD的重要特征之一,同时直接影响Tau蛋白与微管结合的能力,最终导致原纤维丝的形成[20]。本研究通过Western blot和免疫组化检测AD大鼠海马CA1区Tau蛋白的表达,结果显示,miR-103a-3p mimic显著促进Tau蛋白Ser396和Thr231位点的磷酸化,而安神定志方能显著抑制p-TauSer396和p-TauThr231的表达,与前期研究结果一致。
综上所述,安神定志方可能通过抑制miR-103a-3p的表达,进而上调海马组织BDNF的表达,调控Tau蛋白的磷酸化水平,从而促进AD大鼠学习记忆能力。
[1] 卢成淑,冯宁,南国,等.石菖蒲及其活性成分防治阿尔茨海默病的研究进展[J].中草药,2016,47(7):1236-1242.
[2] 王昊,赵振宇,沈霞,等.基于系统药理学研究远志治疗阿尔茨海默病的作用机制[J].药学学报,2017,52(10):1554-1561.
[3] 谌勤,罗洪斌,谢文执.板桥党参通过PP2A信号通路改善AD模型大鼠认知功能障碍[J].中国药理学通报,2019,35(9):1232-1239.
[4] 王欣波,赵宇.安神定志方对阿尔茨海默病大鼠Tau蛋白磷酸化及BDNF/TrkB信号通路的影响[J].海南医学院学报,2019,25(21):1612-1616.
[5] WANG Z, XU P, CHEN B, et al. Identifying circRNA-associated- ceRNA networks in the hippocampus of Aβ1-42-induced Alzheimer's disease-like rats using microarray analysis[J]. Aging (Albany NY), 2018,10(4):775-788.
[6] 张云鹤,张一娜,刘歆,等.Aβ1-42诱导原代海马神经细胞建立阿尔茨海默病细胞模型[J].中国老年学杂志,2011,31(11):2027-2029.
[7] PAXINOS G.大鼠脑立体定位图谱[M].3版.诸葛启钏,译.北京:人民卫生出版社,2005:2-30.
[8] 杨婷婷,刘辰庚,王培昌.MicroRNA作为阿尔茨海默病标志物的研究进展[J].中国老年学杂志,2016,36(20):5190-5193.
[9] 杨群,苏波,郑郧,等.阿尔茨海默病小鼠与野生型小鼠海马中miRNA表达差异[J].中国老年学杂志,2016,36(3):532-536.
[10] 徐鑫鑫,林兰,王旭东,等.miR-103a-3p对肺癌A549细胞增殖、迁移和侵袭的影响[J].临床检验杂志,2018,36(8):583-588.
[11] 杨雨澎,杨志,李晓冬.miR-103a-3p通过调控FEZF1/CDC25A途径影响肝癌细胞的增殖和凋亡[J].临床和实验医学杂志,2018,17(11):1158- 1163.
[12] 王敏,杨睿,钟镇宇,等.环状RNA circTCF25通过miR-103a-3p/ miR-107调控CDK6的表达促进膀胱癌的增殖和迁移[J].中国细胞生物学学报,2018,40(6):929-936.
[13] 张亚珍,何贵省,吴晓明,等.miR-103a-3p在乳腺癌组织和血清中的表达及通过下调PDK4抑制乳腺癌细胞的有氧糖酵解及增殖[J].中国肿瘤生物治疗杂志,2018,25(5):490-496.
[14] 贺军,曹金敏,陈国栋,等.miR-103a-3p在胰腺癌细胞中的表达及意义[J].中国医学创新,2015,12(6):1-4.
[15] 林玲,蔡智慧,常全忠.西红花苷对阿尔茨海默病大鼠空间学习记忆的影响[J].中药药理与临床,2016,32(1):75-79.
[16] LASKE C, STELLOS K, HOFFMANN N, et al. Higher BDNF serum levels predict slower cognitive decline in Alzheimer's disease patients[J]. International Journal of Neuropsychopharmacology, 2011,14(3):399-404.
[17] HOCK C, HEESE K, HULETTE C. Region-specific neurotrophin imbalances in Alzheimer disease:decreased levels of brain-derived neurotrophic factor and increased levels of nerve growth factor in hippocampus and cortical areas[J]. Archives of Neurology,2000,57(6):846-851.
[18] 许曼玉,许志强.不同形态脑源性神经营养因子与阿尔茨海默病关系研究进展[J].重庆医学,2019,48(6):1025-1028.
[19] 高珊,孔立红.Tau蛋白的过度磷酸化机制及其在阿尔茨海默病中的作用[J].华中科技大学学报(医学版),2016,45(6):711-715.
[20] 王建枝,田青.Tau蛋白过度磷酸化机制及其在阿尔茨海默病神经元变性中的作用[J].生物化学与生物物理进展,2012,39(8):771-777.
Effects ofPrescription on miR-103a-3p and Its Mediated Phosphorylation of Tau Protein in Hippocampus of Alzheimer Disease Rats
WANG Xinbo1, ZHAO Yu1, YUAN Xingxing2
To investigate the effects ofPrescription on the levels of miR-103a-3p and Tau protein phosphorylation in hippocampus of Alzheimer disease (AD) rats; To discuss its related mechanism of action.Differentially expressed miRNAs in hippocampus of AD were screened by GEO database. 50 SD rats were randomly divided into control group, model group, miR-103a-3p mimic group,Prescription group and miR-103a-3p mimic combined withPrescription group, with 10 rats in each group. The AD rat model was established by intracerebroventricular injection of Aβ1-42. After modeling, each group was given corresponding drug intervention for 4 weeks. Morris water maze test was used to detect the learning and memory ability. HE staining was used to detect the morphological changes of hippocampus. The expression of miR-103a-3p was detected by RT-PCR. The expressions of BDNF and Tau protein in hippocampus were detected by Western blot and immunohistochemistry.A total of 34 miRNAs were screened by GEO database, 17 of which were up-regulated and 17 were down-regulated. Compared with the model group,Prescription could significantly increase the times of crossing platform and effective residence time, reduce escape latency, improve the tissue morphology of hippocampal CA1 area, up-regulate the expression level of BDNF, and inhibit the expression level of miR-103a-3p, p-TauSer396and p-TauThr231, with statistical significance (<0.05).Prescription may promote the expression of BDNF by inhibiting the expression of miR-103a-3p in hippocampus, and regulate the phosphorylation level of Tau protein, thereby promoting the learning and memory ability of AD rats.
Prescription; Alzheimer disease; GEO database; miR-103a-3p; Tau protein phosphorylation; rats
R285.5
A
1005-5304(2021)02-0062-07
10.19879/j.cnki.1005-5304.202007309

黑龙江省自然科学基金面上项目(H2018063);黑龙江省中医药科研项目(21102190005)
袁星星,E-mail:yuanxingxing80@163.com
(收稿日期:2020-07-15)
(修回日期:2020-08-10;编辑:华强)

