肝癌脑转移瘤合并卒中患者CT、核磁共振影像学特点及预后因素分析
陶景山 臧晓进 戴益盛 刘 斌
滨海县人民医院影像科 (江苏 滨海, 224500)
肝癌晚期大多出现全身转移情况,常见部位有肺、骨、淋巴结等,肝癌脑转移较少见,仅为0.20%~2.20%[1-3],肝癌脑转移瘤合并卒中则更少见[4],而且单发病灶易误诊为颅内出血性疾病。有文献报道,CT、MRI对早期肝癌脑转移瘤合并卒中有提示作用,但其治疗效果并不理想,患者生存期短[5]。本研究旨在总结我院收治的肝癌脑转移瘤合并卒中患者的CT、MRI影像学特点,并对影响预后的因素进行分析,报道如下。
1 资料与方法
1.1 一般资料 选取2014年1月至2019年1月我院收治的肝癌脑转移瘤合并卒中患者38例,其中男29例,女9例,年龄29~72岁,平均年龄为42.34岁。33例还发生肺转移(86.84%)、5例骨转移(13.16%)。其中4例初诊时因“自发性脑出血”收住院(最后确诊为肝癌脑转移瘤合并卒中)。
1.2 纳入标准 均有原发性肝癌病史;肝癌脑转移瘤合并卒中时间间隔15 d~7年;平扫/增强CT或MRI扫描示脑转移占位性病灶,肿瘤周边有或无水肿带;临床资料完整。
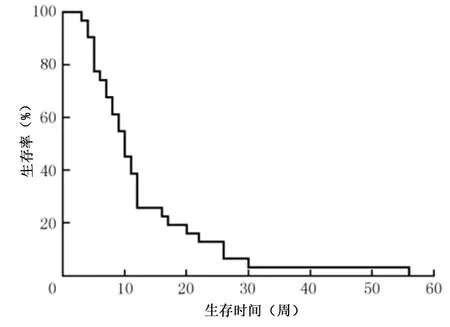
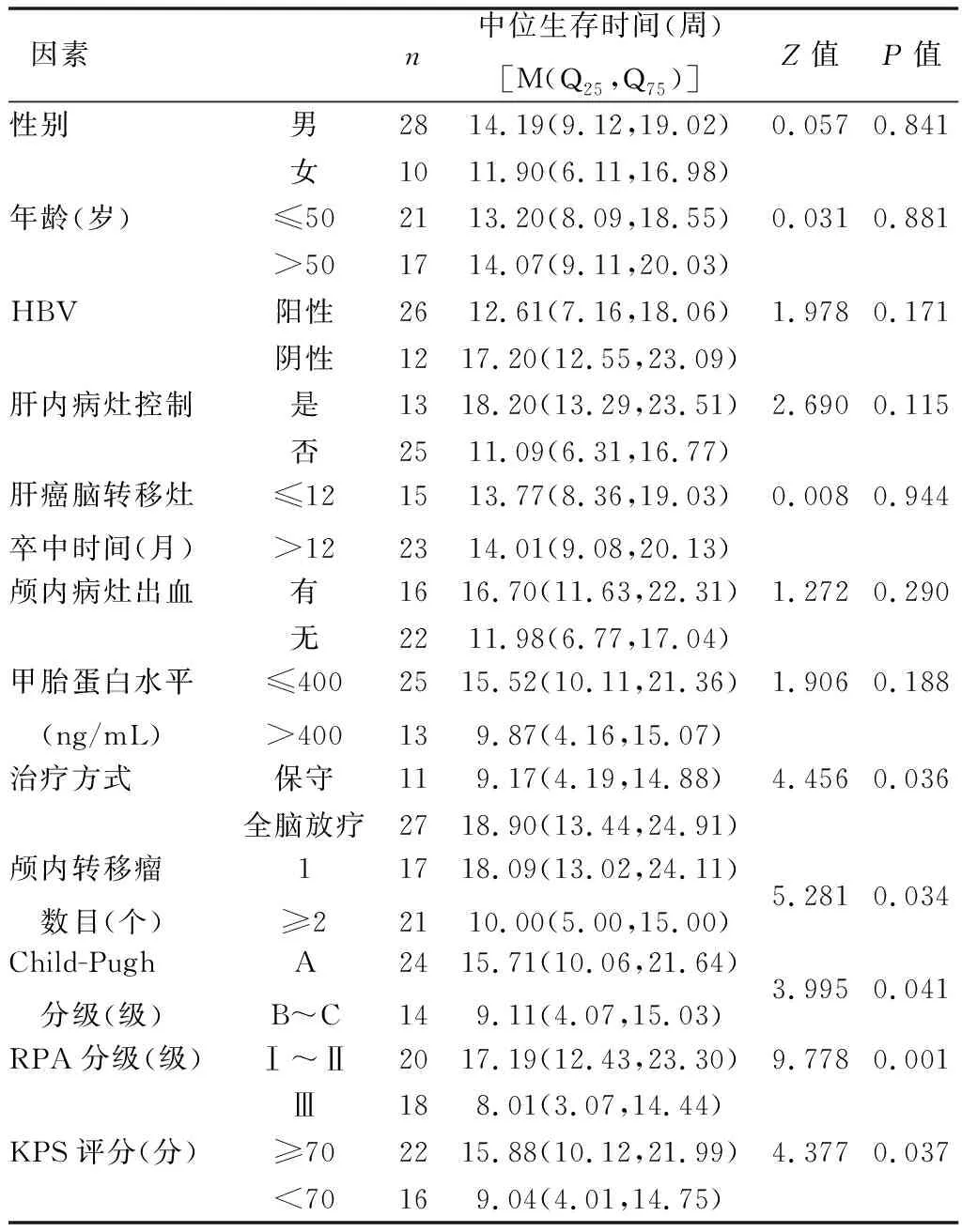
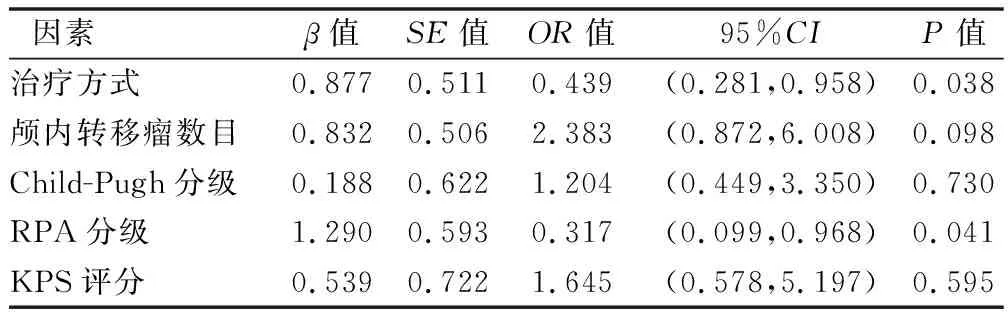
1.3 肝功能分级 采用Child-Pugh分级,预后指标为RPA(国际放射治疗肿瘤组针对脑转移瘤提出的独立递归分级指数)分级:RPAⅠ级为KPS(卡氏评分)≥70分、年龄小于65周岁、原发灶被控制(无转移病灶);Ⅱ级为30分 1.4 影像学检查 15例行CT检查:采用64排螺旋CT扫描仪(GE公司,Optima)进行常规平扫、增强扫描,层厚为7.5 mm。15例行MRI检查:采用磁共振扫描仪(Philips公司,Achieva 1.5 T高场超导型)以FSE脉冲序列及SE序列行T1WI、T2WI进行常规、矢、冠平扫、增强扫描。8例同时行CT+MRI检测。 1.5 治疗方法 确诊为肝癌脑转移瘤合并卒中后均给予患者止血、降低颅内压、抗感染等治疗。结合患者临床症状分为保守治疗21例、全脑放疗治疗17例,无1例接受手术治疗(原因:家属拒绝手术或已错失手术时机)。保守治疗仅给予对症治疗;全脑放疗治疗是应用剂量为36~40 Gy的6MV-X线分18~20次完成。 1.6 统计学方法 本研究数据采用SPSS 23.0统计学软件进行处理与分析,采用Kapian-Meier法进行生存分析,预后影响因素采用单因素及Cox多因素分析。差异有统计学意义用P<0.05表示。 2.1 病灶位置及形态特点 38例患者共38处病灶,均为单发。①病灶位置:小脑5例(13.16%),脑表面与灰白质交界区33例(86.84%);枕叶5例(13.16%),顶枕叶13例(34.21%),额叶9例(23.68%),颞顶部10例(26.32%),小脑蚓部1例(2.63%)。②病灶形态:有29处为类圆形病灶(76.32%),9处为不规则病灶(23.68%);直径均为1.56~10.34 cm,平均4.85 cm;在肿瘤周边出血病灶较多且大部分为不规则状。 2.2 CT、MRI影像学表现 38例患者CT平扫及增强扫描提示:颅内可见多处类圆形、高密度、边缘清楚的出血灶,部分内密度不均匀,大小约3.01 cm×5.00 cm。出血灶周围可见低密度水肿带,脑室轻度受压移位,中线结构轻度移位。MRI扫描病灶,在T1W1呈高低混杂信号且不均匀(在出血区T1W1呈高信号),T2W1呈高信号且不规则。MRI增强扫描出血灶与病灶坏死区并无强化现象,但肿瘤实性部分强化很明显,15例呈团块样强化,15例呈环状强化,8例呈“靶心样”强化。CT、MRI影像学结果显示,有16例患者肿瘤周围水肿带呈指样切迹,15例呈环状水肿,7例患者的肿瘤周围未见明显水肿;37例幕上病灶有明显占位效应,1例幕下病灶无占位效应。 2.3 患者生存情况 见图1。38例患者最终全部死亡,21例因肝内病灶未控制而死亡,17例因脑卒中未控制而死亡。肝癌脑转移瘤合并卒中患者的中位生存时间为10周,1个月、3个月、6个月患者生存率分为92.11%(35/38)、23.68%(9/38)、7.89%(3/38)。 图1 38例患者生存曲线图 2.4 影响患者预后因素 见表1,表2。单因素分析显示:治疗方式、颅内转移瘤数目、Child-Pugh分级、RPA分级、KPS评分与患者预后均呈相关性,P均<0.05。Cox多因素分析显示,治疗方式、RPA分级是影响预后的独立危险因素,P<0.05。 表1 预后影响因素的单因素分析 表2 预后影响因素的Cox多因素分析 3.1 影像学特点 据Kaal等[6]研究发现,肝癌脑转移瘤单发患者占脑转移瘤的1/3,本研究中38例均为单发病灶。本研究除1例病灶发生于幕下,其余均发生于幕上且多发生于皮层与皮髓质交界处。CT常规平扫可见高密度影,出血灶及水肿带在CT增强扫描时并不强化。MRI检查T1WI呈高低混杂信号,T2WI呈高信号。37例幕上病灶有明显占位效应,1例幕下病灶无占位效应,主要是因为小脑体积小,再加上两侧齿状核与蚓部的灰质块阻止了水肿带的延伸与浸润,因此不会出现小病灶、大水肿的现象,故占位效应不明显。同时注意与脑膜瘤、颅内动脉瘤出血、恶性胶质瘤等进行鉴别诊断[7]。 3.2 预后 单因素分析显示:治疗方式、颅内转移瘤数目、Child-Pugh分级、RPA分级、KPS评分与患者预后均呈相关性,Wang等[8]报道,Child-Pugh分级、KPS评分是肝癌脑转移瘤合并卒中患者预后的影响因素,但Cox多因素分析中Child-Pugh分级、KPS评分不是影响患者预后的因素,可能与本研究中均为单发病灶,而单发病灶患者的预后比多发病灶要好有关。临床证明RPA分级可作为其他恶性肿瘤脑转移的预后影响因素。本研究中RPAⅠ~Ⅱ级的患者中位生存时间为17.19周,RPAⅢ级的患者为8.01周,差异有统计学意义,提示RPAⅠ~Ⅱ级患者的预后要比RPAⅢ 级患者好[9-11]。与Jiang等[12]报道相一致。Cox多因素分析显示,治疗方式、RPA是影响患者预后的主要危险因素,提示对RPAⅠ~Ⅱ级患者进行积极治疗应具有较好的临床效果,可延长其生存期。 综上所述,在排除其他颅内出血性疾病的基础上,结合病史、“小病灶大水肿”的影像学特点、多合并肺、骨等转移及有出血病灶,并找到原发病灶等是诊断肝癌脑转移瘤合并卒中的要点。总体来讲,肝癌脑转移瘤合并卒中患者生存期短,预后很差,但针对RPA分级较低的患者可以进行全脑放疗治疗以延长其生存期。2 结果
3 讨论

