达比加群酯用于非瓣膜性房颤抗凝治疗的不良反应分析
张 静,余雄杰,李 园,王 鹏,陈锦华,黄年旭(武汉亚洲心脏病医院,湖北 武汉 430022)
非瓣膜性房颤(non-valvular atrial fibrillation,NVAF)是临床上最常见的心律失常类型,其发病率随着患者年龄的增长而增加[1]。血栓栓塞性并发症是房颤致死、致残的主要原因,选择合理的抗凝药物预防卒中和全身性栓塞是房颤治疗的基石。新型口服抗凝药物达比加群酯是继华法林后,首个被美国FDA批准用于NVAF抗凝治疗的药物,与传统华法林相比,其具有口服方便,食物、药物相互作用少,无需特殊用药监测等特点,为临床抗凝治疗提供了新的选择[2-3]。
达比加群酯于2013年4月在我国上市,随着在临床上的推广应用,国内外已陆续有其药品不良反应(adverse drug reaction,ADR)的相关报道,但多为个案病例,国内少见系统性的研究报道,我国人群对于达比加群酯安全性的循证医学证据还不足。本文通过对2015-2019年我院上报的达比加群酯ADR报告进行统计分析,旨在深入探讨患者使用达比加群酯的安全性,提高达比加群酯的临床合理用药水平。
1 资料与方法
1.1 资料
从2015年2月- 2019年12月我院上报至全国不良反应监测网络的ADR病例报告中,检索得到怀疑药品为达比加群酯的ADR病例报告共计19份,汇总分析19例使用达比加群酯患者的用药情况,ADR发生以及转归情况。
1.2 方法
采用回顾性的研究方法,对19例病例报告相关信息进行提取。将检索内容按患者信息(性别、年龄、原患疾病、既往病史),用药信息(用药疗程、用药剂量、用药目的、合并用药)及ADR情况(发生时间、名称、表现、程度、处理、结果)进行分类统计,分析ADR的发生与患者性别、年龄的关系,既往病史、合并用药对ADR的影响,ADR潜伏期、累及系统/器官及临床症状,严重程度,结果及转归等。
2 结果
2.1 性别和年龄分布
19例达比加群酯ADR病例报告中,男性7例,女性12例,男女比例为1∶1.7,差异无统计学意义(P> 0.05);年龄最小43岁,最大82岁,平均年龄(66.3±9.3)岁,详见表1。

表1 发生ADR患者的年龄和性别分布Tab 1 Distribution of gender and age of patients
2.2 合并基础疾病和联合用药情况
达比加群酯致ADR的19例患者中,全部为我院NVAF患者,同时合并其他基础疾病的有16例。主要合并的基础疾病有高血压、冠心病、陈旧性脑梗、冠状动脉肌桥、2型糖尿病、高脂血症、甲亢等。其中16例患者联用抗高血压药(培哚普利、贝那普利、缬沙坦、厄贝沙坦、美托洛尔、氨氯地平、硝苯地平等),12例联用抗心律失常药物(胺碘酮、地尔硫卓),9例联用调血脂药(阿托伐他汀、瑞舒伐他汀等),7例联用胃酸分泌抑制剂(埃索美拉唑、雷尼替丁),3例联用抗血小板药物(阿司匹林、硫酸氢氯吡格雷),2例联用降糖药物(二甲双胍、维格列汀)和其他药物(如左甲状腺素、曲美他嗪等)。
2.3 ADR发生的时间分布
19例患者中发生ADR的最短时间为用药后2 h即出现全身发热出汗、腹痛等症状;最长时间为用药半年后出现消化道出血症状。发生ADR的时间主要集中在用药后1个月内(17例,89.48%),详见表2。
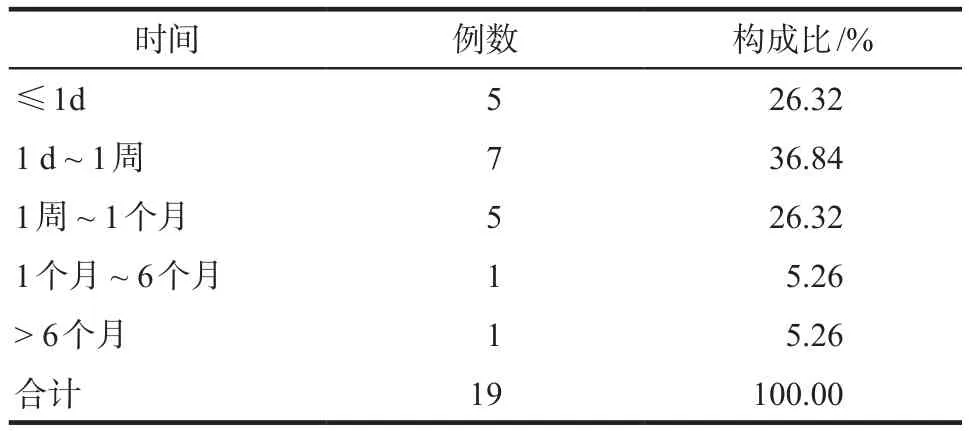
表2 ADR发生的时间分布Tab 2 The time distribution of ADR
2.4 ADR累及的系统/器官及主要临床表现
同一患者服用药物后可能会发生多种ADR,即ADR例次>患者例数,本次回顾性分析发现,我院19例患者服用达比加群酯后共出现24例次ADR,详见表3。ADR主要累及消化系统(9例次,37.50%)、泌尿系统(3例次,12.50%)及全身系统(3例次,12.50%)。临床表现以出血最为常见,包括消化道出血、尿血、咯血、结膜出血,共计12例次(50.00%)。
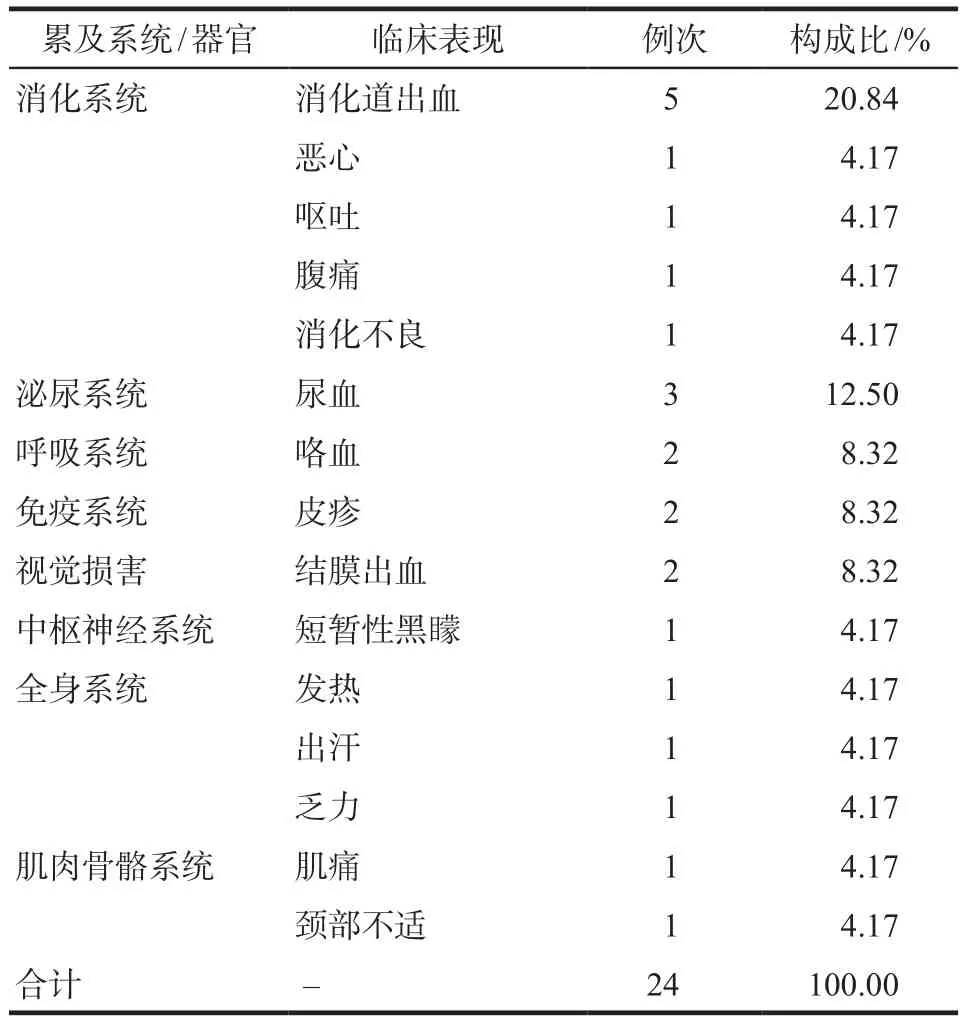
表3 ADR累及的系统/器官及临床表现Tab 3 Systems/organs and clinical manifestations involved in ADR
2.5 ADR报告类型及关联性评价
按照关联性评价标准对19例患者服用达比加群酯所致ADR进行分析评价,其中2例患者服用达比加群酯后分别出现全身发热出汗及短暂性黑矇的临床表现,停药后症状明显好转,ADR的发生与用药时间密切相关,但所致的临床表现尚未有相关文献资料证明,与该药已知的不良反应类型不符合,关联性评价为“待评价”,报告类型为“新的ADR”。另外2例患者服用达比加群酯所致的ADR症状不排除有其合用药物的相关因素影响,因此关联性评价为“可能”。其余15例患者用药与ADR发生时间顺序合理,停药以后症状停止、减轻或好转,与该药已知的不良反应类型相符,同时已排除原患疾病等其他因素影响,其中3例患者ADR再激发试验阳性,关联性评价为“肯定”,其余12例判定为“很可能”,ADR报告类型均为“一般的ADR”。
2.6 ADR结果及转归
本文所调查的ADR中,包括12例次出血,未发现主要致命/危及生命出血,有1例次为次要出血(需要医学干预止血或治疗的出血事件)及11例次轻微出血(无需干预或治疗的出血事件),以消化道出血最为常见(41.70%),其他包括咯血、血尿以及眼部结膜出血。其中1例次要出血表现为胃肠道出血伴血红蛋白降低42 g·L-1,临床采取立即停药处理,并予以止血、抑酸等对症治疗,数天后症状好转。其余ADR通过减少剂量或停药处理后症状均好转。部分患者恢复后经本人同意更换抗凝用药,如华法林、利伐沙班等。
3 讨论
达比加群酯属于非肽类凝血酶抑制剂。2019年美国房颤指南针对卒中预防指出以达比加群酯为代表的四种新型口服抗凝药(new oral anticoagulants,NOACs)被推荐作为替代华法林的首选药物。除了中度至重度二尖瓣狭窄或植入机械心脏瓣膜者,均建议NOACs优先于华法林[4]。但由于该药在国内上市年限较短,对其发生的ADR了解较为有限,该药说明书中所提及的ADR数据主要来自于RE-LY临床试验结果[5]。因此,积极收集达比加群酯在国内患者中所发生的ADR数据并及时更新ADR相关信息对临床尽早发现和处理具有重要的意义。
3.1 ADR与患者因素
通过统计分析发现,发生ADR的19例患者中男性占比36.84%,女性占比63.16%,女性多于男性,可能由于部分老年女性患者体质量偏小,这是出血的一个危险因素。同时60岁以上的患者有14例(73.68%),属该药ADR的高发人群。因高龄是NVAF的高危因素也是房颤患者发生卒中的独立危险因素之一[6],体重降低、肾功能减退、合并用药增加以及各种并发症的出现,均导致老年患者较年轻人群更易发生ADR。由此提示针对该年龄段患者,在使用达比加群酯时应从小剂量开始,治疗过程中需对其开展严密的药学监护。
3.2 引起ADR的药物相互作用
19例患者中,同时合并其他基础疾病的有16例,其中有3例联用抗血栓药物,均发生不同程度的出血事件(2例咯血、1例胃肠道出血)。从RE-LY临床试验收集的房颤患者数据观察到,无论达比加群酯还是华法林,联用抗血小板药物阿司匹林或氯吡格雷均可导致大出血发生率加倍[7]。除此之外,NVAF患者接受该药抗凝治疗时,常与抗心律失常药胺碘酮、维拉帕米联用,本次病例中有3例患者联用胺碘酮,其中2例发生出血症状,1例出现皮疹。因达比加群酯是外流转运体P-糖蛋白(P-gp)的底物,胺碘酮作为强效P-gp抑制剂,两者联用会使前者AUC和Cmax分别增高约60%和50%[8];同时鉴于胺碘酮半衰期(t1/2)较长,在其停药后数周仍存在药物相互作用的可能性。因此,建议临床在使用达比加群酯时,应尽量避免合用可使其血药浓度增高的药物,如强效P-gp抑制剂(胺碘酮、维拉帕米、奎尼丁、酮康唑等),同时也需避免联用因相互作用而增加出血风险的药物,如抗血栓、非甾体抗炎药物等。当进行风险获益评估后继续选择联用时,建议进行密切的临床监测。
3.3 ADR发生与时间因素
由表3可知,在接受治疗初始24 h内发生ADR患者共计5例(26.32%);1个月内共计17例(89.48%)。提示患者在服药后1个月内应重点监测身体出现的任何不适反应,尤其针对老年、肾功能不全及合并用药患者,需严格随访,减少ADR发生的风险。
3.4 ADR累及的系统/器官
19例ADR中,消化系统ADR发生率最高(37.50%),与2014年亚洲一项大型回顾性队列研究结果一致[9]。消化系统损害中最严重的是出血,最常见的是消化道异常,如服药后恶心、呕吐、腹痛、消化不良。导致其消化不良的原因可能是由于达比加群酯是一种包含有酒石酸微丸的口服制剂,微丸溶解后产生的酸性微环境有利于药物在肠道中吸收,但该环境对胃部具有刺激作用,进而导致消化系统不适[10]。RE-LY研究发现达比加群酯治疗组所报道的消化不良症状常为暂时性,且程度较轻[11]。服药过程中可通过以下方式减轻消化道症状:如加水服用(200~300 mL)、或与食物同时服用从而延缓血药浓度上升等。
达比加群酯致皮疹2例,出现的时间为首次服用达比加群酯48 h内,药疹累及部位为躯干及四肢等,在患者停药并给予抗过敏对症治疗后,药疹均可逐渐消退。然而达比加群酯引起皮肤过敏反应的机制尚不清楚,可能与其结构为芳香胺有关[12]。本次回顾性分析中发现达比加群酯还可能引起发热、乏力、短暂性黑矇及颈部不适等,虽然发生率较低或尚未见相关报道,但也需引起医务人员的关注,在治疗过程中加强用药监测及患者教育。
3.5 达比加群酯致出血原因分析及应对措施
作为抗凝药物,达比加群酯在治疗过程中具有治疗指数窄的特性,当血药浓度过高时,必然存在出血的风险。本次调查的ADR病例中,出血共计12例次(50.00%)。FDA指出当达比加群血药浓度控制在40 ~200 ng·mL-1时,临床治疗可能更为有效且安全[13]。根据研究报道显示达比加群的血药浓度主要受肌酐清除率(CrCl)、年龄、体重及性别影响[7]。由于该药80%都以药物原型经肾脏排泄,健康个体的达比加群t1/2约为12~17 h,中度肾功能损害患者(CrCl 30~ 50 mL·min-1)延长至13~23 h,重度肾功能损害患者(CrCl < 30 mL·min-1)服用该药后t1/2是正常患者的2倍,AUC为正常患者的6倍,t1/2延长导致体内血药浓度升高,成为出血不良反应的重要因素[14],因此在国内说明书中明确指出禁用于CrCl < 30 mL·min-1的患者。12例发生出血的ADR中,有6例患者均存在不同程度的肾功能损害,提示在开始服用该药时,需通过CrCl对肾功能进行评估,并以此排除重度肾功能损害的患者。治疗过程中,应密切监测患者肾功能情况[15]。
本次ADR病例中未发现致命/危及生命出血,有1例次要出血及11例轻微出血,通过减少剂量或停药处理后症状均得到好转或痊愈。因达比加群酯t1/2较短(12~14 h),一旦发生出血,在非急症情况下可暂停用药2~4 d以逆转其药理作用,随着药物从体内清除,出血可自发停止[16]。同时根据患者具体情况可采取以下针对性的处理措施[17]:1)在末次服药2 h内,可考虑口服活性炭减少达比加群酯的进一步吸收;2)由于达比加群主要经肾脏排泄,需维持适度利尿;3)给予止血对症治疗,如物理压迫止血、补液和血管活性药物治疗、外科手术止血及血液制品输注;4)因达比加群血浆蛋白结合率较低(约为35%),血液透析可加速其从体内清除;5)如出现严重、危及生命的出血,需及时补充凝血酶或凝血因子;除上述措施外,也可考虑直接使用逆转剂Idarucizumab 5 g,分2次静脉输注,间隔不超过15 min[18]。Idarucizumab作为全球首个NOACs的特异性逆转剂,2019年3月获得CFDA批准正式在国内上市,对于口服达比加群酯时需要紧急手术或出现威胁生命的出血的患者,推荐其作为一线用药以逆转达比加群酯的抗凝作用[19]。
达比加群酯虽不需要常规抗凝监测,但通过凝血检查有助于发现因其暴露量增加而导致出血风险增加的患者。实验室可利用经过验证的活化部分凝血活酶时间(APTT)作为快速识别过度抗凝和出血风险的初筛手段[20]。当该药应用于特殊人群(如高龄老年患者、肾功能不全患者、合并用药患者)时,可将血药浓度谷值时APTT升高不超过2倍正常值上限作为安全性指标之一[21]。
3.6 ADR与剂量因素
值得注意的是,本次调查的19例ADR中,所有患者使用的药物剂量均为110 mg,bid,po,未发现使用150 mg剂量者,这可能与该药进入临床应用时间较短,国内相关大样本安全性研究数据较少,使用该药治疗的患者年龄普遍偏大有关。同时多项研究[22-23]提示与西方人群相比,亚裔人群出血尤其是颅内出血风险更高。达比加群酯消化道出血事件的发生呈剂量相关性,用药剂量150 mg·次-1者出血风险明显高于110 mg·次-1者。因此临床选用110 mg剂量降低出血风险保证用药安全。
综上,达比加群酯在我院使用期间未出现严重ADR,经对症处理后临床症状均好转或治愈,安全性较高,为临床房颤抗凝治疗提供了新的选择。但由于本研究样本量较小,其在国内应用的临床经验仍需进一步积累。随着该药临床应用的日益普及,在多种临床复杂状态时(如高龄、合并多种疾病或危重症患者),有针对性地进行药物浓度和抗凝效果监测有利于提高治疗的安全性和改善预后。

