E3泛素连接酶TRIM50促进口腔鳞状细胞癌增殖及迁移侵袭的分子机制研究
刘 琛,赵许兵,程 政,马志军
(1西安交通大学口腔医学院口腔综合科,西安 710004;2西安市第九医院口腔科;*通讯作者,E-mail:Maazhijun@126.com)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是最常见的口腔颌面部恶性肿瘤,在口腔癌中占比90%,其发病率在全身肿瘤中排名第八[1]。尽管针对OSCC的放化疗以及手术治疗在不断进步,但是患者的总生存率并没有因此而得到明显的提高[2,3]。因此,寻找可靠的生物标志物和新的分子靶点对为OSCC患者制定并实施精准的个性化的治疗方案至关重要[4]。
泛素化是泛素与目标蛋白赖氨酸残基发生共价结合使其降解的生物学过程,此过程由3种酶完成,泛素激活酶(E1)、泛素偶联酶(E2)和泛素连接酶(E3),每一种酶都由一组蛋白组成[5]。其中E3连接酶是泛素级联的关键组成部分,通过直接与各种底物相互作用,在泛素化途径中发挥特殊作用[6,7]。目前,根据泛素蛋白酶体系统(ubiquitin proteasome system,UPS)的组成成分进而开发靶标药物是肿瘤研究中的一个热点,受到越来越多的关注[8]。TRIM(tripartite motif containing protein)蛋白家族近年来因其特有的结构(3个保守的结构域)和广泛参与各种生物学途径而备受关注[9]。越来越多的证据表明部分TRIM家族成员作为E3泛素连接酶介导泛素化降解途径靶向调控癌相关基因,在癌症发展的过程中起到关键作用[10]。
TRIM50作为TRIM蛋白家族新成员,参与调控神经系统的发育以及胃消化腺的分泌等过程[11,12]。但其在肿瘤方面的相关报道甚少,特别是在口腔癌中并没有报道。本研究旨在探究E3泛素连接酶TRIM50对OSCC生物学功能的影响,并初步探究TRIM50蛋白表达对OSCC细胞恶性表型调控的潜在机制,为明晰OSCC发病机制以及发展分子靶向治疗提供理论基础。
1 材料与方法
1.1 主要试剂

1.2 实验方法
1.2.1 细胞培养 OSCC细胞系SCC9、SCC25以及Cal27购于美国菌种保藏中心,HOK和HSC3细胞购于广州赛库生物公司。细胞完全培养基按DMEM培养基 ∶胎牛血清 ∶青链霉素=90 ∶9 ∶1的体积比例配制,细胞培养瓶放置在37 ℃、体积分数为5% CO2的恒温培养箱中培养。当OSCC细胞生长至密度为约80%时,用0.25%的胰蛋白酶消化并传代,收集生长状态良好的细胞进行后续的细胞转染、细胞增殖、克隆形成以及迁移侵袭等实验。
1.2.2 过表达载体构建 过表达目的蛋白的载体为pcDNA3.1(+),由CMV启动子驱动目的基因的表达。TRIM50-Flag cDNA克隆的上游引物序列为5′-GCGAAGCTTATGGCTTGGCAGGTGAGCCTG-3′,其5′端包含了保护碱基GCG以及HindⅢ限制性内切酶的酶切位点;其下游引物序列为5′-CGGGATCCCTTGTCATCGTCGTCCTTGTAGTCCAGCTTG-GTGGGCTGCTCGG-3′,其5′端包含了BamHⅠ限制性内切酶的酶切位点。Rb-HA cDNA克隆的上游引物序列为5′-GCGAAGCTTGCGGAAAGGCGTCA-TGCCGCC-3′,下游引物的序列为5′-CGGGATCCAGCGTAATCTGGAACATCGTATGGGTATTTC TCTTCCTTGTTTGAGGTATCC-3′。其上游及下游引物的5′端分别包含HindⅢ以及BamHⅠ酶切位点。Ub-Flag cDNA克隆上游引物序列为5′-GCGAAGC-TTATGCAGATCTTCGTGAAAACCC-3′,下游引物序列为5′-CGGGATCCCTTGTCATCGTCG TCCTTGTAGTCGCCACCCCTCAGGCGCAGG-3′。全长cDNA克隆PCR的反应条件为:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸按每个千道尔顿1 min进行,循环33次。
1.2.3 细胞转染 按1×105的数量将OSCC细胞接种于6孔板中。待细胞融合至密度约为60%时,按照LipofectamineTM2000试剂盒说明书,转染TRIM50 siRNAs以及上述过表达载体和空白载体pcDNA3.1(+)至OSCC细胞。转染6 h后,更换新鲜培养基并继续培养48 h,收集目的细胞用于后续实验。本实验所用干扰片段均由吉玛基因公司(上海)设计并合成,具体序列见表1。

表1 干扰片段序列
1.2.4 采用蛋白质免疫印迹法检测TRIM50和Rb蛋白表达量 收集转染后的各组OSCC细胞,加入RIPA裂解液,置于冰上充分裂解30 min以提取细胞的总蛋白。用BCA蛋白试剂盒测定各组蛋白浓度后,取适量蛋白溶液,95 ℃加热15 min使蛋白质变性。每泳道上样20 μg蛋白,之后进行十二烷基硫酸钠-聚丙烯酰胺凝胶(dodecyl sulfate sodium salt-polyacrylamide gel electrophoresis,SDS-PAGE)电泳(100 V,90 min),将分离的蛋白通过半干转法(100 V,45 min)转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),转膜后置于5%脱脂奶粉溶液中封闭2 h,再分别加入抗TRIM50(ab272586,abcam,1 ∶1 000)、β-actin(BS6007M,Bioworld,1 ∶5 000)、Rb(ab24,abcam,1 ∶1 000)、Flag(M185-3L,MBL,1 ∶2 500)和HA(M180-3S,MBL,1 ∶2 000)抗体,4 ℃孵育过夜。加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗(1 ∶1 000),37 ℃下孵育1 h。洗膜后,滴加增强化学发光液进行避光显影。
1.2.5 采用逆转录聚合酶链反应法检测TRIM50和Rb基因表达量 使用TRIzol裂解液裂解实验细胞并提取总RNA,然后通过逆转录试剂盒将RNA逆转录为cDNA。再以cDNA为模板,通过聚合酶链式反应(polymerase chain reaction,PCR)试剂盒进行PCR扩增。TRIM50上游引物:5′-CGCCAAACTGGTGAACAAC-3′;下游引物:5′-TGGTCCTCATTGCCGAAC-3′。Rb上游引物:5′-AGTTCGCTTGTATTACCG-3′;下游引物:5′-ATTTCAATGGCTTCTGG-3′。内参基因GAPDH上游引物:5′-CAA-GGTCATCCATGACAACTTTG-3′;下游引物:5′-GT-CCACCACCCTGTTGCTGTAG-3′。扩增结束后,进行琼脂糖凝胶电泳。
1.2.6 采用细胞计数法检测细胞增殖能力 用靶向TRIM50的siRNAs或过表达质粒转染OSCC细胞(1×104)48 h后,将各组细胞接种于24孔培养板中培养。分别在细胞培养24,48,72,96,120 h后进行细胞计数,每次实验重复3次,统计各组的细胞数,并绘制细胞生长曲线图。
1.2.7 采用细胞克隆集落形成法检测细胞克隆形成能力 同样将所示的质粒或siRNAs转染至OSCC细胞48 h后,将其置于6孔培养板中,用含10%胎牛血清的DMEM培养基培养14 d。之后用无水甲醇固定细胞,然后用结晶紫溶液染色。在显微镜下统计≥30 μm的细胞集落数,每次实验重复3次。
1.2.8 采用Transwell法检测细胞迁移侵袭能力 Transwell小室实验用于体外细胞迁移和侵袭的测定,用siRNAs或是质粒转染OSCC细胞。之后,将无血清培养基重悬1×104转染后的细胞并接种到上室进行细胞迁移测定。对细胞侵袭的测定,我们在上室覆盖基质胶再接种相应数量的转染细胞。迁移和侵袭后的细胞用无水甲醇固定,通过5%结晶紫溶液染色。在显微镜下从每个下室膜中采集图像,统计发生迁移侵袭的细胞数量。
1.2.9 采用免疫共沉淀法验证TRIM50蛋白与Rb蛋白的相互作用 将TRIM50-Flag和Rb-HA过表达质粒转染至HSC3细胞48 h,再用10 μmol/L MG132处理细胞6 h,然后使用抗Flag或HA抗体孵育转染细胞的蛋白裂解液,4 ℃过夜,使其充分与目的蛋白结合,免疫复合物用蛋白A/G琼脂糖珠进行捕获,之后再通过SDS-PAGE电泳分离。然后对电泳后PAGE凝胶进行银染质谱分析,或者通过蛋白质免疫印迹法检测免疫共沉淀复合物中的蛋白。
1.2.10 采用放线菌酮实验检测Rb蛋白降解半衰期的变化 将TRIM50-Flag过表达质粒转染至HSC3细胞,并设置空载组作为对照,转染48 h后,提取细胞蛋白记为0 h,然后在培养基中加入20 μg/ml CHX,分别在加入2,4,6,8 h后提取细胞蛋白。之后,通过蛋白质免疫印迹法检测CHX处理后的细胞内蛋白降解的情况。
1.2.11 采用体外泛素化实验检测Rb蛋白的泛素化水平 将TRIM50-Flag、Rb-HA以及Ub-Flag过表达质粒共转染HSC3细胞48 h,MG132(10 μmol/L)处理6 h,使用抗HA抗体免疫沉淀Rb-HA蛋白免疫复合物,通过蛋白质免疫印迹法检测Rb-HA蛋白的泛素化水平。
1.3 统计学方法
采用SPSS 18统计学软件处理分析实验数据,实验结果通过GraphPad Prism 5绘图。所有实验均独立重复至少3次,两组数据采用独立样本t检验,多组间比较采用方差分析,两两比较采用LSD-t检验。当P<0.05时,视为差异有统计学意义。
2 结果
2.1 TRIM50蛋白在不同的OSCC细胞系中的表达量
蛋白质印迹结果显示,TRIM50蛋白的表达水平在SCC9和SCC25细胞中较低,在Cal27与HOK细胞中较高(见图1)。

图1 TRIM50蛋白在不同OSCC细胞系中的表达
2.2 过表达TRIM50促进OSCC细胞增殖能力
蛋白质印迹结果显示,TRIM50-Flag-pcDNA3.1(+)转染的SCC9以及SCC25细胞后成功过表达TRIM50蛋白(见图2A)。与空白对照组相比,过表达TRIM50组OSCC细胞增殖活力明显增强,差异具有统计学意义(P<0.01,见图2B)。

图2 过表达TRIM50对OSCC细胞的增殖能力的调控作用
2.3 过表达TRIM50促进OSCC细胞克隆形成能力
与空白对照组相比,过表达TRIM50组OSCC细胞的克隆形成集落数明显增多,差异具有统计学意义(P<0.05,见图3)。
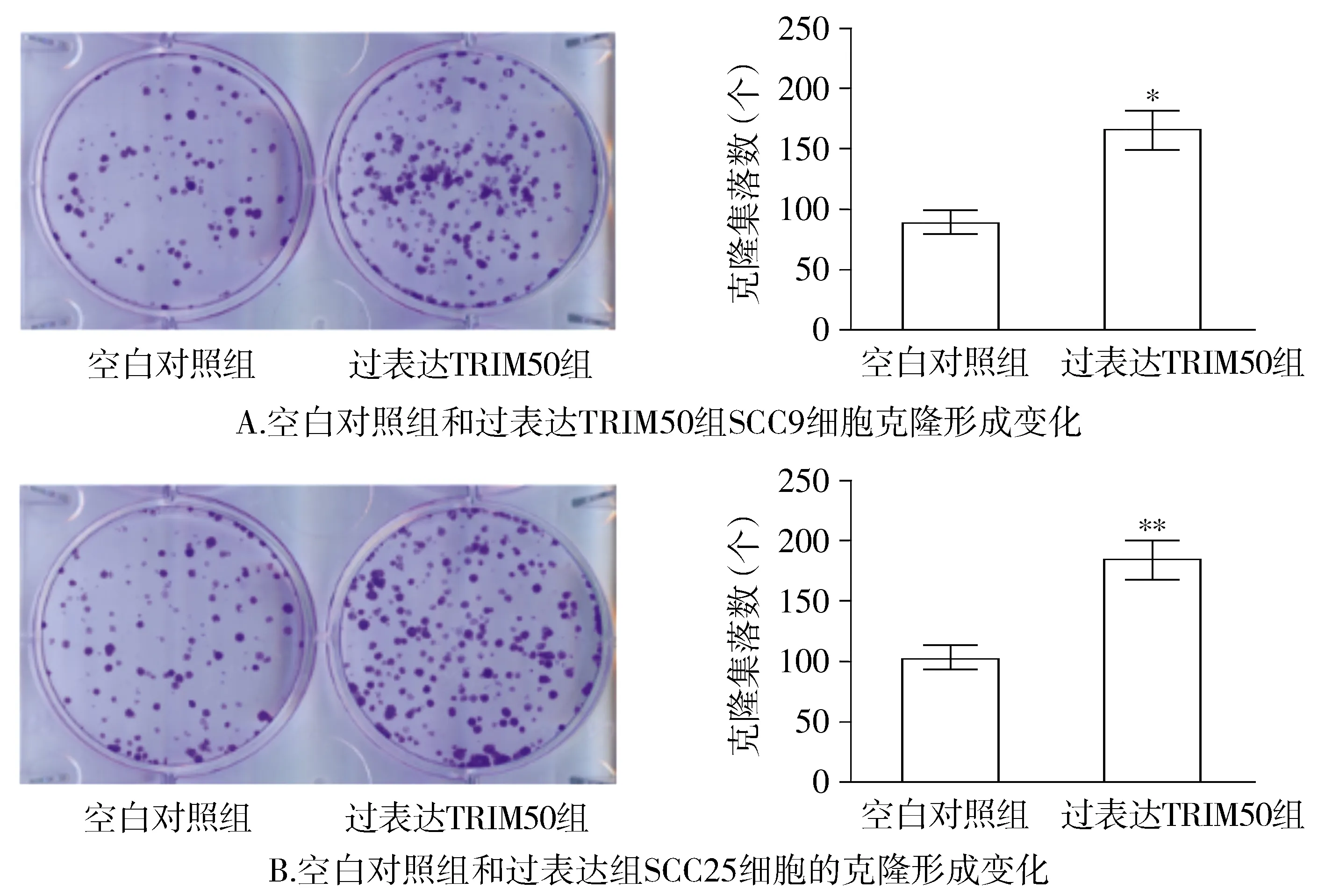
与空白对照组比较,*P<0.05,**P<0.01
2.4 过表达TRIM50促进OSCC细胞迁移侵袭能力
与空白对照组相比,过表达TRIM50组的OSCC细胞迁移侵袭的数量显著升高(P<0.01,见图4)。

与空白对照组比较,*P<0.05,**P<0.01
2.5 沉默TRIM50抑制OSCC细胞增殖能力
蛋白质印迹结果显示,TRIM50 siRNA干扰片段转染后的Cal27以及HOK细胞成功下调TRIM50蛋白的表达(见图5A)。与阴性对照组相比,沉默TRIM50组OSCC细胞的生长能力显著受到抑制(P<0.01,见图5B)。
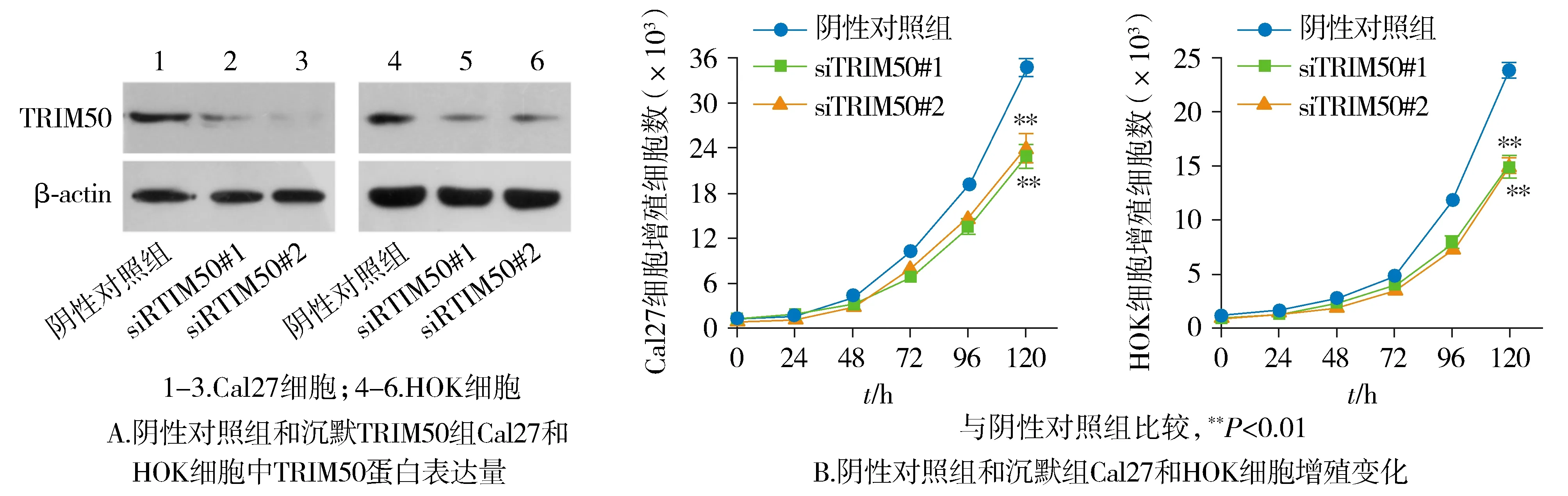
图5 TRIM50沉默对OSCC细胞的增殖能力的影响
2.6 沉默TRIM50抑制OSCC细胞克隆形成能力
与阴性对照组相比,沉默TRIM50组OSCC细胞克隆形成能力显著下调(P<0.01,见图6)。

与阴性对照组比较,**P<0.01
2.7 沉默TRIM50抑制OSCC细胞迁移侵袭能力
与阴性对照组相比,沉默TRIM50组OSCC细胞迁移侵袭的能力受到显著抑制(P<0.01,见图7)。
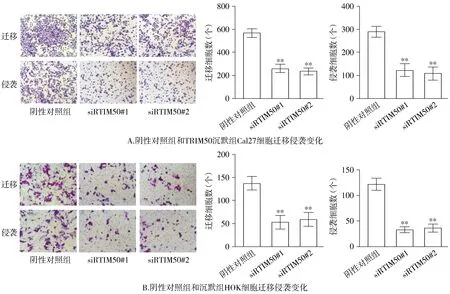
与阴性对照组比较,**P<0.01
2.8 TRIM50与抑癌蛋白Rb相互作用
根据TRIM50蛋白免疫免疫共沉淀蛋白印迹法结果显示,与空白对照组相比,过表达TRIM50组的Rb蛋白存在于TRIM50蛋白复合物中(见图8A),过表达Rb组的TRIM50蛋白也存在于Rb蛋白复合物中(见图8B),二者共沉淀。

图8 TRIM50蛋白与抑癌蛋白Rb相互作用
2.9 TRIM50抑制Rb蛋白的表达
蛋白质印迹以及逆转录PCR结果显示,与空白对照组相比,过表达TRIM50组Rb蛋白的表达水平下调,Rb mRNA的表达水平没有变化(见图9A)。与阴性对照组相比,而沉默TRIM50组Rb蛋白的表达量上调,Rb mRNA的表达没有变化(见图9B)。
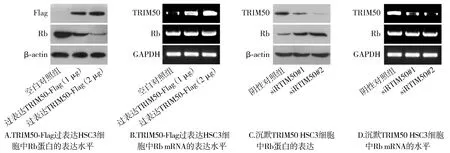
图9 TRIM50对Rb表达水平的调控
2.10 TRIM50促进Rb的泛素化降解从而下调Rb蛋白的表达
相比于空白对照,TRIM50过表达缩短了Rb蛋白降解的半衰期(P<0.05,见图10A,B)。泛素化实验结果显示,在蛋白酶体抑制剂MG132存在时,相比于空白对照组,TRIM50过表达组Rb多聚泛素化水平增多(见图10C)。
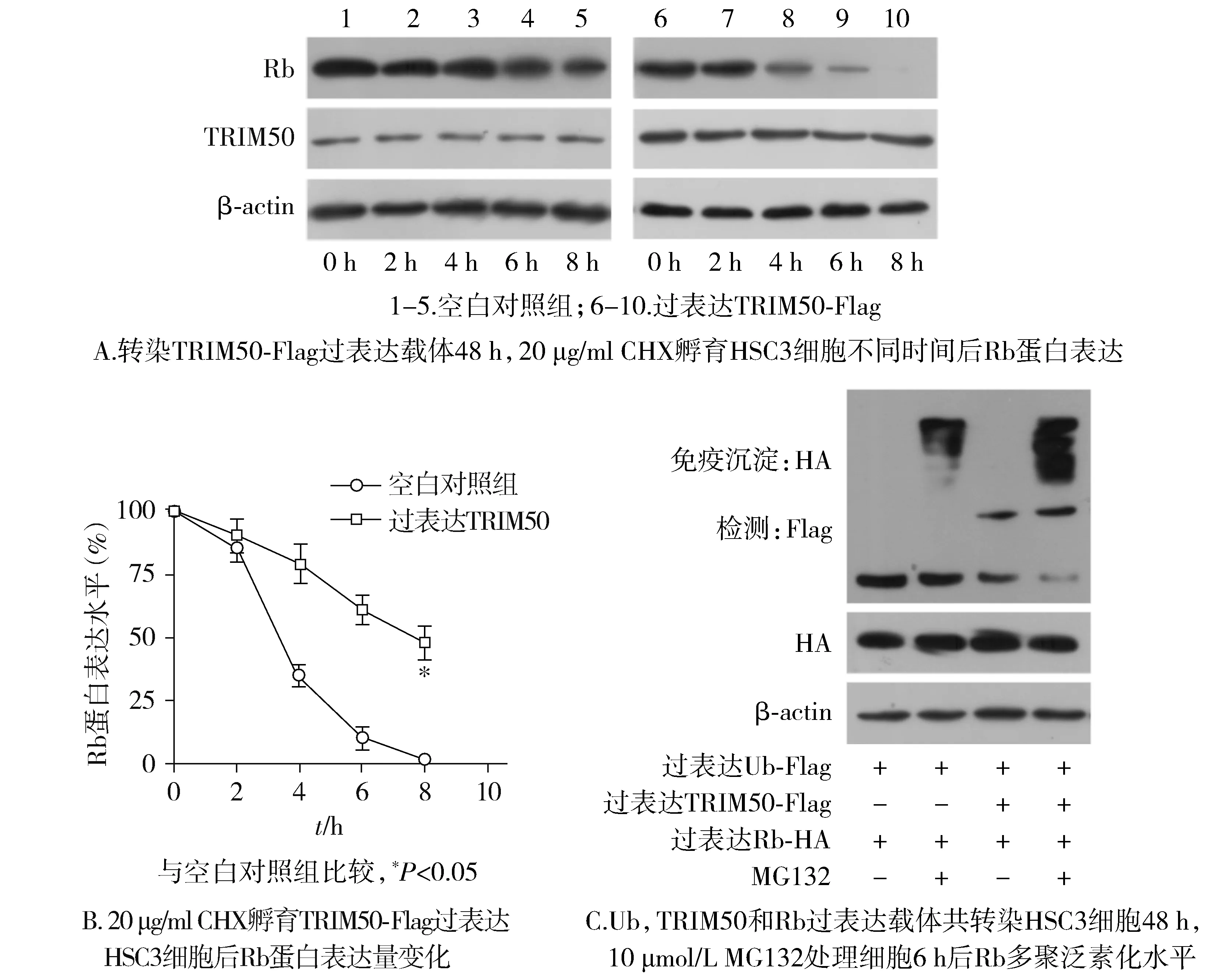
图10 过表达TRIM50对Rb半衰期以及泛素化水平的影响
2.11 TRIM50表达逆转Rb过表达对HSC3细胞增殖的抑制作用
蛋白质印迹结果显示,TRIM50-Flag-pcDNA3.1(+)和Rb-HA-pcDNA3.1(+)共转染的HSC细胞成功过表达Rb和TRIM50蛋白(见图11A)。细胞生长实验结果显示,相比于Rb过表达组,TRIM50与Rb共过表达组HSC细胞增殖能力增强(P<0.01,见图11B),但相比于空白对照组,TRIM50与Rb共过表达组HSC细胞增殖能力没有变化(P>0.05,见图11B)。

图11 TRIM50表达逆转Rb过表达对HSC3细胞增殖的抑制作用
2.12 TRIM50过表达逆转Rb过表达对HSC3细胞克隆形成的抑制作用
细胞克隆形成实验结果显示,相比于Rb过表达组,TRIM50与Rb共过表达组的HSC3细胞克隆形成能力增强(P<0.01,见图12);但相比于空白对照组,TRIM50与Rb共过表达组HSC3细胞克隆形成能力没有明显变化(P>0.05,见图12)。

图12 TRIM50过表达逆转Rb过表达对HSC3细胞克隆形成的抑制作用
2.13 TRIM50过表达逆转Rb过表达对HSC3细胞迁移侵袭的抑制作用
细胞迁移侵袭实验结果显示,相比于Rb过表达组,TRIM50与Rb共过表达组HSC3细胞迁移侵袭能力增强,差异具有统计学意义(P<0.01,见图13);但相比于空白对照组,TRIM50与Rb共过表达组HSC3细胞迁移侵袭能力没有变化(P>0.05,见图13)。

与其余三组比较,**P<0.01
3 讨论
根据肿瘤统计数据显示,OSCC是头颈部最常见的肿瘤之一,全球每年有超过30万的新确诊患者[13,14]。由于OSCC具有高侵袭性转移生物学行为,即使是早期癌也容易出现淋巴结转移,致死率较高[15]。同时,患者术后常有复发,预后不尽人意,其5年生存率基本保持不变[3]。因此,寻找新的关键靶点分子对OSCC治疗具有重要意义。UPS负责降解细胞中80%-90%的已知蛋白[16,17]。人类UPS的特异性主要由大约617个E3泛素连接酶决定,参与细胞周期调控和肿瘤发生的一些蛋白(如p53、p27和cyclins)被E3连接酶酶特异性调控[18-20]。由此可见,E3泛素连接酶肿瘤发生发展中的发挥着重要作用。
TRIM50最初在Williams-Beuren综合征中被鉴定为E3泛素连接酶[12]。另有报道表明,TRIM50与SNAIL相互作用,参与调控其降解抑制肝癌的发生发展[21]。到目前为止,有关TRIM50功能的报道非常有限,其生物学功能也远未阐明。TRIM50在癌变中的作用并不是很明确,尤其是在OSCC中,鉴于E3连接酶在疾病中的活性,我们预计它可能参与调控OSCC的发展。在本研究中,我们在OSCC细胞中进行TRIM50过表达,并检测细胞增殖、克隆形成、迁移侵袭等功能的变化。结果发现,过表达TRIM50能够增强OSCC细胞的增殖、克隆形成以及迁移侵袭能力。另外,TRIM50沉默后相关的功能实验结果显示,沉默TRIM50抑制了OSCC细胞的增殖、克隆形成以及迁移侵袭能力。因此,综合TRIM50过表达和沉默两方面的功能实验结果表明,E3泛素化连接酶TRIM50在OSCC恶性表型维持中呈现出正向调控的功能,我们首次证明了TRIM50作为一个促癌基因调控OSCC的发生发展。
为了深入研究TRIM50促进OSCC细胞增殖和转移的分子机制,我们通过免疫共沉淀和质谱分析的方法来鉴定与其相互作用的蛋白,以发现E3连接酶TRIM50作用的底物。根据质谱分析的结果,我们通过免疫共沉淀蛋白印迹法证实,TRIM50蛋白与Rb蛋白相互作用,说明Rb蛋白可能是E3连接酶TRIM50的潜在底物。众所周知,视网膜母细胞瘤肿瘤抑制蛋白Rb是细胞生长周期和的关键调节因子,调控相关基因的转录和表达从而导致细胞周期在G1期停滞[22]。为了进一步明确TRIM50与Rb的关系,我们探究了TRIM50的表达对Rb mRNA、蛋白表达水平的影响。结果发现,TRIM50负向调控Rb蛋白的表达量却不影响其mRNA的表达水平,说明TRIM50在转录后水平负向调控Rb蛋白的表达。因为TRIM50是E3泛素连接酶,因此我们推测TRIM50可能是通过促进了Rb的泛素化降解从而抑制OSCC细胞中的Rb蛋白的表达。为了确定TRIM50是否与Rb的泛素化降解有关,我们进一步研究了TRIM50对Rb蛋白半衰期和泛素化的影响。放线菌酮实验结果显示,TRIM50过表达缩短了Rb蛋白降解的半衰期。泛素化实验结果显示,过表达TRIM50增加了Rb蛋白多聚泛素化的水平。综上所述,我们的结果表明了TRIM50通过促进Rb的泛素化降解从而下调OSCC细胞中的Rb蛋白的表达量。为了证实TRIM50通过调控Rb蛋白的表达量从而抑制OSCC细胞的增殖和转移,我们进行了TRIM50和Rb共表达组合功能实验,结果发现,过表达TRIM50能逆转过表达Rb对OSCC细胞恶性生物学功能的抑制作用。因此可以说明,Rb是TRIM50下游的靶标分子,被其所介导的泛素化降解途径所调控,从而影响OSCC的生物学功能,我们初步阐明了TRIM50促进OSCC的增殖和转移的分子机制。
综上所述,我们揭示了TRIM50与OSCC细胞增殖与转移之间的关系,发现E3泛素化连接酶TRIM50在OSCC中作为一个肿瘤驱动因子调控细胞的恶性表型,从而促进了OSCC的发生发展。TRIM50通过促进OSCC细胞中抑癌蛋白Rb的泛素化和降解来间接促进其激进的生物学行为。因此,靶向TRIM50-Rb通路可能是治疗OSCC的有效手段。

