轻烧粉在氯化铵体系中的萃取实验研究
吴丹,张琦,王玉琪,张文燕,武海虹,骆碧君,黄西平
(自然资源部天津海水淡化与综合利用研究所,天津 300192)
近年来,随着我国纯碱产业的发展,其副产品NH4Cl 由于在化肥方面的应用受到限制而造成大量积压,已成为纯碱工业的瓶颈,亟需找到合适的利用方式[1]。如果将NH4Cl 分解成经济价值较高的NH3和HCl,NH3可在纯碱工业中循环利用,HCl也可以在有机氯化工等诸多领域得到应用。因此,NH4Cl分解制NH3和HCl是解决纯碱工业瓶颈问题的一个很好的途径[2-3]。
NH4Cl受热可分解成NH3和HCl,但同时有大量的NH4Cl升华,而且生成的NH3和HCl 难以分离,极易重新生成很小的NH4Cl 颗粒。为了得到NH4Cl 的分解产物NH3和HCl,一种可行的方法是在反应物NH4Cl中加入可重复使用的酸性或碱性物质,加热后使NH3先释放出来,然后在更高的温度下使HCl释放出来[4]。


1 实验部分
1.1 试剂与仪器
轻烧粉(MgO),活性(柠檬酸法)1 min 50 s,工业级;氯化铵(NH4Cl)、铬黑T、EDTA、氨水、无水乙醇均为分析纯;蒸馏水。
METTLER PL403 精密电子天平;2NCLT10000ML智能恒温电加热磁力搅拌器;Rigaku D/max 2500v/pc X-射线自动衍射仪;Philips XL30ESEM场发射扫描电镜。
1.2 实验方法
将调浆后的MgO 和一定浓度的NH4Cl溶液按照一定摩尔比混匀,注入四口烧瓶中,设定温度和搅拌速度并开始计时。在 MgO 萃取过程中,定时从四口烧瓶中取样并立即抽滤,测定滤液中Mg2+浓度变化,用来观测MgO的萃取率。四口烧瓶中产生的NH3用稀硫酸溶液进行吸收。
1.3 分析方法
采用化学滴定法分析MgO的萃取率;采用X-射线自动衍射仪(XRD,Cu Ka 辐射)表征过程中固相组分的晶型;采用场发射扫描电镜(SEM)表征过程中固相组分的形貌。
2 结果与讨论
2.1 Mg2+初始浓度对MgO萃取率的影响
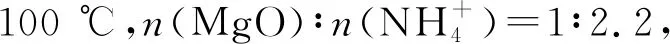
由图1可知,随着Mg2+初始浓度的升高,MgO的萃取率逐渐降低。Mg2+初始浓度1 mol/L时MgO的萃取率最高。选取Mg2+初始浓度为1 mol/L开展实验。

图1 Mg2+初始浓度对MgO萃取率的影响Fig.1 Effect of Mg2+ initial concentration on MgO extraction rate


图对MgO萃取率的影响 MgO extraction rate
2.3 温度对MgO萃取率的影响

由图3可知,70~90 ℃萃取,MgO萃取率随着时间的增加升高幅度较小。当萃取温度升高至100 ℃,MgO萃取率随时间的增加升高幅度大幅增加,反应120 min后MgO萃取率接近90%。当萃取温度继续升高至110 ℃,45 min后MgO萃取率即大于80%,仅需90 min MgO萃取率即趋于平衡。随着反应温度的升高,NH3在溶液中的溶解度随之降低,有利于NH3的逸出,反应体系中有更多的MgO转化为Mg2+溶解于溶液中。选取温度为110 ℃开展实验。反应120 min后,MgO萃取率大于98%时,故选取反应时间2 h开展实验。

图3 温度对MgO萃取率的影响Fig.3 Effect of temperature on MgO extraction rate
2.4 机理研究
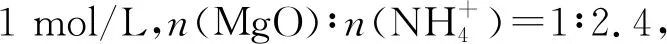
由图4a可知,MgO-NH4Cl-H2O 体系中,反应15 min取样,MgO已经开始转化成Mg(OH)2,但是转化率还很低。由图4b可知,在反应30 min时已经有接近50%的MgO转化为Mg(OH)2。由图4c可知,反应45 min时80%的MgO已经转化为Mg(OH)2, 且Mg(OH)2衍射峰强度逐渐增强。由图4d可知,当反应60 min时,大部分MgO已经转化为Mg(OH)2,仅有一小部分没有完全转化。Mg(OH)2衍射峰的位置与标准PDF卡(07-0239)上的Mg(OH)2结构完全一致,属六方晶系。

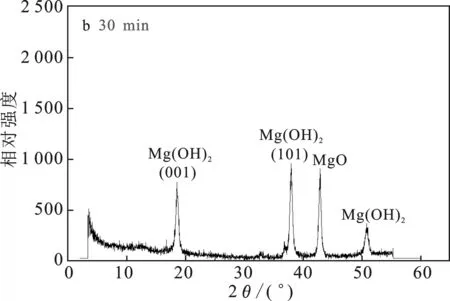


图4 不同时间点的固相XRD谱图Fig.4 XRD patterns of the solid phase at different time
原料MgO和60 min时固相的电镜照片见图5。
由图5a可知,原料MgO为大小不均的块状物,而60 min固相为六方片状产物,进一步验证了MgO在NH4Cl体系中的萃取过程分两步进行,第1步是MgO水化成Mg(OH)2;第2步是Mg(OH)2的溶解。这与文献[7]的结论一致。


图5 原料MgO和60 min固相的电镜照片Fig.5 SEM of MgO raw material and 60 min solid phase
铵盐在MgO-H2O悬浮体系中形成了缓冲体系,能够显著加速MgO溶解和Mg(OH)2沉淀的形成。铵盐溶液环境下,MgO在水化过程中未与铵盐形成中间产物,其过程符合“溶解-沉淀-溶解”机理。整个过程的反应方程式可表示为[7-8]:

Mg2+(aq) +2OH-(aq)
Mg2+(aq) + 2OH-(aq) → Mg(OH)2(s)
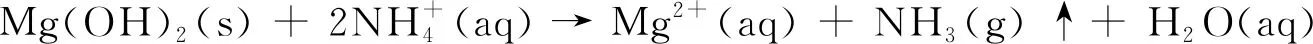
从反应过程可知,MgO在铵盐体系中先快速水化为Mg(OH)2,再与铵盐反应转化成Mg2+,产生大量NH4OH,随着温度的升高和反应时间的延长,大量NH3溢出,促进了MgO的水化和Mg(OH)2的溶解。
3 结论与展望
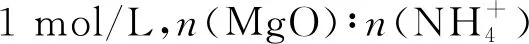
(2)MgO在NH4Cl体系中的萃取过程分两步,第1步是MgO水化成Mg(OH)2;第2步是Mg(OH)2溶解转变为Mg2+,其过程符合“溶解-沉淀-溶解”机理。
(3)对于不同的含镁原料,用氨作为沉淀镁离子的碱性物时有两大类工艺流程,以可溶性镁盐为原料时可以采用开放式流程,以活性MgO为原料时则可以采用封闭式流程[9]。活性MgO可溶解于铵盐溶液,形成富含镁离子的溶液,释放出氨气。镁盐溶液除去水不溶物和带色离子后,再与蒸出的氨气反应生成Mg(OH)2沉淀。Mg(OH)2可作为制备高品质MgO的前驱体,母液返回蒸氨系统继续作为溶剂进行蒸氨反应。整个反应过程中铵盐溶液与氨气全部循环,没有废铵渣产生,适宜于规模性连续生产。
(4)MgO在NH4Cl体系中萃取制备Mg(OH)2为低品位镁矿应用提供了一条新思路[10]。充分利用低品位镁矿制备高附加值的镁系物,有助于降低生产成本,完善海水化学资源产业链条,改变镁系低端初级型产品大量低价出口、高端高附加值产品大量进口的不利局面,提升企业盈利与国际市场竞争能力,助力我国化学资源综合利用产业发展。

