藏药佐太和甲基汞对神经细胞Neuro-2a毒性的差异比较
夏政华,李岑,毕宏涛,耿卢婧,杜玉枝,魏立新
(1.中国科学院西北高原生物研究所,藏药研究重点实验室,青海 西宁 810008;2.中国科学院大学,北京 100049;3.青海省藏药药理学与安全性评价重点实验室,青海 西宁 810008)
佐太是水银等原料经炮制后制成的矿物药[1-2],藏医认为将其加入到药物中具有“减毒增效”的功能[3],在治疗中风、神经系统疾病、肝胆胃肠疾病和肿瘤等方面具有独特的功效[4],然而,由于近年来环境中的汞污染受到人们的持续关注,尤其是甲基汞极易透过血脑屏障对神经系统造成不可逆转损伤[5],造成“汞化合物等于神经毒物”的认知,引起人们对含汞藏药的恐慌,极大限制了含佐太藏药的临床应用.
尽管现代理化分析表明佐太中约含54.5%的β-HgS,这些β-HgS是微粒直径约为200~700 nm的纳米药物[6-7],并且通过对含佐太药物使用的临床监测和动物试验,已初步证实该药对人体肝肾功能是安全的,肝肾等代谢器官中的汞蓄积对试验动物无明显毒副作用[8-10].此外,临床应用表明,含佐太的药物能治疗神经系统类疾病,如阿尔茨海默症[11],而且前期研究发现佐太对抑郁模型小鼠的抑郁状态具有良好的改善作用[12],这些研究结果均提示佐太的药理活性作用部位可能是神经系统.但是,目前对佐太和甲基汞的毒性差异研究主要集中在肝肾毒性、药物代谢酶、药物转运体基因的表达等方面[13-15],缺乏在神经毒性差异方面的研究,无法消除人们对含佐太藏药治疗神经系统类疾病的质疑.
为了探究佐太和甲基汞对神经细胞的毒性区别,进一步提供佐太用药的安全性依据,本研究选用小鼠神经瘤母细胞Neuro-2a,通过测定用药后细胞存活率、细胞形态、细胞凋亡率、凋亡基因的表达等指标,以期能系统地评价佐太和甲基汞对神经细胞Neuro-2a凋亡的影响差异.
1 仪器与材料
1.1 药物
佐太(西藏藏医院藏药厂);MeHg(美国Sigma公司);小鼠脑神经瘤母细胞Neuro-2a(中国科学院细胞库).
1.2 仪器
奥林巴斯荧光倒置显微镜(奥林巴斯公司);多功能酶标仪(珀金埃尔默企业管理上海有限公司);FlowSight流式细胞仪(美国默克公司);ETC811基因扩增仪(苏州东胜兴业科学仪器有限公司); ViiATM7实时荧光定量PCR仪(赛默飞世尔科技中国有限公司).
1.3 主要试剂
磺基罗丹明 B(sulforhodamine B,SRB)(美国Sigma公司);苏木素伊红染色试剂盒(中国碧云天生物技术有限公司);细胞凋亡检测试剂盒(中国碧云天生物技术有限公司);逆转录试剂盒、荧光定量试剂盒(大连Takara公司).
2 试验方法
2.1 细胞培养
将Neuro-2a细胞培养于含10%胎牛血清和1%青霉素-链霉素溶液 (100×)的MEM 培养液中,置于 37 ℃、5% CO2培养箱中培养,取对数生长期的Neuro-2a细胞用 0.25% 胰酶-EDTA 消化传代,胰酶消化2~3 min后收集细胞,8 000个/孔接种于96孔板或25万/孔接种于6孔板,培养24 h后进行后续试验步骤.
2.2 分组和给药
试验分组为:空白对照组(Control),佐太组(Zuotai,1.83 mg/L,含汞1 mg/L),甲基汞组(MeHgCl,1.25 mg/L,含汞1 mg/L),给药后培养时间分别为6、12、24 h,培养结束后进行细胞存活率、细胞形态、凋亡率、凋亡基因表达的检测.试验药物的配制液均为PBS,佐太组为悬浮液给药[16].
2.3 细胞存活率
采用磺基罗丹明 B 法(sulforhodamine B,SRB)法检测细胞存活率,相比于传统的MTT法,SRB法不仅具有操作简便、灵敏的特点,而且测量结果不受时间影响[17].按照2.1方法在细胞培养结束后,倒掉细胞培养液后每孔加入100 μL预冷的10% TCA,4 ℃固定后纯水清洗5次,每孔加入100 μL SRB作用20 min,1% 冰乙酸冲洗5次后干燥,加入150 μL/孔Tris-HCl(10 mmol/L),置于振板器20 min,酶标仪560 nm测定OD值.按照下式计算细胞存活率.
细胞存活率(%)=(给药组OD值/空白对照组OD值)×100%
2.4 细胞形态
按照2.1方法在细胞培养结束后,6孔板中取出细胞爬片,PBS漂洗3次,95%的乙醇固定20 min后苏木素染色10 min,自来水冲洗10 min去除多余染色液,伊红染色30~120 s,70%乙醇、80%乙醇、90%乙醇、无水乙醇梯度脱水,中性树脂封片后进行细胞形态观察.
2.5 细胞凋亡率
使用AnnexinV-FITC和PI双染法检测药物细胞孵育后的凋亡情况[18-19].按照2.1方法在细胞培养结束后,PBS洗涤细胞一次,消化后收集细胞于1 000g离心5 min,弃上清PBS重悬后计数,取10万细胞1 000g离心5 min,弃上清后加入195 μL Annexin V- FITC结合液重悬细胞,加入5 μL Annexin V- FITC、0 μL碘化丙啶(PI)混匀,室温避光孵育15 min后流式细胞仪检测凋亡情况.
2.6 凋亡基因、炎症因子基因检测
按照2.1方法在细胞培养结束后弃去培养液,1 mL/孔的TRIzol提取RNA,使用逆转录试剂盒合成cDNA,使用目标引物扩增cDNA后检测凋亡基因、炎症因子基因的表达情况.引物序列见表1.

表1 实时荧光定量PCR引物列表Table 1 Primer sequences for RT-PCR
2.7 统计分析
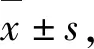
3 结果与分析
3.1 细胞存活率检测
与空白组相比,随着孵育时间的增加(6、12、24 h),佐太组的细胞存活率分别为(100±0.032)%、(99.4±0.033)%、(96.8±0.102)%,甲基汞组的细胞存活率分别为(97.1±0.082)%、(66.1±0.147)%、(26.3±0.069)% (图1),甲基汞对于Neuro-2a细胞存活率的影响远大于佐太.
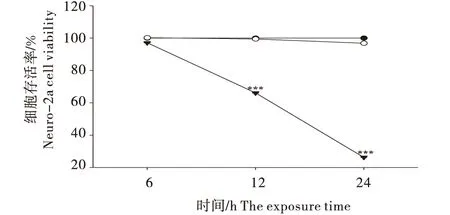
3.2 细胞形态观察
HE染色表明,3个孵育时间下(6、12、2 4h),空白组的Neuro-2a细胞呈不规则多边形,细胞边界清晰,形态良好(图2-A、2-D、2-G).与空白组相比,佐太组的细胞形态未有明显变化(图2-B、2-E、2-H),而甲基汞组的细胞逐渐固缩且出现絮状物,细胞形态受破坏程度逐渐加剧(图2-C、2-F、2-I),佐太和甲基汞对细胞形态的破坏性与细胞存活率的检测结果一致.
与空白组相比,***P<0.001,**P<0.01,*P<0.05.Compared with the control group,*** P<0.001,** P<0.01,*P<0.05.图1 佐太和甲基汞对Neuro-2a细胞存活率的影响(n=6)Figure 1 Effect of Zuotai and MeHgCl on the cell viability of Neuro-2a (n=6)
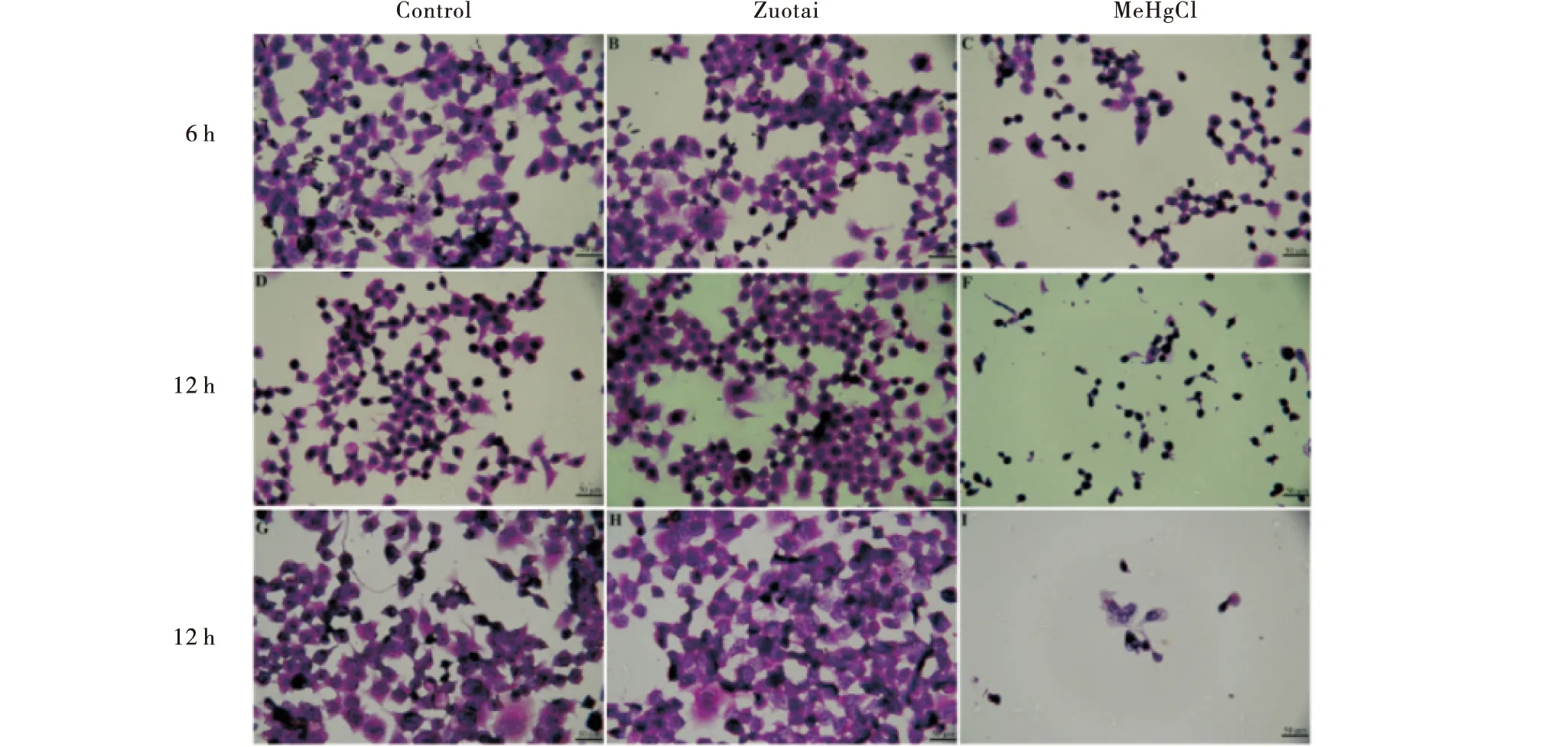
图2 佐太和甲基汞对Neuro-2a细胞形态的影响(HE染色,400×)Figure 2 Effect of Zuotai and MeHgCl on Neuro-2a cell morphology (HE staining,400×)
3.3 流式法检测细胞凋亡率
AnnexinV-FITC和PI双染表明,与空白组相比,佐太组的细胞凋亡率在12 h和24 h显著增加,而甲基汞组的细胞凋亡率随孵育时间的增加均极显著增加,且均远高于佐太组.孵育6 h时甲基汞组的凋亡率比佐太组高24.5%;孵育12 h时甲基汞组的凋亡率为46.9%,佐太组为17.4%;孵育24 h时甲基汞组的凋亡率是佐太组的2.52倍(图3-A).结果与细胞存活率、细胞形态结果一致.图3-B是细胞仪检测细胞凋亡的可视化图,图4是Annexin V-FITC/PI法检测佐太和甲基汞对Neuruo-2a细胞凋亡率影响的流式图.

图4 佐太和甲基汞对Neuruo-2a细胞凋亡率影响的流式图(Annexin V-FITC/PI法)Figure 4 Flow cytometric analysis of the effects of Zuotai and MeHgCl on neuruo-2a cell apoptosis(Annexin V-FITC/PI)
3.4 Caspase家族基因表达
RT-PCR检测表明,孵育时间为24 h时,甲基汞组Caspase-3基因表达量比空白组和佐太组分别高21.9%、22.3%,Caspase-9基因表达量比空白组和佐太组分别高239%、232%(图5).Caspase家族基因表达结果与细胞凋亡率并不完全一致,可能是由于基因表达与表型的差异性所致,还需要Westen blot等方法进一步的检测.
与空白组相比,***P<0.001,**P<0.01,*P<0.05.Compared with the Control group,***P<0.001,**P<0.01,*P<0.05.图3 佐太和甲基汞对Neuro-2a细胞凋亡率的影响 (n=3)Figure 3 Effect of Zuotai and MeHgCl on the apoptosis rates in Neuro-2a (n=3)
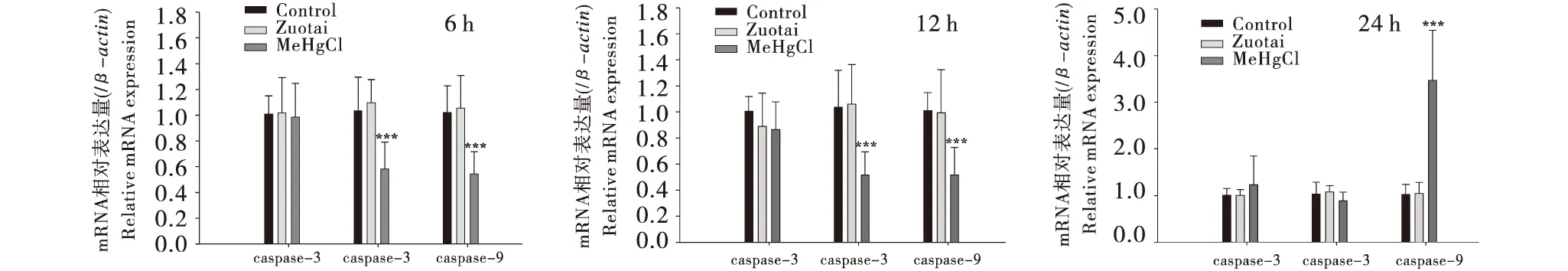
与空白组相比,***P<0.001,**P<0.01,*P<0.05.Compared with the control group,***P<0.001,**P<0.01,*P<0.05.图5 佐太和甲基汞对Neuro-2a细胞Caspase家族基因表达的影响(n=9)Figure 5 Effect of Zuotai and MeHgCl on the expressions of Caspase-related genes in Neuro-2a (n=9)
3.5 线粒体相关凋亡基因表达
RT-PCR检测表明,随着孵育时间的增加,佐太组Bcl-2/Bax的比值并未有明显变化,而甲基汞组Bcl-2/Bax的比值分别为86.9%(6 h)、60.8%(12 h)、48.5%(24 h),说明细胞趋于凋亡状态(图6).

与空白组相比,***P<0.001,**P<0.01,*P<0.05.Compared with the control group,***P<0.001,**P<0.01,*P<0.05.图6 佐太和甲基汞对Neuro-2a细胞线粒体凋亡相关基因表达的影响(n=9)Figure 6 Effect of Zuotai and MeHgCl on the expressions of mitochondrial apoptosis-related genes in Neuro-2a (n=9)
3.6 炎症因子相关基因表达
RT-PCR检测表明,与空白组相比,佐太组在孵育时间为6 h和12 h时炎症因子的表达并未有明显变化,但是随着孵育时间增加至24 h,IL-6和TNF-α分别增加了11.3倍和1.61倍.甲基汞组在孵育的3个时间点,IL-6、IL-1β、TNF-α的表达均显著增加,如在2 h时IL-6、IL-1β、TNF-α的表达分别增加了138倍、33.5倍、218倍.虽然甲基汞和佐太均能引起炎症因子基因表达的增加,但是甲基汞的影响远远大于佐太组.
4 讨论
为了探究藏药佐太和甲基汞对神经细胞Neuro2a凋亡情况的影响差异,采用SRB法测定细胞存活率、HE染色观察细胞形态、流式细胞术检测细胞凋亡率,实时荧光定量PCR检测Caspase家族基因、线粒体凋亡相关基因、炎症因子基因的表达,结果发现在含汞量相同时,甲基汞对神经细胞Neuro-2a的凋亡影响远大于佐太.
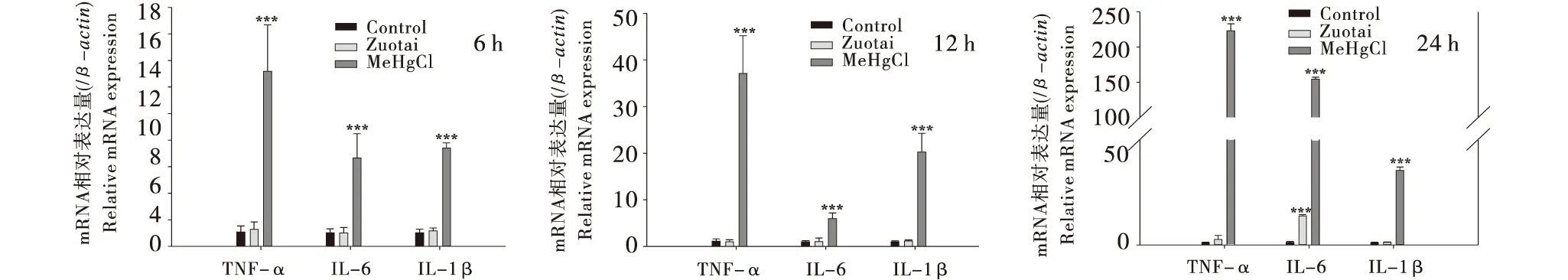
与空白组相比,***P<0.001,**P<0.01,*P<0.05.Compared with the Control group,***P<0.001,**P<0.01,*P<0.05.图7 佐太和甲基汞对Neuro-2a细胞炎症因子基因表达的影响(n=9)Figure 7 Effect of Zuotai and MeHgCl on the expressions of inflammatory cytokines genes in Neuro-2a (n=9)
通过测定细胞存活率,同时结合细胞形态学观察和细胞凋亡率的检测,发现随着孵育时间的增加,甲基汞组的细胞存活率逐渐降低,细胞形态受到严重破坏,而佐太组细胞的存活率并无明显变化,形态也未产生明显改变.甲基汞组的细胞凋亡率随孵育时间的增加而显著增加,且均高于佐太组,细胞凋亡率的变化与细胞存活率和细胞形态学的差异性一致.
Caspase家族在细胞凋亡的分子网络中处于核心地位[20],是多条凋亡通路的汇聚点,是执行凋亡的最终途径,检测Caspase家族基因的表达可以进一步表明细胞的凋亡状态[21].RT-PCR检测结果显著,甲基汞组的Caspase家族基因Caspase-3和Caspase-9基因表达增加,佐太对Caspase家族基因的表达无显著影响.细胞的凋亡通路会还受到多种基因和蛋白的调控,如线粒体凋亡通路,而线粒体凋亡通路中的Bc1-2家族的基因表达和调节是影响细胞凋亡的重要因素之一[22],Bcl-2家族中的促凋亡成员(如Bax、Bak)和抑凋亡成员(如Bcl-2)通过相互作用影响细胞的凋亡状态,其中Bcl-2与Bax的比值变化是调节细胞凋亡状态的关键因素[23].RT-PCR结果表明甲基汞组的Bcl-2/Bax比值随孵育时间的增加而降低,表明细胞趋于凋亡状态,而佐太组的Bcl-2/Bax比值并未有明显变化.前期研究发现佐太和甲基汞结合蛋白能够分别影响肥大细胞和神经细胞炎症因子的释放[24-25],因此检测炎症因子相关基因IL-6、IL-1β、TNF-α的表达,RT-PCR结果显示甲基汞组在孵育的3个时间点,IL-6、IL-1β、TNF-α的表达均极显著增加,佐太虽然也能引起炎症因子基因表达的增加,但远低于甲基汞.
以上试验结果表明不同孵育时间下,甲基汞均可以通过增加Caspase家族基因和炎症因子基因表达,改变线粒体凋亡基因的表达比例来加剧神经细胞Neuro-2a的凋亡状态,使得细胞存活率降低,细胞凋亡率增加,改变细胞的正常形态,而等汞含量的佐太对神经细胞Neuro-2a的凋亡状态并无显著影响,说明汞含量相同时藏药佐太对神经细胞Neuro-2a的毒性远小于甲基汞.推测造成这种影响差异的决定性因素在于汞形态的不同,传统含汞药物中汞的形态均为硫化汞,例如中药朱砂、印度药Kajjali,佐太中汞的形态为β-HgS,与甲基汞相比在溶解度和肠道吸率等方面有显著差异[26].已有研究表明含汞药物中汞的形态可能是决定其药效和毒性的关键因素[27],而佐太中经过特殊炮制后存在的汞可能是其药效学的基础[28].此外,由于佐太的颗粒性,在通过体外细胞系培养探索其毒性和药理时,均采用悬浮液给药方式[16,25],本文中采用的是PBS配制佐太悬浮液,未考察汞溶出情况,在后续研究中应结合汞溶出情况进一步深入探索.
通过以上探究证实藏药佐太对神经细胞Neuro-2a凋亡的影响远小于甲基汞,提示藏药佐太对神经系统的毒性不能只考虑汞元素而应该充分考虑汞的形态.本研究比较了藏药佐太和甲基汞在神经细胞毒性方面的差异性,为佐太安全性用药和药效学评价提供了新的依据.

