转录组及代谢组联合解析郑单309响应花粒期高温胁迫的机制
李 川,黄 璐,乔江方,张美微,张盼盼,牛 军,刘京宝,王淑凤
(1.河南省农业科学院 粮食作物研究所,河南 郑州 450002; 2.禹州市农业农村局,河南 禹州 452570)
温度是影响作物生长发育、产量品质的关键因素。近年来随着全球气候变暖,短期异常高温频发[1-3]。玉米是我国重要的粮食、饲料、工业三元作物。温度对玉米抽雄吐丝及授粉过程的影响较大[4],进而严重影响玉米产量。因此,研究玉米对花粒期高温的响应机制具有重要的现实意义。玉米吐丝授粉的最佳日平均温度为25~28 ℃,空气相对湿度70%[5]。日最高温度超过35 ℃,田间玉米授粉过程将受到阻碍,花粉在高于39 ℃时会失活,授粉过程不能顺利完成从而造成减产甚至绝收[6]。高温胁迫除了影响花粉活性和授粉过程外,还可以影响雌穗的发育,例如雌穗分化异常、延缓吐丝,最终导致雌雄穗发育时期不协调,玉米授粉结实率下降[7-8]。花粒期日平均温度过高可以导致玉米叶片气孔关闭[9]、破坏玉米叶片叶绿体结构[10]、降低玉米植株中蛋白酶活性,这些最终导致玉米植株光合作用被大大削弱[11-12]。花粒期日间高温会提高玉米植株生育过程中多种生理生化反应速率[13-14],缩短生育期,减少籽粒干物质积累量[15],减少籽粒库容,导致玉米籽粒败育率增加[16],最终导致玉米产量下降[17]。另外,玉米花粒期高温胁迫还能够改变内源激素的含量及种类[18],而玉米果穗的灌浆由多种内源激素共同调控。其中,脱落酸(ABA )在植株受到高温胁迫时表达水平提高,调控下游高温诱导相关基因的表达水平,减少高温对叶绿体结构的破坏,提高植株的耐热性。玉米灌浆速率受多种内源激素的共同调控,其中,赤霉素(GA)可以提高植物结实率;生长素(IAA)可以促进细胞分裂、植株生长。玉米花粒期高温胁迫还可以改变植株内多种酶活性,降低玉米品质[19]。光合作用的中间产物蔗糖运输至玉米籽粒后,由束缚态淀粉酶、可溶性淀粉合成酶、蔗糖合成酶、腺苷二磷酸葡萄糖焦磷酸化酶等不同种类的酶蛋白催化形成淀粉。花粒期高温胁迫降低淀粉合成酶的活性,最终造成籽粒中合成的淀粉减少[20]。
目前,关于花粒期高温胁迫对玉米的危害研究主要集中于玉米植株生理生化过程、产量、品质等方面[20-22],而在分子水平上的研究报道较少,主要是从抗逆基因[23]、激素所调控的高温胁迫相关下游基因[24]等单个或少数几个基因表达水平上分析高温胁迫对玉米的影响。为此,利用高通量转录组测序手段和广泛靶向代谢组测序手段全面阐述玉米新品种郑单309花粒期响应高温胁迫的分子机制,明确高温胁迫下的差异表达基因、差异表达代谢物,并对差异表达基因和差异表达代谢物代谢通路进行分析,从而阐明郑单309响应高温胁迫的分子机制。
1 材料和方法
1.1 供试材料
供试材料为玉米新品种郑单309,由河南省农业科学院粮食作物研究所选育,于2018年通过河南省作物品种审定委员会审定(豫审玉20180038)。该品种耐高温热害,抗青枯病和穗腐病,稳产性好,适应范围广。
1.2 高温处理
试验于2018年6月12日在河南省农业科学院现代农业科技试验示范基地进行。在玉米第9片叶展开时(大喇叭口期)采用生长箱进行田间增温处理,生长箱长20 m、宽15 m、高4 m。生长箱四周用透光率较好(95%)的树脂薄膜覆盖,顶部密封90%,留出10%的空隙便于田间气体交换。生长箱下部树脂薄膜可以拆移,以便生长箱内温度过高时可以快速降温。在生长箱四周和中间悬挂温度计,每天早、中、晚观察记录生长箱内温度变化,控制生长箱内气温平均高于外界田间气温4~5 ℃。17:00—8:00揭开树脂膜。生长箱内光照强度和相对湿度等生长条件基本与外界生长条件一致。玉米植株抽雄散粉后即高温胁迫处理7 d进行第一次取样,高温处理14 d进行第二次取样,之后拆除生长箱不再进行高温处理。
1.3 取样
高温处理7 d 进行第一次取样:选5株长势一致的玉米植株,取穗位叶混合在一起,重复3次,分别命名为HT郑单309-1、HT郑单309-2、HT郑单309-3;不进行高温处理的对照材料分别命名为CK郑单309-1、CK郑单309-2、CK郑单309-3。高温处理14 d 进行第二次取样:另选取5株长势一致的玉米植株,取穗位叶混合在一起,分别命名为HT郑单309-4、HT郑单309-5、HT郑单309-6;对照材料分别命名为CK郑单309-4、CK郑单309-5、CK郑单309-6。叶片样品立即放于液氮中冷冻,然后于-70 ℃超低温冰箱保存。
1.4 RNA提取及转录组测序
玉米叶片总RNA用试剂盒RNeasy Plant Mini Kit(Qiagen,Germany)提取。用琼脂糖凝胶电泳及生物芯片分析检测仪Agilent Bioanalyzer 2100 system(Aglilent Technologies, USA)检测提取RNA 的完整性。RNA浓度用Nanodrop ND-1000 UV-Vis Spectrophotometer(Nanodrop Technologie, USA)测定。由北京百迈客生物科技有限公司构建cDNA文库, 转录组高通量测序用Illumina HiSeqTM2500测序仪完成。
1.5 高通量测序结果分析及基因功能注释
高通量测序后的原始序列通过去除接头序列、低质量序列、多N序列及长度过短序列等一系列分析后获得干净序列。最终计算出测序序列的碱基错误率及GC碱基含量。利用Hisat2 序列比对软件采用BWT算法将所得干净序列与已经公布的玉米自交系B73序列(https://www.maizegdb.org/)进行比对,查找基因信息。利用RSeQC-2.6.3软件对与上述自交系B73序列比对所得基因进行测序饱和度、基因覆盖度及冗余序列分析,参照Nr 蛋白质序列、 Nt 核酸序列、Pfam、KOG/COG、Swiss-Prot、KO、GO数据库进行高通量测序结果基因的功能注释。
1.6 基因表达量统计及筛选差异表达基因
基因表达具有时间和空间特异性,本试验中高温胁迫处理不同时间段材料中检测到的基因表达水平存在显著差异的基因命名为差异表达基因(Differentially expressed genes,DEGs)。差异表达基因是郑单309响应高温胁迫的重要基因。转录组测序所得所有转录本用FPKM(Fragment per kilobase of transcript per million fragment mapped)值表示。依据基因表达量及edgeR软件计算获得差异表达基因,筛选标准P<0.05。显著差异表达基因筛选标准为错误发现率FDR<0.05 ,基因表达量变化倍数取2为底数对数值的绝对值|log2FC|≥2。参照GO数据库,将差异表达基因按照参与的生物学过程(Biological process,BP)、细胞组分(Cellular component, CC)、分子功能(Molecular function, MF)进行基因功能注释分类。参照KEGG (Kyoto Encyclopedia of Genes and Genomes)数据库分析差异表达基因参与的代谢途经。
1.7 代谢组学测序分析
代谢组学测序分析材料同转录组测序材料,采用广泛靶向技术进行分析,由北京百迈客生物科技有限公司完成。郑单309叶片样本粉碎后用微孔滤膜过滤。叶片中代谢物用液相色谱串联质谱(UPLC-MS/MS)分析仪检测,并根据检测所获得的二级谱信息定性分析代谢物种类。之后对郑单309叶片样本代谢物进行主成分分析(Principal component analysis,PCA),获知样本之间总体代谢差异和组内样本之间的变异度。利用正交偏最小二乘法-判别分析统计方法(Orthogonal projections to latent structures-discriminant analysis,OPLS-DA)过滤掉代谢组测序结果中与分类变量不相关的正交变量,并对非正交变量和正交变量进行分析,从而获得更加可靠的代谢物组间差异。差异代谢物筛选标准为代谢物表达量变化倍数取2为底数对数值的绝对值|log2FC|≥2以及OPLS-DA模型的变异度值VIP>1。利用R软件(www.r-project.org)对所检测到的同一代谢物在不同郑单309叶片样本间的积累模式进行聚类分析(Hierarchical cluster analysis, HCA)。通过查找KEGG数据库对检测到的差异代谢物进行功能注释、代谢通路等分析。
2 结果与分析
2.1 高温胁迫与正常生长条件下郑单309转录组测序序列分析
经分析(表1)发现,CK郑单309-1获得了71 543 704条干净序列,GC含量为59.84%,没有AT/GC分离现象,碱基识别精度99.9% 以上序列即Q30碱基质量值达92.68%。与参照B73基因组比对发现,84.33%的序列配对成功,获得60 332 708条配对序列。HT郑单309-1获得了56 355 684条干净序列,GC含量为60.42%,没有AT/GC分离现象,Q30碱基质量值达92.68%。与参照B73基因组比对发现,82.76% 的序列配对成功,获得46 641 566条配对序列。 CK郑单309-2获得了58 280 642 条干净序列,与参照B73基因组比对81.81%的序列配对成功。HT郑单309-2获得了62 827 976条干净序列,与参照B73基因组比对84.96%的序列配对成功。CK郑单309-3获得了69 146 446 条干净序列,与参照B73基因组比对82.60%的序列配对成功。HT郑单309-3获得了58 844 390条干净序列,与参照B73基因组比对84.53% 的序列配对成功。
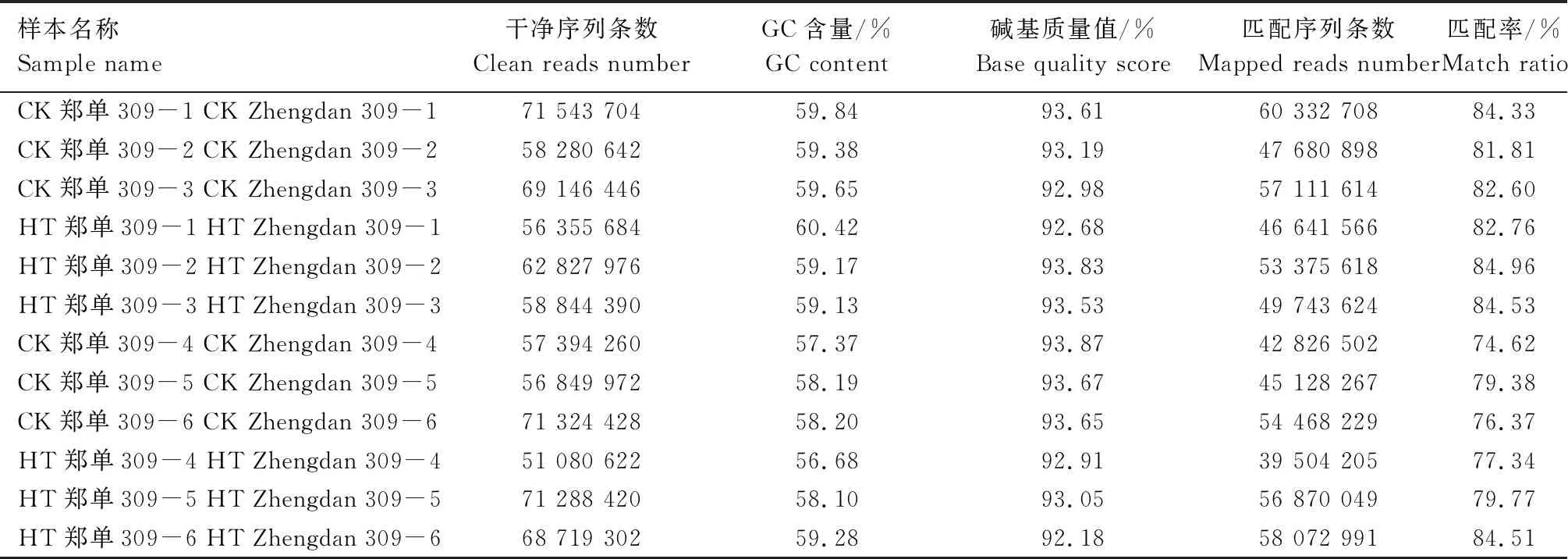
表1 高温胁迫与正常生长条件下郑单309转录组测序数据统计分析
CK郑单309-4获得了57 394 260 条干净序列,与参照B73基因组比对74.62%的序列配对成功。HT郑单309-4获得了51 080 622条干净序列,与参照B73基因组比对77.34% 的序列配对成功。CK郑单309-5获得了56 849 972 条干净序列,与参照B73基因组比对79.38%的序列配对成功。HT郑单309-5获得了71 288 420条干净序列,与参照B73基因组比对79.77% 的序列配对成功。CK郑单309-6获得了71 324 428 条干净序列,与参照B73基因组比对76.37%的序列配对成功。HT郑单309-6获得了68 719 302条干净序列,与参照B73基因组比对84.51% 的序列配对成功。
2.2 郑单309高温胁迫条件下的差异表达基因统计
差异表达基因根据表达水平分为上调表达基因(Up-regulated gene)和下调表达基因(Down-regulated gene)。图1所示,郑单309高温胁迫7 d与正常生长条件材料对比组(G0)共检测到515个差异表达基因,其中75个为上调表达基因,440个为下调表达基因。郑单309高温胁迫14 d与正常生长条件材料对比组(G1)共检测到506个差异表达基因,其中114个为上调表达基因,392个为下调表达基因。郑单309高温胁迫7 d 与高温胁迫14 d材料对比组(G2)共检测到2 050个差异表达基因,其中790个为上调表达基因,1 260个为下调表达基因。G0与G1中有7个基因在高温胁迫7、14 d叶片中均较正常材料差异表达。这7个共同差异表达基因分别为Zea_mays_newGene_28308,在高温胁迫7 d叶片中上调表达,在高温胁迫14 d叶片中下调表达,属于新基因,功能未知; Zm00001d019114,在高温胁迫7、14 d叶片中均上调表达,编码叉状蛋白抑制因子,在KOG数据库中分类属于RNA 加工及修饰蛋白; Zm00001d021497,在高温胁迫7、14 d叶片中均下调表达,编码丝切蛋白/原肌球蛋白类肌动蛋白结合蛋白,在KOG数据库中分类属于细胞骨架; Zm00001d025043,在高温胁迫7 d叶片中上调表达,在高温胁迫14 d叶片中下调表达,编码ABC转运蛋白,在KOG数据库中分类属于次级代谢物生物合成;Zm00001d022453,在高温胁迫7、14 d叶片中均上调表达,编码阳离子过氧化酶1,在KOG数据库分类中属于过氧化物;Zm00001d025319,在高温胁迫7、14 d叶片中均上调表达,编码泛素-蛋白连接酶1,在KOG数据库中分类属于翻译后修饰;Zm00001d038806,在高温胁迫7、14 d叶片中均下调表达,编码热激蛋白101,在KOG数据库中分类属于翻译后修饰。G0与G2中检测到58个共同差异表达基因。G1与G2中检测到115个共同差异表达基因。上述差异表达基因中的Zm00001d022453、Zm00001d025319、Zm00001d038806是G0、G1、G2中的共同差异表达基因。
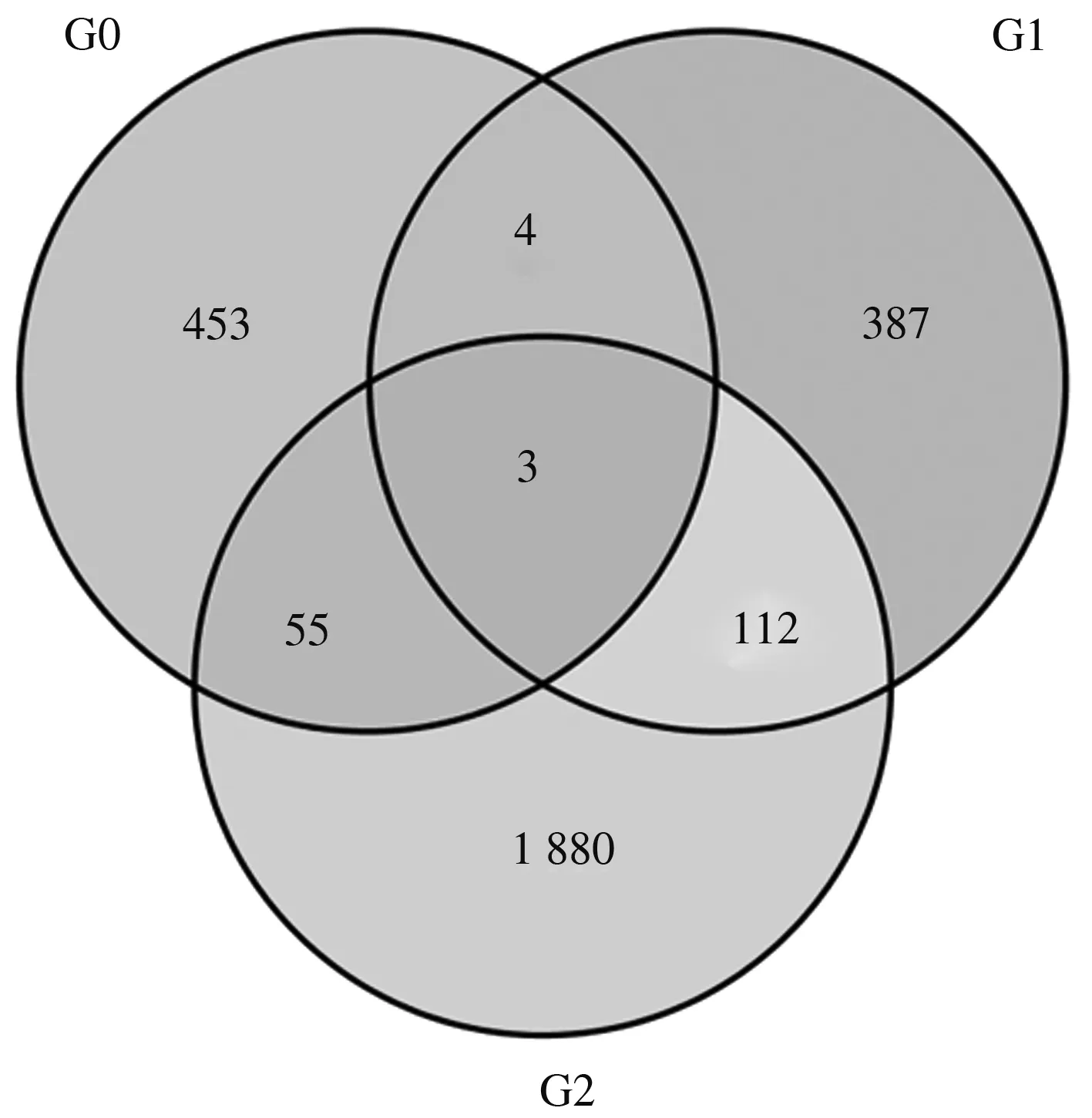
G0:郑单309高温胁迫7 d与正常生长条件材料的差异表达基因数目;G1:郑单309高温胁迫14 d与正常生长条件材料的差异表达基因数目;G2:郑单309高温胁迫7 d与高温胁迫14 d材料的差异表达基因数目
2.3 郑单309高温胁迫下差异表达基因的功能分析及分类
参照GO数据库,郑单309高温胁迫7 d 与正常生长条件材料对比组中差异表达基因主要富集于中和作用、生长发育、多有机体过程、生殖过程、繁育、细胞组分、生物调控、细胞进程,细胞连接、共质体、细胞外区、细胞外区成分,催化活性、分子功能活性、抗氧化活性等。郑单309高温胁迫14 d 与正常生长条件材料对比组中差异表达基因主要富集于节奏过程、中和作用、多有机体过程、定位、刺激反应、单有机体过程、代谢过程,细胞膜、细胞膜成分、细胞外区、细胞外区成分,结合作用、催化活性、电子载体活性、抗氧化活性、养分储备活性等。郑单309高温胁迫7 d 与14 d对比组中差异表达基因主要富集于单有机体过程、刺激反应、定位、多有机体过程、信号传导、中和作用、节奏过程,细胞膜、细胞膜成分、细胞外区、核酸细胞成分,转运蛋白活性、核酸结合转录因子活性、电子载体活性、信号转导活性,分子转换活性、抗氧化活性等。
依据KOG/COG数据库,对差异表达基因进行同源分类。郑单309高温胁迫7 d 与正常生长条件材料对比组中差异表达基因主要分布于碳水化合物的运输和代谢、信号转导系统、细胞壁/细胞膜/被膜生物合成、脂质运输及代谢、通用功能预测系统5个主要(富集到的差异表达基因个数≥10个)分类,以及能量产生及转换、细胞循环控制/细胞分裂/染色体分区、氨基酸转运及代谢、辅酶转运及代谢、转录、复制/重组/修复、细胞运动性、翻译后修饰/蛋白质中转/分子伴侣、无机离子运输及代谢、次级代谢物生物合成/运输/分解代谢、防卫机制、细胞骨架、未知功能13个次要(富集到的差异表达基因个数<10个)分类。郑单309高温胁迫14 d 与正常生长条件材料对比组中差异表达基因主要分布于氨基酸转运及代谢、碳水化合物的运输和代谢、细胞壁/细胞膜/被膜生物合成、次级代谢物生物合成/运输/分解代谢、通用功能预测系统、信号转导系统、防卫系统7个主要(富集到的差异表达基因个数≥10)分类,以及能量产生及转换、细胞循环控制/细胞分裂/染色体分区、核苷酸转运及代谢、辅酶转运及代谢、脂质运输及代谢、翻译/核糖体结构及生物合成、转录、复制/重组/修复、细胞运动性、翻译后修饰/蛋白质中转/分子伴侣、无机离子运输及代谢、胞内运输/分泌/膜泡运输、细胞外结构、未知功能14个次要(富集到的差异表达基因个数<10)分类。郑单309高温胁迫7 d 与14 d对比组中差异表达基因远远多于郑单309高温胁迫7 d 与正常生长条件材料对比组及郑单309高温胁迫14 d 与正常生长条件材料对比组,差异表达基因主要分布于能量产生及转换、氨基酸转运及代谢、核苷酸转运及代谢、碳水化合物的运输和代谢、辅酶转运及代谢、脂质运输及代谢、翻译/核糖体结构及生物合成、转录、细胞壁/细胞膜/被膜生物合成、翻译后修饰/蛋白质中转/分子伴侣蛋白、无机离子运输及代谢、次级代谢物生物合成/运输/分解代谢、通用功能预测系统、信号转导系统、防卫系统15个主要分类,以及RNA加工及修饰、染色质结构及动态、细胞循环控制/细胞分裂/染色体分区、复制/重组/修复、细胞运动性、细胞外结构、细胞骨架、未知功能8个次要分类。
对差异表达基因注释参与的代谢途径(Pathway)进行分析能进一步了解基因功能。郑单309高温胁迫7 d 与正常生长条件材料对比组中差异表达基因主要注释到植物-病原体相互作用、戊糖及葡萄糖醛酸酯相互转换、淀粉和蔗糖代谢、木质素生物合成、植物激素信号传导、氧化磷酸化6个代谢途经中。郑单309高温胁迫14 d 与正常生长条件材料对比组中差异表达基因主要注释到淀粉和蔗糖代谢、木质素生物合成、苯基丙氨酸代谢、植物-病原体相互作用、碳代谢、氨基糖及核苷酸糖代谢、氨酰tRNA生物合成7个代谢途经中。郑单309高温胁迫7 d 与14 d对比组中差异表达基因较多,主要注释到内质网内蛋白质加工、氨基酸生物合成、碳代谢、淀粉及蔗糖代谢、胞吞作用、过氧化酶体、植物激素信号传导、剪接体、DNA复制、核糖体、错配修补、泛素介导的蛋白质水解作用、RNA降解、RNA运输、真核细胞核糖体生物合成、氮代谢、硫代谢、半胱氨酸及蛋氨酸代谢、木质素生物合成、谷胱甘肽代谢、脂肪酸降解、磷酸戊糖途径、脂肪酸生物合成、果糖及甘露糖代谢、脂肪酸延长、醚酯代谢、丁酸甲酯代谢、嘌呤代谢、氰基氨基酸代谢、嘧啶代谢、丙酮酸代谢、光合作用、苯基丙氨酸代谢、2-氧化磷酸代谢、甘油磷脂代谢、脂肪酸代谢、类胡萝卜素生物合成、半乳糖代谢、萜类化合物主链生物合成、乙醛酸及脱酸产物代谢、光合器官中碳固定、糖酵解/糖异生作用、抗坏血酸代谢、缬氨酸亮氨酸及异亮氨酸降解、氨基糖及核苷酸糖代谢、丙氨酸天冬氨酸及谷氨酸代谢、甘氨酸丝氨酸及苏氨酸代谢、植物昼夜节奏、植物-病原体互作20个代谢途经中。
2.4 郑单309高温胁迫下的差异代谢物统计
对不同高温胁迫处理郑单309代谢组学进行分析,共检测到654个代谢物(图2)。郑单309高温胁迫7 d 与正常生长条件材料对比组G0中检测到40个差异表达代谢物,其中8个上调表达,32个下调表达。郑单309高温胁迫14 d 与正常生长条件材料对比组G1中检测到40个差异表达代谢物,其中4个上调表达,36个下调表达。郑单309高温胁迫7 d 与14 d对比组G2中检测到46个差异表达代谢物,其中17个为上调表达,29个下调表达。G0与G1对比组中检测到17个共同差异表达代谢物均在高温胁迫7 d叶片、高温胁迫14 d叶片中显著表达。G0与G2对比组中检测到4个共同差异表达代谢物显著表达,分别为喜树碱,上调表达;乙酰基赖氨酸O-己糖苷,上调表达;反式己二烯二酸,上调表达;对苯二甲醛,上调表达。G1与G2对比组中检测到7个共同差异表达代谢物显著表达,分别为髓鞘相关糖蛋白异构体1,下调表达;胆甾醇,下调表达;山奈酚,下调表达;绿原酸甲酯,下调表达;乙酰氧乙酸,下调表达;N,N-二甲基甲酰胺,下调表达M;对苯二甲酸,下调表达。尤其值得注意的是,代谢物对苯二甲酸在GO、G1、G2对比组中表达量均达到差异水平,只是表达模式不同。
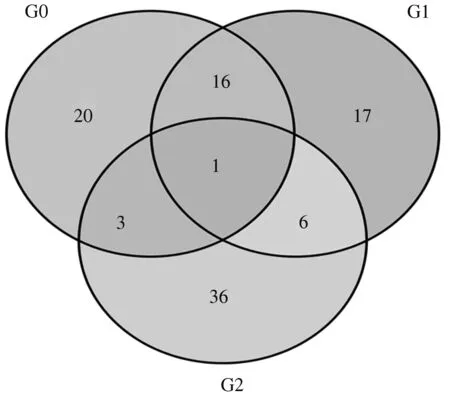
G0:郑单309高温胁迫7 d与正常生长条件材料的差异表达代谢物数目;G1:郑单309高温胁迫14 d与正常生长条件材料的差异表达代谢物数目;G2:郑单309高温胁迫7 d与高温胁迫14 d材料的差异表达代谢物数目
2.5 郑单309高温胁迫下差异代谢物的功能分类
由表2可知,郑单309高温胁迫7 d 与正常生长条件材料对比组中的40个差异表达代谢物主要富集于精氨酸及脯氨酸代谢,甘氨酸、丝氨酸及苏氨酸代谢,次生代谢产物生物合成,组氨酸代谢,类黄酮生物合成,ABC转运蛋白,嘧啶代谢,氨酰tRNA生物合成,碳青霉烯生物合成,氨基酸生物合成,黄酮和黄酮醇生物合成等KEGG通路。
由表3可知,郑单309高温胁迫14 d 与正常生长条件材料对比组中的40个差异表达代谢物主要富集于精氨酸及脯氨酸代谢,甘氨酸、丝氨酸及苏氨酸代谢,谷胱甘肽代谢,次生代谢产物生物合成,类黄酮生物合成,黄酮和黄酮醇生物合成,戊糖和葡萄糖醛酸相互转化,ABC转运蛋白,烟酸及烟酰胺代谢,半乳糖代谢,色氨酸代谢,类固醇生物合成,嘌呤代谢,赖氨酸降解,萜类化合物、哌啶及吡啶生物碱生物合成等KEGG通路。
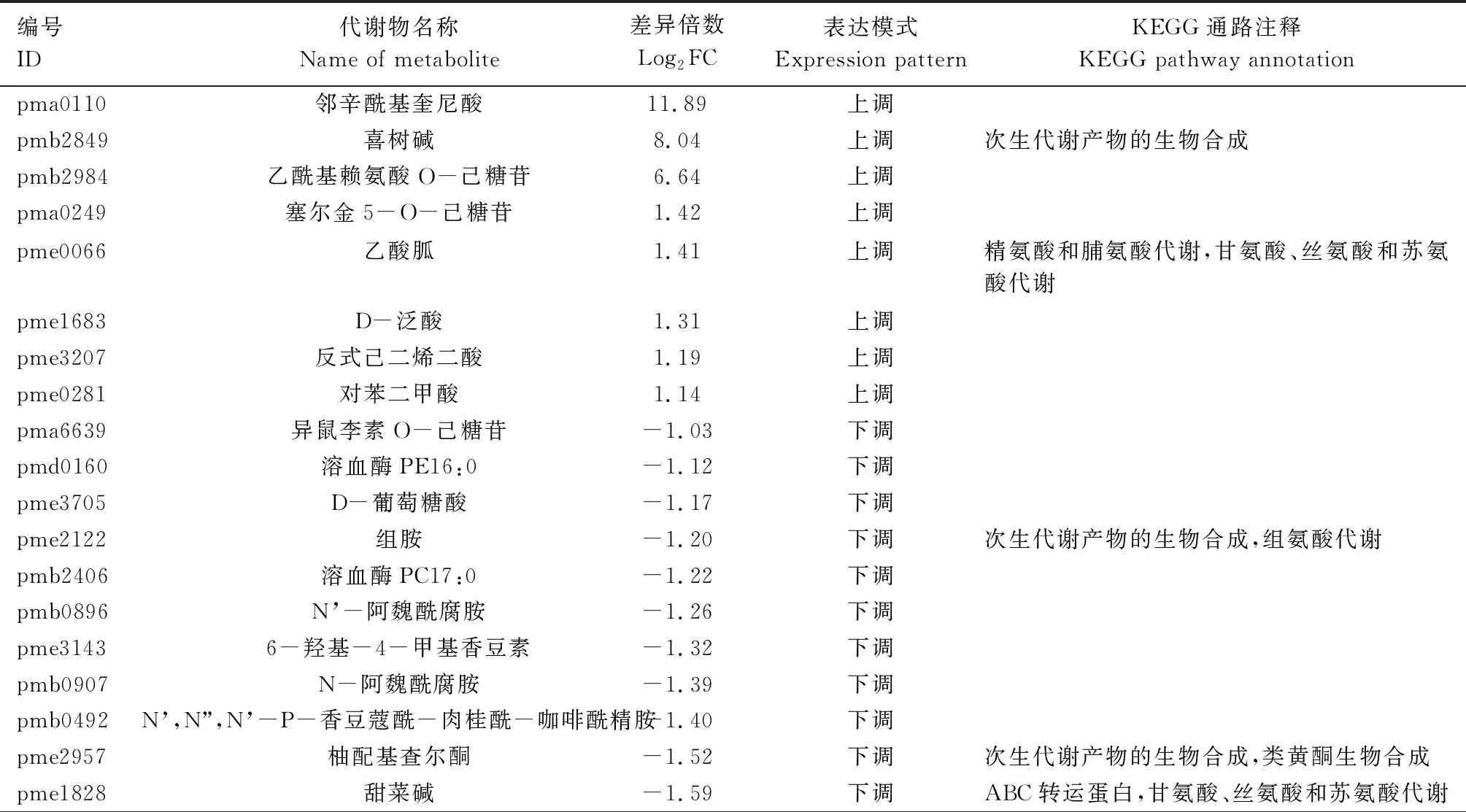
表2 高温胁迫处理7 d与正常条件下郑单309差异表达代谢物KEGG注释结果
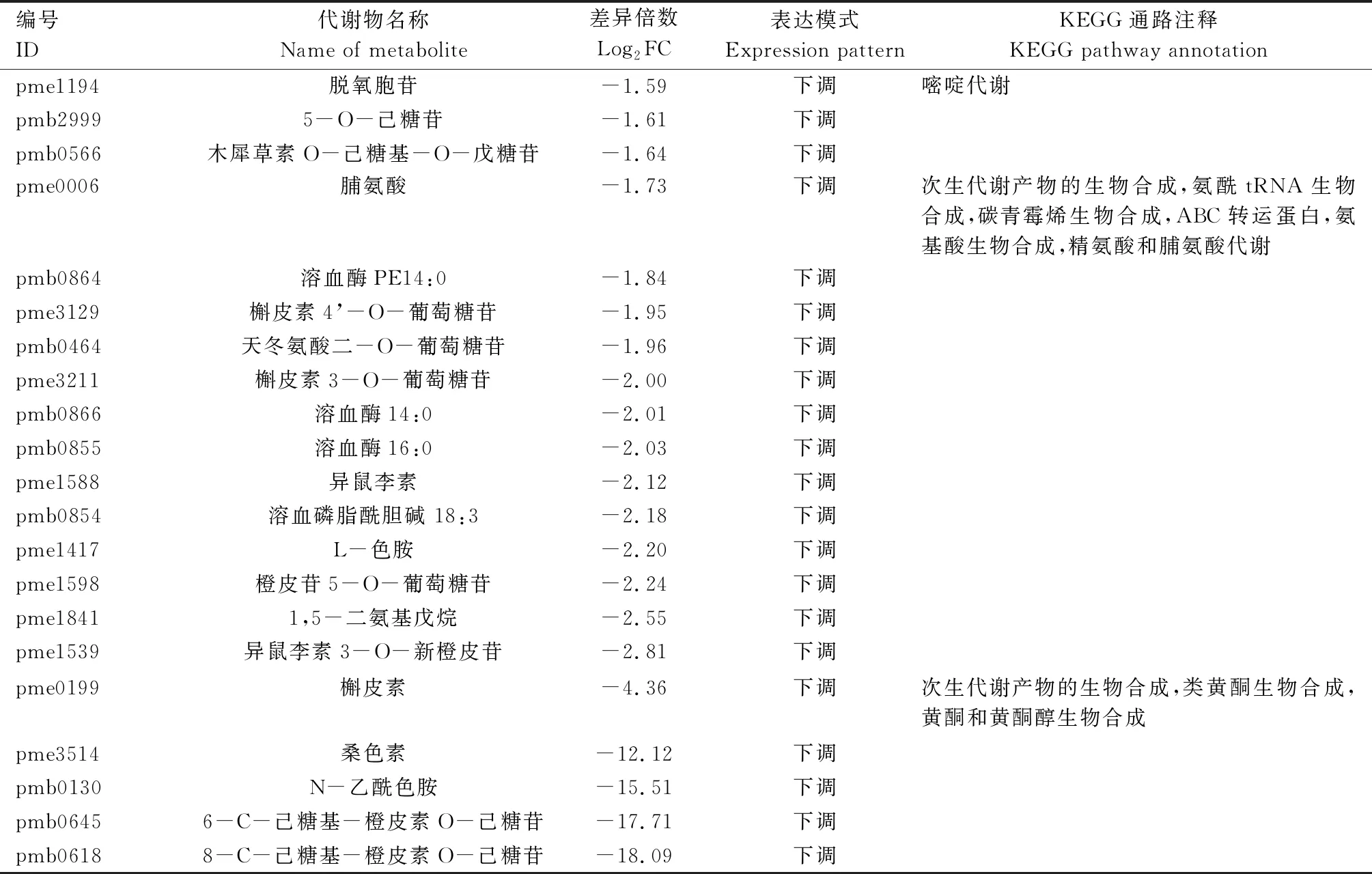
续表2 高温胁迫处理7 d与正常条件下郑单309差异表达代谢物KEGG注释结果
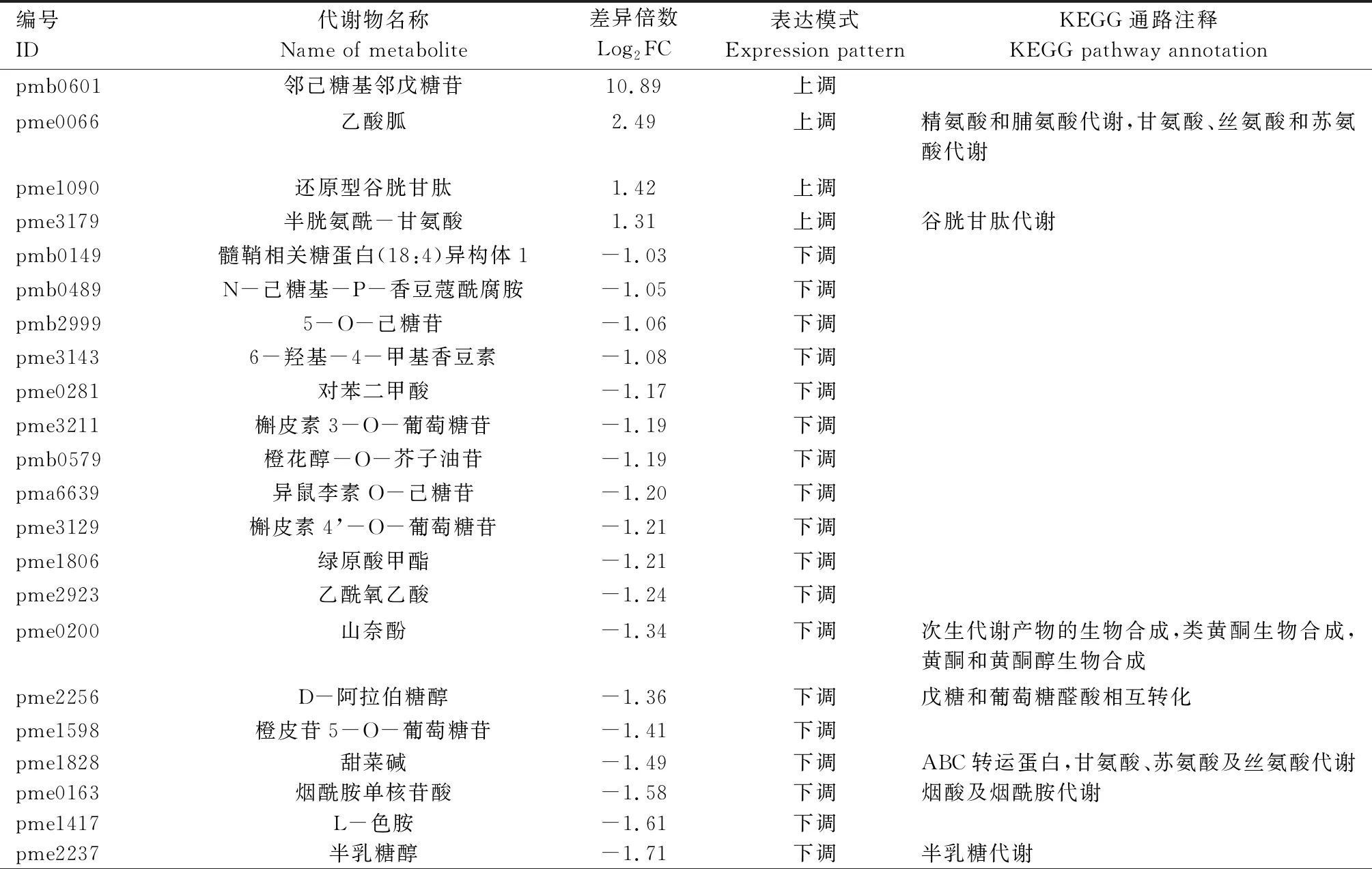
表3 高温胁迫处理14 d与正常条件下郑单309差异表达代谢物KEGG注释结果
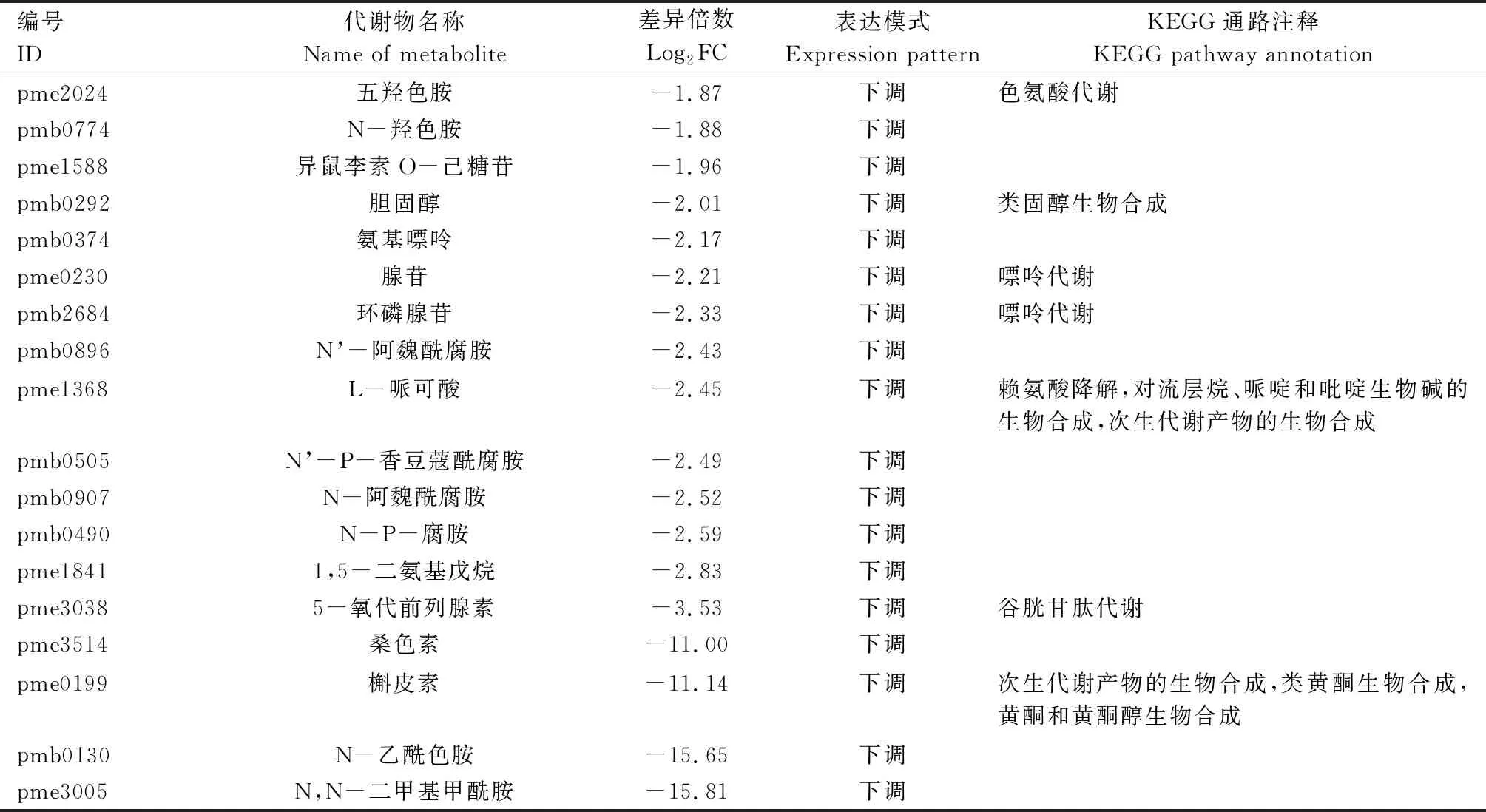
续表3 高温胁迫处理14 d与正常条件下郑单309差异表达代谢物KEGG注释结果
由表4可知,郑单309高温胁迫7 d 与14 d对比组中的46个差异表达代谢物主要富集于次生代谢产物生物合成,葡萄糖甙生物合成,氰氨基酸代谢,对苯二甲酸、哌啶和吡啶生物碱的生物合成,ABC转运蛋白,氨基酸生物合成,缬氨酸、亮氨酸及异亮氨酸降解,缬氨酸、亮氨酸及异亮氨酸生物合成,2-氧羧酸代谢,氨酰tRNA生物合成,丙氨酸、天冬氨酸和谷氨酸代谢,嘧啶代谢,氮代谢,精氨酸生物合成,嘌呤代谢,乙醛和二羧酸代谢,色氨酸代谢,精氨酸和脯氨酸代谢,鞘脂代谢,甘油磷酸代谢,类黄酮生物合成,苯并恶嗪类生物合成,苯丙氨酸、酪氨酸和色氨酸生物合成,苯丙醇生物合成,泛酸盐和辅酶A生物合成,氨基酸生物合成,碳代谢,C5支链二元酸代谢,赖氨酸生物合成,丁酸代谢,牛磺酸代谢,抗坏血酸和醛酸代谢,2-氧羧酸代谢,柠檬酸循环(TCA循环),戊糖和葡萄糖醛酸相互转化,组氨酸代谢,黄酮和黄酮醇生物合成等KEGG通路。
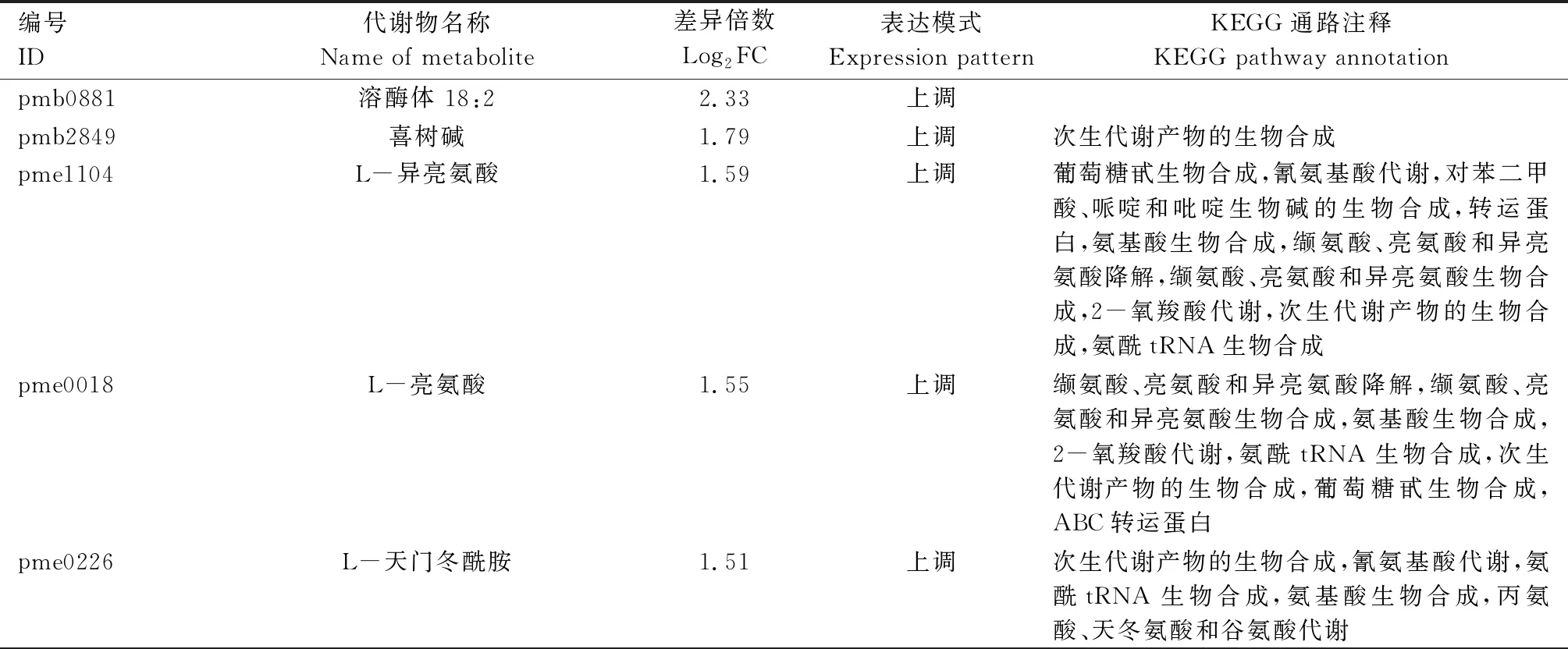
表4 高温胁迫处理7 d与14 d郑单309差异表达代谢物KEGG注释结果
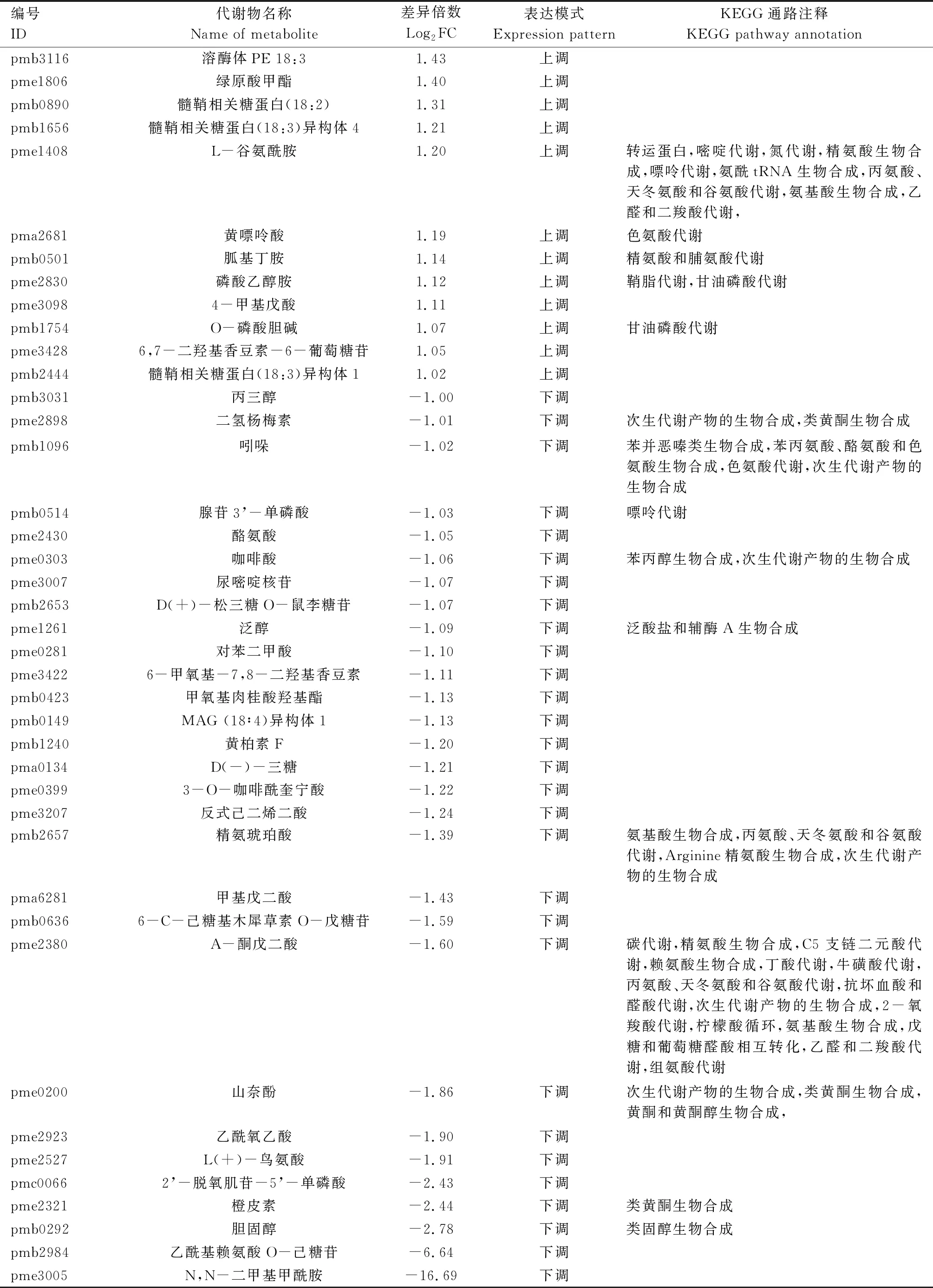
续表4 高温胁迫处理7 d与14 d郑单309差异表达代谢物KEGG注释结果
3 结论与讨论
郑单309是适合河南省夏播的高产玉米品种,在2017年河南省玉米区域试验中,比对照郑单958增产2.2%。本研究对花粒期郑单309高温胁迫处理7 、14 d及正常生长条件下穗位叶进行转录组高通量测序,解析郑单309响应花粒期高温胁迫的分子机制。郑单309高温胁迫7 d与正常生长条件材料对比组中共检测到515个差异表达基因,其中75个为上调表达基因;高温胁迫14 d与正常生长条件材料对比组中共检测到506个差异表达基因,其中114个为上调表达基因。高温胁迫7 d 材料与高温胁迫14 d材料相比,发现2 050个差异表达基因,其中790个为上调表达基因,1 260个为下调表达基因。说明随着高温胁迫处理时间的延长,郑单309在转录水平上有更多的基因表达模式发生变化。高温胁迫7 d与正常生长条件对比组、高温胁迫14 d与正常生长条件对比组、高温胁迫7 d与高温胁迫14 d对比组中只检查到了3个共同差异表达基因Zm00001d022453、Zm00001d025319、Zm00001d038806。Zm00001d022453编码阳离子过氧化酶1,在KOG数据库中分类属于过氧化物。这与前人[25]研究结果一致,即高温胁迫破坏玉米植株生长发育中活性氧产生与清除的动态平衡。活性氧的大量积累可以损伤膜系统,导致电解质流出及细胞生理生化特性发生紊乱。高温逆境下高表达水平的过氧化物可以清除积累的活性氧,从而维持细胞活性。Zm00001d025319编码泛素-蛋白连接酶1,在KOG数据库中分类属于翻译后修饰。而泛素化修饰在高温逆境中起到重要作用,尤其泛素对植物激素的改变,从而改变激素下游重要蛋白质的表达进而影响生长发育。Zm00001d038806编码热激蛋白101。研究发现,植物响应高温胁迫的网络主要包括热激蛋白和热激转录因子组成的植物高温胁迫响应调控网络、氧化胁迫调控网络、锌指蛋白转录因子抗逆响应网络、激素参与的高温胁迫应答机制、高温胁迫下的磷脂信号通路[26]。从而推断Zm00001d038806基因在郑单309应答花粒期高温胁迫网络中起着重要作用。
不同对比组中差异表达基因富集的具体GO分类不同,郑单309高温胁迫7 d 与正常生长条件材料对比组中差异表达基因主要富于中和作用、细胞外区、细胞外区成分、分子功能调控、抗氧化活性5个GO分类。郑单309高温胁迫14 d 与正常生长条件材料对比组中差异表达基因主要富集于电子载体活性、抗氧化活性、节奏过程、细胞外区、中和作用5个GO分类。由此推测,转录组测序检测到的高温胁迫相关差异表达基因主要属于中和作用、细胞外区、抗氧化活性3类GO分类功能。随着高温胁迫时间的延长,郑单309高温胁迫7 d 与14 d对比组中差异表达基因主要富集于电子载体活性、核苷酸、细胞外区、转运蛋白活性、核苷酸结合转录因子活性5个GO分类功能中。不同对比组中差异表达基因主要富集于碳水化合物的运输和代谢、细胞壁/细胞膜/被膜生物合成、通用功能预测系统、信号转导系统4个主要KOG/COG分类。研究发现,花粒期高温胁迫改变籽粒淀粉合成酶的活性,减少淀粉合成减少产量[27]。郑单309植株检测到差异表达基因属于碳水化合物运输和代谢功能,调节籽粒内淀粉的合成,最低程度减少高温对产量的损失。不同对比组中差异表达基因主要富集于植物-病原体相互作用、淀粉和蔗糖代谢、木质素生物合成3个KEGG代谢途经中。
代谢组学分析共检测到654个代谢物,郑单309高温胁迫7 d与正常生长条件材料对比组中检测到40个差异表达代谢物,其中8个上调表达;郑单309高温胁迫14 d与正常生长条件材料对比组中检测到40个差异表达代谢物,其中4个上调表达;随着高温胁迫处理时间的延长,上调表达代谢物减少,下调表达代谢物增加。对苯二甲酸在不同对比组中均差异表达。研究发现,玉米秸秆中存在大量的对苯二甲酸[28],然而对苯二甲酸具体如何在玉米响应高温胁迫中起作用尚需要探索研究。不同对比组中检测到的差异表达代谢物主要富集于精氨酸及脯氨酸代谢,甘氨酸、丝氨酸及苏氨酸代谢,次生代谢产物生物合成,类黄酮生物合成,ABC转运蛋白,嘧啶代谢,黄酮和黄酮醇生物合成7个主要KEGG代谢通路中。

