肝豆状核变性患者肝脏剪切波速度的变化*
齐 端,唐绘卓,阳 静,欧阳飞
肝豆状核变性(hepatolenticular degeneration,HLD)属常染色体单基因隐性遗传性疾病,又称威尔逊病(Wilson’s disease,WD),主要因血清铜蓝蛋白减少致使铜代谢合成障碍致病。流行病学调查显示国内该病较为多见,发病年龄范围较大,青少年高发,男性发病稍多于女性[1]。HLD患者受累最多的部位为肝脏和脑组织,故多数HLD患者首发症状为肝功能异常,与肝组织内铜积蓄有关,而后期病情往往呈进行性进展,最后可能进展为肝纤维化和肝硬化[2]。因此,早期发现HLD患者肝损伤程度,对临床治疗具有较大的指导意义。当HLD患者出现肝功能异常时,超声声像图上可显示肝脏回声弥漫性改变[3]。声辐射力脉冲成像(acoustic radiation force impulse,ARFI)作为近年来推出的一种新型超声成像新技术,可对肝脏组织弹性或硬度进行无创评估,已被证实在肝纤维化早期诊断中具有较高的特异性和敏感性[4,5]。本研究应用ARFI技术观察了HLD患者肝脏剪切波速度,现将结果报道如下。
1 资料与方法
1.1 一般资料 2017年6月~2019年6月我院收治的HLD患者38例,男25例,女13例;年龄15~52岁,平均年龄为(28.0±6.3)岁。符合《肝豆状核变性的诊断与治疗指南》诊断标准[6],伴有锥体外系症状或体征,肉眼或在裂隙灯下可见角膜色素环,血清铜蓝蛋白(ceruloplasmin,CP)低于200 mg/L,或/和血清铜氧化酶活力低于0.2活力单位,24 h尿铜排泄量大于100 μg(1.56 μmol)。排除标准:(1)严重的心、肺、肾等重要脏器功能不全;(2)存在精神疾病或精神障碍者;(3)伴有病毒性肝炎、原发性硬化性胆管炎、自身免疫性肝炎等其他肝病;(4)肝内外恶性肿瘤;(5)妊娠或哺乳期妇女。选择同期我院收治的非HLD肝脏疾病患者49例,男29例,女20例;年龄19~54岁,平均年龄为(28.5±6.4)岁,其中慢性乙型肝炎10例,乙型肝炎肝硬化20例,丙型肝炎肝硬化6例,酒精肝硬化6例,原发性肝癌4例,布加综合征1例,肝囊肿2例。另选择同期入院的健康体检者56例,男32例,女24例;年龄20~55岁,平均年龄为(28.7±6.5)岁。所有健康体检者均无任何器质性疾病,且未发现任何神经系统症状和体征。所有研究对象签署知情同意书,本研究获得我院医学伦理委员会批准。
1.2 超声检查 使用德国西门子公司生产的ACUSON-S2000彩色多普勒超声诊断仪(腹部4 C1凸阵探头,探头频率为2.5~4.6 MHz,机械指数为1.0,系统配备ARFI技术)。所有研究对象于早晨空腹状态下行常规超声检查,扫查肝脏,记录肝脏实质回声。患者再取左侧卧位,行右肋间扫查,选择肝右后叶距肝包膜下约1 cm处为ARFI操作区域,尽可能避开肝动静脉、门静脉等肝内管道结构。固定探头,以使探头垂直于检查部位。嘱研究对象屏住呼吸,启动ARFI成像系统,对肝脏右后叶行声触诊组织定量(virtual touch quantification,VTQ)检测,测量所选区域内的肝脏剪切波速度(shear wave velocity,SWV),于一个屏气周期内连续测量5次,取其平均值,即为SWV,单位为m/s。
1.3 血清检测 采用原子吸收光谱法测定血清铜离子(copper ion,Cu2+)水平(北京博晖创新光电技术股份公司生产的BH5100型多通道原子吸收光谱仪和北京东西分析仪器有限公司试剂);采用免疫透射比浊法测定血清CP水平(德国西门子公司生产的BNP型特种蛋白分析仪和深圳市生科源技术有限公司试剂);采用手工法测定血清铜氧化酶(copper oxidase,sCO)水平(上海钰博生物科技有限公司);采用放射免疫法检测血清Ⅲ型前胶原(type Ⅲ precollagen,PC-Ⅲ)、层黏蛋白(laminin,LN)、Ⅳ型胶原(collagen type Ⅳ,Ⅳ-C)和透明质酸(hyaluronic acid,HA)水平(美国Bio-Rad公司生产的Bio-Rad550型酶标仪和北京华夏远洋科技有限公司试剂)。
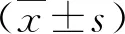
2 结果
2.1 三组血清铜有关指标比较 HLD患者血清Cu2+和CP均显著低于非HLD或健康人(P<0.05,表1)。
2.2 三组血清肝纤维化指标比较 HLDPC-Ⅲ、Ⅳ-C、LN、HA水平均显著高于健康人,低于非HLD(P<0.05,表2)。
2.3 HLD患者超声声像图表现 见图1。
2.4 三组SWV值比较 HLD组SWV值为(1.9±08.2)m/s,非HLD组为(2.2±0.3)m/s,健康人为(1.1±0.2)m/s,差异有统计学意义(F=296.750,P=0.000)。

表1 三组血清铜有关指标比较
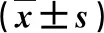
表2 三组血清肝纤维化指标比较

图1 HLD患者超声声像图表现
3 讨论
HLD作为一种常染色体隐性遗传性疾病,主要因为铜代谢异常,其致病基因ATP7B定位于染色体13q14.3,编码P型三磷酸腺苷酶铜离子转运蛋白,参与体内铜转运代谢[7,8]。AIP7B基因突变致三磷酸腺苷酶功能减弱或丧失,导致血清CP合成减少,引起铜转运蛋白合成障碍或溶酶体缺陷,促使通过胆管排泄的铜离子发生障碍,肠管吸收的铜显著增多,而体内溶酶体缺乏,蓄积于体内的铜离子于脑组织、肝脏、角膜等处沉积,诱发一系列临床症状[9]。多数HLD患者首发部位为肝脏病变,主要以肝损害为主,症状表现轻重不一。在超声引导下行肝脏组织学穿刺活检是诊断该病的金标准,但因淤积的铜在肝内沉积呈不均匀分布,故该病早期肝组织学活检可能出现假阴性结果[10]。近年来,ARFI技术被广泛用于临床,其基本原理为组织受探头发射的声脉冲形成机械应力,出现纵向压缩和横向振动,而受组织硬度的影响导致组织位移不同。通常,组织硬度越高,位移越大。采用传统连续声束追踪方法量化剪切波传播速度,用量化速度值代表组织硬度,可间接判断肝脏硬度,能很好地反映肝脏质地[11,12]。
本研究结果显示,HLD患者肝脏SWV值显著高于健康人,但显著低于非HLD的慢性肝病患者。根据HLD患者二维超声声像图表现的不同,可将其分为脂肪肝型、星光型、树枝状、岩层状和结节状,这些特征有助于识别特征性的病变[13-15]。
本研究结果显示,HLD患者血清Cu2+和CP水平显著低于非HLD患者和健康人,HLD和非HLD患者sCO水平显著低于健康人,提示HLD患者铜代谢障碍明显。目前,研究发现HLD的发病与铜代谢障碍有关,血清CP减少是HLD的关键诱因,伴有胆管排泄障碍、溶酶体缺陷、肠管内铜吸收增多、金属巯蛋白基因或调节基因异常等[16]。机体内Cu2+代谢机制是在于ATP7B酶作用下,6个Cu2+与1个CP前体合成CP,并释放入血,而HLD患者ATP7B酶基因缺失,致使CP合成障碍,肝脏组织中Cu2+大量蓄积,促使血液Cu2+和CP明显减少[17,18]。sCO表示CP酶的活性,与CP含量比较,其能更好地反映机体内Cu2+代谢的活力状态,而HLD患者sCO显著低于正常人,可帮助诊断HLD。
本研究结果显示,HLD患者血清PC-Ⅲ、Ⅳ-C、LN和HA水平均显著高于健康人,但低于非HLD患者,提示HLD患者可能已经出现肝纤维化。HLD累及到肝脏时,最终会出现肝纤维化[18,19]。临床上,应用血清PC-Ⅲ、Ⅳ-C、LN和HA水平变化协助诊断肝纤维化,其中PC-Ⅲ反映肝纤维化积蓄的敏感性较高,而Ⅳ-C和LN与肝组织汇管区和小叶内炎症明显相关,且与肝纤维化程度一致。有研究表明,慢性乙型肝炎进展至肝纤维化阶段,采用ARFI技术测量肝脏SWV值,发现肝脏SWV值与血清PC-Ⅲ、Ⅳ-C、LN和HA均呈正相关,证实肝脏SWV值能反映慢性乙型肝炎患者肝纤维化程度[20]。本研究发现,HLD患者血清PC-Ⅲ、Ⅳ-C、LN和HA水平低于包括慢性乙型肝炎在内的普通慢性肝病患者,预示本组HLD患者肝纤维化程度可能较轻。因肝细胞内铜蓄积量不断增加,肝细胞逐渐变性坏死,纤维组织增生,肝硬化进程才进展。

