川芎嗪对脂多糖诱导的人脐静脉内皮细胞高通透性的保护作用研究
张云霄,任 婷,叶苗苗,王元元,陶 静,李 言
肺微血管内皮细胞作为保护肺脏的第一道门户,其屏障功能在其中发挥着至关重要的作用。在感染性疾病诱发的急性肺损伤(ALI)时,脂多糖(lipopolysaccharide,LPS)引起肺内微血管内皮细胞与中性粒细胞黏附增加以及巨噬细胞细胞炎症因子的释放,细胞骨架相关信号通路被激活,下游肌动蛋白细胞骨架重构,从而导致内皮细胞损伤继而引发肺内微血管内皮屏障破坏。因此,通过LPS建立在体或离体炎症模型[1-2]成为研究ALI的常用实验方法。
Ras相关的C3肉毒素底物1(ras-related C3 botulinum toxin substrate 1,Rac1)是小G蛋白家族成员之一,其活性形式Rac1-GTPase能够对细胞骨架的调节产生重要影响。Rac1通过作用下游靶点cAMP依赖的蛋白激酶A(PAK)激活LIM激酶(LIMK)[3],LIMK通过磷酸化抑制丝切蛋白(cofilin)诱导的肌动蛋白解聚,间接促进肌动蛋白应力纤维形成、细胞骨架重构,继而引发细胞通透性的改变[4]。川芎嗪(tetramethylpyrazine,TMP)的化学成分是四甲基吡嗪,主要来源于中国传统中药川芎的根茎提取物,可以通过抑制炎症反应减轻机体脓毒症症状[5],临床上广泛应用于扩张血管、改善微循环等方面[6]。课题组前期实验研究发现TMP可以降低通路中相关蛋白的表达来减弱LPS对内皮细胞骨架的损伤[7]。但是TMP对于Rac1/LIMK1信号通路上游分子的调控机制并不确定。为此本实验通过检测TMP在人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)体外模型上引起的通透性的改变,以明确TMP对LPS诱导损伤血管内皮细胞后通透性升高的改善情况;Western blotting检测Rac1/LIMK1信号通路相关蛋白表达情况;从分子水平探讨Rac1/LIMK1信号通路是否参与LPS诱导的内皮细胞损伤,探讨TMP干预Rac1/LIMK1信号通路的具体分子学机制。
1 材料与方法
1.1 主要试剂及材料 健康足月剖宫产新生儿脐带,标本取自蚌埠医学院第一附属医院产科(均征得产妇同意);盐酸TMP(中国食品药品检定研究院);LPS(0111美国SIGMA公司);ECM培养基(ScienCell公司);胰酶、4%多聚甲醛(Biosharp公司);基质胶(CORNING公司);FITC标记葡聚糖(美国SIGMA公司);Transwell培养板(CORNING公司);Rac1活性检测试剂盒、LIMK1、p-LIMK1抗体(Abcam公司);β-actin(ABclonal公司)。
1.2 实验方法
1.2.1 HUVECs原代培养以及传代培养 无菌条件下,取约15 cm的新生儿脐带,37 ℃预热的PBS冲洗3次。注入预热的0.25%胰酶消化液15~20 mL,置37 ℃培养箱中孵育4~6 min,充分消化脐静脉内皮。收集消化液,用ECM完全培养基冲洗脐静脉管腔,收集胰酶-ECM培养基混合液于离心管,1 000 r/min离心10 min,弃上清液。加入3 mL完全培养液,用吹打管吹打均匀,按1×105个接种于25 cm2培养瓶,置于5%CO2、37 ℃培养箱中培养3~5 d,达到70%~80%融合后,弃去培养瓶中的旧培养液,0.25%胰酶消化、传代培养,经Ⅷ因子抗体免疫组织化学鉴定为血管内皮细胞后,将2~3代用于实验。
1.2.2 内皮细胞鉴定 用ECM不完全培养基稀释的基质胶(1∶8)包被六孔板内的无菌盖玻片,PBS冲洗3次晾干待用;取2~3代对数生长期的HUVECs,0.25%胰酶消化并1 000 r/min离心5 min,ECM培养基重悬细胞并计数,以每孔3×105个细胞接种于盖玻片上;37 ℃细胞培养箱内培养,细胞融合80%以上程度时弃去旧培养基,PBS冲洗2次,冷丙酮固定10 min;PBS冲洗2次,3%H2O2常温孵育30 min;PBS冲洗2次,加入1∶100Ⅷ因子兔抗人抗体,4 ℃湿盒内孵育12 h;PBS冲洗2次,滴加山羊抗兔IgG,常温孵育20 min;混合DAB试剂盒内A、B、C液各1滴于1 mL PBS缓冲液中,常温染色20 min,PBS缓冲液清洗2次;苏木精复染5 min;无水乙醇脱水2次,每次2 min;二甲苯透明2次,每次2 min;中性树胶封片;显微镜下观察并采集图像。
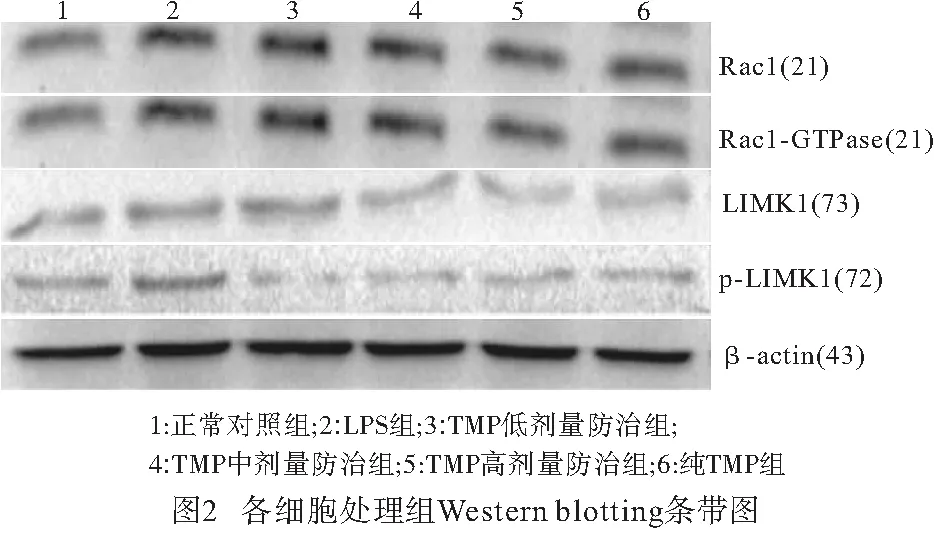
1.2.3 细胞分组 正常对照组(不做药物及损伤处理)、LPS组(LPS 1 μg/mL作用12 h)、TMP低、中、高剂量防治组(TMP终浓度分别为60、120、240 μg/mL作用12 h后+LPS 1 μg/mL继续作用12 h)、纯TMP组(TMP 240 μg/mL作用24 h)。
1.2.4 HUVECs体外模型的构建及通透性检测 Transwell上构建HUVECs单层模型:Transwell板由上、下室两部分构成。上室底是由透明聚酯薄膜构成(孔径0.4 μm),下室是24孔培养板。细胞按5×103接种在Transwell上室滤膜,滤膜提前12 h铺被ECM不完全培养基稀释的基质胶(1∶8)包被处理,培养4~5 d待细胞完全融合为单层后进行药物干预分组处理。在Transwell上室加入用ECM不完全培养基配制的异硫氰酸萤光素-右旋糖酐(FITC-Dextran)溶液(500 μg/mL)100 μL,在Transwell下室加入ECM不完全培养基600 μL,在37 ℃、5%CO2细胞培养箱内孵育1 h后,从每个嵌套小室上层和下层分别取液100 μL,加入黑色96孔板中,用Synerge Ⅱ多功能酶标仪(BioTek公司,美国)测定Transwell小室上下双层液体中的荧光强度值,激发光波长495 nm,发射光波长520 nm。内皮细胞单层对右旋糖苷通透性的大小用通透系数(Pa)表示,计算公式为:Pa=(下室荧光强度值)×(下室液体体积)/FITC孵育时间(s)/滤膜面积(cm2)/上室荧光强度值。实验结果以Pa%表示,Pa%=(实验样品组Pa/实验对照组Pa)×100%。
1.2.5 体外模型的跨内皮细胞电阻值(TEER)测定 将RE1600上皮细胞电压电阻仪的两片电极分别置于滤膜表面及滤膜下,12只Transwell上室加入ECM完全培养基200 μL,下室加入ECM完全培养液1 000 μL,用RE1600上皮细胞电压电阻仪测量每个Transwell小室的基础电阻值,Transwell上室接种细胞悬液后,分别在12、24、36、48、60、72、84、96、108、120 h测量电阻值,TEER按以下公式计算:TEER(单位:Ω×cm2)=(内皮细胞电阻值-基础电阻值)×Transwell上室滤膜的底面积(0.33 cm2),然后绘制TEER-时间曲线。当TEER达到标准值并稳定后,上室内更换为相应实验培养液,下室内更换为ECM完全培养基。置CO2培养箱。在加入干预因素后0、12和24 h测定各孔的TEER值,并绘制各组TEER值变化曲线。
1.2.6 各组细胞蛋白表达检测实验
1.2.6.1 细胞分组与蛋白收集 根据Rac1活性检测试剂盒说明书,将2~3代HUVECs接种于细胞培养瓶中,待细胞融合90%以上作分组药物干预(分组情况同通透性检测实验),每个细胞培养瓶中加入1 mL 1× Assay Buffer-蛋白酶抑制剂混合液(1 000∶1),冰上裂解20 min;收集混合液,1 000 r/min离心5 min;取上清液至新EP管中;BCA法定量各组上清液中蛋白含量,2 000 μg/mL。
1.2.6.2 Rac1-GTPase下拉实验 取500 μL各组蛋白上清样品,1×Assay Buffer调节体积至1 mL;取40 μLPAK1 PBD琼脂糖珠浆液加入各组蛋白样品中;4 ℃震荡孵育1 h;19 ℃ 14 000 r/min离心10 s,沉淀琼脂糖珠;吸出上清液转移至新的EP管中;500 μL 1× Assay Buffer洗涤琼脂糖珠3次,每次离心后小心吸出上清液,保留珠粒沉淀;将珠粒沉淀重悬于40 μL SDS-PAGE蛋白上样缓冲液(2×)中,混匀后快速离心10 s,蛋白样本于PCR仪中95 ℃ 5 min加热变性。所得样品直接Western blotting检测。
1.2.6.3 Western blotting检测各组细胞蛋白表达 制作SDS-聚丙烯酰胺凝胶,每孔加入30 μg蛋白样品,经Bio-Rad电泳仪进行电泳,转膜,5%BSA封闭1~2 h,TBST稀释一抗(Rac1 1∶1 000、LIMK1 1∶1 500、p-LIMK1 1∶1 500、β-actin 1∶10 000)4 ℃孵育过夜,TBST液洗膜20 min后二抗孵育1 h,再经TBST洗膜30 min;最后加入显影液上机曝光检测目的蛋白相对表达量。
1.3 统计学方法 采用方差分析和q检验。
2 结果
2.1 正常HUVECs形态学观察以及细胞鉴定结果 使用0.25%胰酶灌注成功将HUVECs消化下来,12 h后倒置显微镜下观察发现大多数细胞处于贴壁状态,亮空泡状的无活性细胞较少(见图1A)。原代培养4 d后观察内皮细胞融合为单层,密度可高达90%以上,细胞形态呈饱满的不规则铺路石状紧密排列(见图1B)。镜下观察细胞质内大量黄褐色颗粒聚集于细胞核周围(见图1C),Ⅷ因子相关抗原蛋白呈阳性表达,可证明培养的细胞为内皮细胞。
2.2 各组细胞通透性检测结果 与正常对照组相比,LPS组Pa升高明显(P<0.01);与LPS组相比,3组TMP防治组Pa呈下降趋势(P<0.05~P<0.01),并且具有一定的浓度依赖性(见表1)。

表1 各组间内皮细胞单层通透性比较

2.3 TEER测定结果 细胞接种Transwell小室12 h内,TEER值受细胞贴壁影响明显升高,12~84 h这一阶段细胞TEER值呈稳定趋势增长[12、24、36、48、60、72 h分别为4.59±0.53、5.69±0.10、6.58±0.51、7.63±0.60、9.01±0.19、(10.28±0.60)Ω×cm2],84 h后细胞TEER值增长明显减缓[84、96、108 h分别为12.55±0.19、13.54±1.26、(13.60±0.33)Ω×cm2](F=189.042,P<0.05,MS组内=0.301)。LPS作用12 h时,与正常对照组相比,LPS组TEER值显著性降低(P<0.05);与LPS组相比,TMP中、高剂量防治组TEER显著升高(P<0.05~P<0.01)(见表2)。

表2 LPS作用12 h前后各处理组TEER值变化情况比较
2.4 各处理组细胞蛋白样品中目的蛋白表达情况 与正常对照组比较,LPS组Rac1-GTPase、Rac1、LIMK1、p-LIMK1蛋白表达均明显上调(P<0.01);TMP高剂量防治组与LPS组比较,Rac1-GTPase、Rac1、LIMK1、p-LIMK1蛋白表达均明显下调(P<0.05~P<0.01)(见图2、表3)。
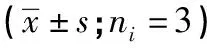
表3 各组Rac1-GTPase、Rac1、LIMK1、p-LIMK1蛋白相对表达量比较
3 讨论
内皮细胞是血管表面与血液和组织之间形成的一道单层界面,是调节血管渗透的一道重要屏障[8],肺微血管内皮细胞受损作为ALI发病的最初环节,可以继发导致肺微血管内皮细胞屏障功能受损,从而引起肺泡毛细血管壁通透性增加。而这种内皮屏障功能对维持循环稳定以及组织器官正常功能具有重要意义[9]。内皮细胞或是其他种类的真核细胞,其完整的细胞形态都离不开细胞骨架架构出的一道复杂且严谨的立体网状结构。当细胞受到LPS刺激时,细胞骨架相关信号通路被激活,导致细胞骨架相关蛋白表达发生变化,细胞骨架重构,最终导致内皮细胞通透性增高。
测定TEER以及荧光标记大分子物质通透性是检测内皮细胞屏障系统的常用方法。使用这2种方法联合检测可以减少人为因素的干预以及细胞早期通透性变化信息的丢失[10]。我们选择用基质胶提前包被内皮细胞的体外生长环境模拟细胞-基底膜的黏附连接,通过检测内皮细胞时间-TEER值的变化判断细胞的融合情况,对细胞间紧密连接完整性进行评估。在接种细胞84 h后TEER值增长速度明显减慢进入“平台期”,细胞发生接触抑制。但是细胞TEER值进入“平台期”的时间节点会随着细胞接种数目的增多而相应的缩短。LPS作用之前,各组细胞TEER值没有显著性差异,加入LPS作用12 h后,与正常组相比,LPS组TEER值下降明显。国内外相关研究[7,11]发现TMP在抗炎、内皮细胞保护等方面具有良好的效果,我们在内皮细胞体外模型中加入不同剂量的TMP(60、120、240 μg/mL)进行预保护处理,结果发现,与LPS组相比,TMP中、高剂量防治组TEER值显著升高。另外,在各组细胞对FITC-葡聚糖的通透系数百分比Pa检测实验结果中发现,LPS组Pa较正常组明显增高;TMP低、中、高剂量防治组Pa较LPS组相比呈不同程度降低。可以说明LPS对内皮细胞屏障造成较明显破坏,而TMP在改善LPS对内皮细胞屏障的破坏上发挥了积极的作用。
Rac1是细胞骨架相关通路中重要的上游分子,作为小G蛋白家族成员之一,能够与GTP/GDP结合,对下游信号通路产生on/off效应[12]。Rac1-GTPase还可以通过作用下游靶点PAK1激活LIMK。关于LIMK1对细胞骨架,涉及到的比较经典的两个通路是Rac1/PAK/LIMK1/Cofilin信号通路以及RhoA/ROCK/LIMK1/cofilin信号通路。LIMK1是磷酸化cofilin的重要激酶,LIMK1的活性形式p-LIMK1可以将cofilin N端第三位丝氨酸磷酸化,p-cofilin为cofilin的失活态,从而cofilin诱导的肌动蛋白解聚减少,聚合态的肌动蛋白增加,引起细胞骨架重构[13]。WOO等[14]在LPS诱导的大鼠成纤维细胞中发现LPS引起Rac1激活,并且呈时间依赖性。在我们的Western blotting实验检测中发现,LPS组较正常组Rac1-GTPase活性蛋白表达上调,并且TMP高剂量保护组中Rac1-GTPase活性蛋白表达较LPS组下降。对各组总蛋白的Western blotting检测发现,LPS组较正常组p-LIMK1蛋白表达升高,TMP中、高剂量保护组较LPS组的p-LIMK1蛋白表达则出现下调,结合上述通透性实验相关数据可以说明TMP对LPS诱导的内皮细胞屏障功能损伤的保护作用可能与其下调Rac1/LIMK1信号通路中Rac1-GTPase活性蛋白、LIMK1磷酸化蛋白表达有关。对于TMP是否参与其他骨架蛋白相关信号通路的调节有待进一步研究证实。

