C反应蛋白与前白蛋白比值在评估胃癌病人预后中的临床价值
马亚辉,杨 琪,朱洪波,刘冬良
中国的癌症发病率和死亡率一直在上升,癌症现已成为自2010年以来的主要死亡原因[1]。胃癌是一种预后不良的肿瘤,国外一项大数据研究[2]表明病人的5年生存率仅为25%。而在日本和韩国,由于拥有完善的筛查程序,大部分胃癌病人能够得到早期诊断,生存率得以提高[3-4]。胃癌预后相关的因素一直是临床关注的重点问题。自1863年,VIRCHOW首先发现了炎症与癌症之间的关系,随后,越来越多的学者开展了相关研究[5-8]。应用TNM分期和炎症指数的结合可以更好地预测胃癌病人的预后。LIU等[9]发现C反应蛋白/白蛋白(CRP/ALB)在预测胃癌的长期存活方面优于传统的炎症指标。前白蛋白(PA)是主要在肝脏中合成的54 000蛋白质。其主要功能是运输甲状腺素,间接运输维生素A(它作为视黄醇结合蛋白的载体蛋白)。PA是一种快速代谢的内脏蛋白,其半衰期(近2 d)比ALB短得多。此外,PA早期受到蛋白质平衡急剧变化的影响,并且比ALB对营养状况的反应更快[10]。有研究表明,PA作为单一参数,可用于评估蛋白质能量营养不良,对癌症手术后的结局和复发有重要指导意义[11-12],并且是恶性肿瘤病人预后的独立预测因子[13-14]。根据上述理论基础,我们假设PA可以替代ALB与CRP结合以构建新的炎症指数:CRP/PA,这在临床上鲜见报道。本研究根据临床数据来研究CRP/PA在预测胃癌预后中的价值,为临床提供参考。
1 资料与方法
1.1 研究对象 收集2012-2013年在我院胃肠外科经根治性手术治疗(毕罗Ⅱ式,D2 清扫)的胃癌病人,手术均由同一外科手术组完成,所有病人术后均行铂类联合5-氟尿嘧啶(5-Fu)方案化疗。本研究共纳入符合标准病人214例。本研究通过医院医学伦理委员会批准,所有病人均签署相关知情同意书。
研究对象纳入标准:(1)首次确诊为胃癌,且不合并其他肿瘤;(2)术前至少2周未使用任何种类抗生素、非甾体类抗炎药;(3)未接受过任何形式的抗肿瘤治疗;(4)本研究包含的临床资料及随访数据完整。排除标准:(1)胃癌复发和再发病例;(2)合并其他部位原发肿瘤;(3)合并血栓;(4)合并其他严重疾病,非癌性死亡病人。
1.2 资料收集 收集所有病人的临床病理资料,包括年龄、性别、体质量指数(BMI)、空腹血糖、血红蛋白、PA、肿瘤部位、肿瘤分化程度、肿瘤大小、肿瘤分期等。采用美国癌症联合会(AJCC)第七版 TNM 分期方法进行病理分期[15]。
1.3 随访 查询病人的原始病历,获得病人的一般临床资料、入院后的血生化指标、围手术期并发症及病理资料,通过电话随访或门诊方式调查病人术后的预后情况。病人的生存时间按月计算,随访至病人因为胃癌死亡,或时间截至2018年12月。
1.4 统计学方法 采用t检验、χ2检验,生存分析采用Kaplan-Meier法,多变量分析采用Cox比例风险回归模型。
2 结果
2.1 CRP/PA与CRP/ALB预测胃癌病人预后的价值 214例病人的CRP/PA值范围为(0.33~45.21)×10-3,CRP/ALB值范围为(2.37~307.5)×10-3,根据5年生存作为终点分别绘制两者的ROC曲线(见图1)。计算CRP/PA与CRP/ALB的曲线下面积AUC值分别为0.704(95%CI:0.637~0.764)与0.656(95%CI:0.588~0.719)。CRP/PA的预测价值高于CRP/ALB(z=2.21,P<0.05)。当CRP/PA值为18.8×10-3时,Youden指数最大,灵敏度为0.828,特异度为0.562;以18.8×10-3作为分界值,将≤18.8×10-3作为低CRP/PA(LCP)组(129例),>18.8×10-3为高CRP/PA(HCP)组(85例)。

2.2 胃癌病人CRP/PA水平与临床病理特征的关系 2组病人性别、BMI、肿瘤部位、肿瘤分化程度、空腹血糖差异均无统计学意义(P>0.05),年龄、贫血、肿瘤直径、浸润深度淋巴结转移、TNM分期在2组病人之间差异均有统计学意义(P<0.05~P<0.01)(见表1)。

表1 CRP/PA与临床病理资料的关系
2.3 胃癌病人CRP/PA水平与并发症的关系 214例病人中共有62例病人出现并发症,并发症的发生率为28.9%,包括切口液化或感染6例,切口裂开1例,吻合口瘘5例,腹腔感染6例,肺部感染28例,胸腔积液10例,呼吸衰竭1例,心力衰竭1例,淋巴漏4例,所有病人经治疗后均顺利出院。HCP组并发症发生率37.64%(32/85)高于LCP组的发生23.26%率(30/129)(χ2=5.16,P<0.05)。
2.4 胃癌病人预后的影响因素 在最长60个月的随访周期内,共有125例病人死亡,13例病人失访,所有病人5年累积生存率为35.5%。病人的中位生存时间是43个月。HCP组和LCP组病人的5年累积生存率在分别是29.4%和46.3%。LCP组病人5年生存率高于HCP组的病人(χ2=5.86,P<0.05)(见图2)。由于肿瘤TMN分期包括浸润深度及淋巴结转移,只研究TMN分期,通过Cox比例风险模型进一步分析发现,CRP/PA水平、TNM分期是胃癌病人术后的独立预后因素(P<0.01)(见表2)。

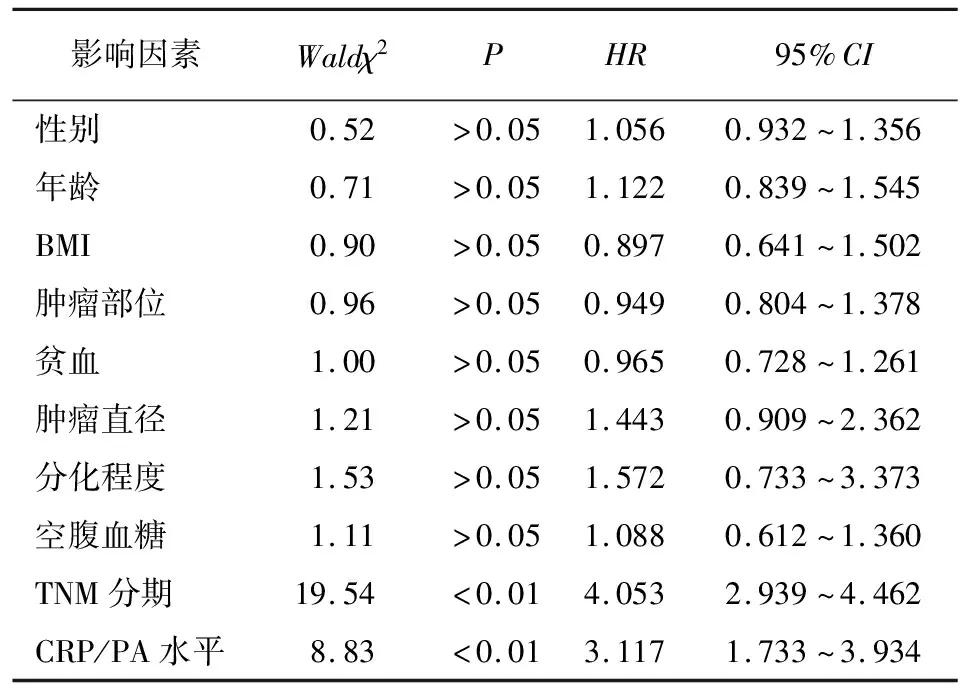
表2 胃癌病人总生存率的COX比例风险模型多因素分析
3 讨论
胃癌是一种消化道恶性肿瘤,位居癌症发病率第四高,也是癌症死亡的第二大原因(占癌症死亡人数的10.4%)[2]。手术仍然是成功治疗的主要方法,但由于早期胃癌的表现症状不明显,大多数病人发现时已处于中晚期,预后较差。在胃癌的诊疗过程中对于病人预后的判断不是一件容易的事,在实际操作中,由于胃癌存在很大的异质性,即使具有相同的危险因素,不同个体的预后仍有很大差异,为了及时判断胃癌病人的病情,依据病人的预后选择合适的治疗方案有重要的临床意义。
肿瘤诊断时的TNM分期(肿瘤浸润深度、淋巴结转移和远处转移)是用于评估预后和预测可切除胃癌中全身治疗需求的最重要工具[16]。TNM系统描述了肿瘤的大小和浸润深度、癌细胞是否已扩散到淋巴结以及癌症是否已扩散到身体的不同部位。目前临床普遍使用的主要分类是由美国癌症联合委员会(AJCC)和国际抗癌联盟(UICC)开发的肿瘤分期系统以及日本分期系统,而日本分期系统更加详细,基于解剖学基础,更加侧重于淋巴结情况[15,17]。尽管广泛使用TNM分期来评估胃癌病人的预后,特别是淋巴结的数量作为不良预后因素,但在相同肿瘤阶段的病人之间预后通常不同。因此,除TNM分期外,还应该研究其他一些影响因素提高预后分层的准确性。
一些炎症指标,如中性粒细胞-淋巴细胞比率(NLR)、系统免疫炎症指数(SII)、血小板-淋巴细胞比率(PLR)在癌症诊疗中的应用价值已得到证实[6-8]。中性粒细胞计数的增加可能是由于未成熟和无功能的中性粒细胞数量的增加,相对比淋巴细胞比例减少,随之而来的是淋巴细胞介导的对肿瘤的免疫应答较弱[18]。癌症相关炎症的特征包括炎症细胞的浸润和肿瘤组织中炎症因子的产生,组织重塑,组织修复和血管生成从而促进恶性肿瘤的进展和转移[19]。以前的研究表明,在炎症反应中,身体通过合成大量细胞因子作出反应,这些因素包括白细胞介素和肿瘤坏死因子,这些因子可下调、降低ALB和PA的血浆浓度[20],营养不良与免疫功能的降低密切相关,这会削弱身体的抗肿瘤免疫力。CRP/ALB值对于预测胃癌的预后有重要的价值[9]。但由于ALB半衰期长(近20 d),特别是在围手术期,急性蛋白质营养不良可降低ALB的敏感性。PA是一种快速代谢的内脏蛋白,其半衰期(近2 d)比ALB短得多,早期受到蛋白质平衡急剧变化的影响,并且比ALB对营养支持的反应更快[10]。在我们的研究中,我们用PA与CRP结合以构建新的炎症指数CRP/PA,并与CRP/ALB相比较,我们根据5年生存作为终点分别绘制两者的ROC曲线,计算CRP/PA与CRP/ALB的曲线下面积AUC值分别为0.704与0.656,通过z检验发现CRP/PA的预测价值高于CRP/ALB(z=2.213,P=0.026 9)。通过生存分析结果显示CRP/PA是影响胃癌病人预后的独立危险因素,低CRP/PA组病人的5年生存率高于高CRP/PA组的病人,说明低CRP/PA组病人预后优于高CRP/PA组的病人,与其他研究[21]结果相似。
胃癌手术的术后并发症导致多种不良事件,包括住院时间延长,医疗费用增加和辅助化疗延迟,最终导致病人预后恶化。文献[21]报道,胃癌的预后可能受到由并发症引起的延长的炎症反应的影响,即使在病理性治愈性切除术后,肿瘤细胞仍可能在数年后复发。还有文献[19]报道胃癌术后严重并发症炎症反应与宿主免疫抑制有关。本研究214例病人中共有62例病人出现并发症,并发症的发生率为28.9%,分组比较,高CRP/PA组的并发在发生率显著高于低CRP/PA组(37.1%和23.1%,P<0.05)。而CRP/PA值的升高与高CRP及低PA有关,这与国外研究[11]相似。我们假设如果我们在手术前提供营养支持的潜在干预以及控制病人的全身炎性反应,可以降低术后并发症风险。这个结果具有特别重要的意义,因为对于术后并发症的其他危险因素,并不是我们容易改变的。
我们目前的研究仍存在一些局限性,首先,这是一项样本量较小的单中心研究,其次,缺乏基础研究来探索CRP/PA如何参与影响胃癌预后的详细机制。
综上所述,本研究中CRP/PA水平、TNM分期是影响胃癌病人预后的独立因素,处于CRP/PA高值水平的病人术后并发症发生率会增加,预后差。

