固有淋巴细胞比例失衡与类风湿关节炎的相关性
方玮婷,张媛媛,秦贻,陈竹
类风湿关节炎(rheumatoid arthritis, RA)是一种以累及外周关节为主、以慢性侵蚀性滑膜炎为特征的系统性自身免疫性疾病[1]。近年研究发现,固有免疫系统参与了RA的发病机制[2]。固有淋巴细胞(innate lymphoid cells, ILC)是近年来发现的一群参与固有免疫的异质性淋巴细胞, 多位于黏膜屏障部位,接受局部微环境细胞因子的信号,通过分泌细胞因子及其他介质,发挥早期的免疫监控和免疫调节作用。基于分泌的细胞因子及所表达转录因子的不同,将其分为3大亚群,分别为ILC1群(包括NK细胞和ILC1,表达T-bet、Eomes和NFIL3,产生IFN-γ)、ILC2群(ILC2,表达Gata3,产生IL-4、IL-5、IL-13等细胞因子)和ILC3群(包括LTi和ILC3,表达RORγt,产生IL-17、IL-22和CM-CSF)[3]。近期研究发现,人体外周血存在ILC前体细胞(innate lymphoid cell precursors, ILCP),可在体内和体外分化为ILC亚群[4]。越来越多的证据表明,ILC亚群可作为抗原呈递细胞,启动辅助型T细胞(Th)下游的免疫反应[3]。
研究发现,ILCs参与多种自身免疫性和炎症性疾病,如炎症性肠病、多发性硬化、系统性硬化症、ANCA相关性血管炎和RA的发生发展[2]。与Th1和Th17在RA中的致病效应相一致的是,ILC1和ILC3被认为在RA中发挥促炎作用,但相关研究结果不一致[2]。与此相反,ILC2可能在RA中具有抑制炎症的效应。在RA患者和小鼠关节炎研究中发现,活动期RA患者外周血ILC2数量减少,ILC2缺陷的小鼠关节炎明显加重,而活化ILC2可改善实验小鼠的关节炎[5-6]。目前ILCP和ILC其他亚群在RA中的临床意义尚不明确,本研究旨在分析ILCP和ILC各亚群在RA外周血的水平以及与临床和实验室指标的相关性,初步探讨其在RA发病机制中的作用。
1 资料与方法
1.1 一般资料
选取2020年9月至2021年2月就诊于安徽医科大学附属省立医院风湿免疫科门诊及住院的RA患者60例,所有患者诊断均满足1987/2010年RA分类标准。详细记录患者的基本信息(性别、年龄及病程)、临床特征 [肿胀关节数(SJC)、压痛关节数(TJC)、疾病活动评分DAS28]、实验室检查 [血沉(ESR)、C-反应蛋白(CRP)、类风湿因子(RF)、抗环瓜氨酸肽抗体(Anti-CCP)]及治疗情况。根据DAS28评分,将RA患者分为稳定组(DAS28≤3.2,29例)和活动组(DAS28>3.2,31例)。纳入同期在医院体检中心体检的性别年龄匹配,且排除免疫相关疾病的健康对照者32例。所有研究对象均签署知情同意书。
1.2 ILC亚群检测
空腹抽取两组对象5mL外周抗凝血,Ficoll密度梯度离心法分离获得外周血单核细胞(peri-pheral blood monouclear cells, PBMC)悬液并计数。取200 μL PBMC悬液,加入荧光抗体APC/Cy7-FVS、FITC-Lin(CD3、CD14、CD16、CD19、CD20、CD56)、BV510-CD45、PerCP-CD127、PE/Cy7-CRTH2、BV421-CD117、APC-NKp44、AF700-CD161(均来自美国Biolegend),避光孵育30 min后,磷酸盐缓释液(PBS)洗涤,加300 μL PBS重悬,流式细胞仪上机检测ILC细胞比例(BD Canto Ⅱ)。
1.3 统计学分析
正态分布连续性变量采用(均值±标准差)表示,定量资料比较应用单因素方差分析、Mann-WhitneyU检验及Kruskal-WallisH检验,流式数据采用Flowjo V10软件分析,使用GraphPad Prism 6进行数据统计作图,所有资料用SPSS 22.0进行统计分析,以P<0.05为差异有统计学意义。
2 结果
2.1 RA患者临床资料
活动组患者RF、SJC、TJC、ESR、CRP、DAS28明显高于稳定组患者,差异有统计学意义。两组患者性别比、平均年龄、病程、抗CCP抗体滴度及用药情况差异无统计学意义(表1)。

表1 RA患者临床资料Table 1 Clinical data of patients with RA
2.2 ILCs亚群的比例
三组实验对象外周血总ILCs、ILCP和ILC亚群(图1A)百分比比较:(1)活动组RA患者外周血总ILCs(FVS-CD45+Lin-CD127+)占CD45+细胞百分比高于对照组[(0.42±0.44)%比(0.24±0.11)%,P=0.014 1],稳定组RA患者总ILCs与对照组百分比相当,差异无统计学意义(图1B)。(2)活动组RA患者ILCP(FVS-CD45+Lin-CD127+CD117+)占总ILC百分比低于对照组[(6.05±4.96)%比(8.78±4.77)%,P=0.0324]和稳定组RA患者[(6.05±4.96)%比(9.12±5.44)%,P=0.0286],稳定组RA与对照组差异无统计学意义(图1C)。(3)活动组RA患者ILC1(CRTH2-CD117-)占总ILC百分比高于稳定组RA患者[(87.99±8.00)%比(81.43±7.06),P=0.0017]和对照组[(87.99±8.00)%比(82.35±7.09)%,P=0.005],而ILC2(CRTH2+CD117-)占总ILC百分比显著低于稳定组RA[(8.43±6.18)%比(13.14±6.62),P=0.0069]和对照组[(8.43±6.18)%比(12.21±5.83)%,P=0.017 1]。稳定组RA患者ILC1和ILC2百分比与对照组差异无统计学意义(图1D、E)。活动组RA患者ILC3(CRTH2-CD117+)占总ILC百分比低于对照组[(3.49±2.79)%比(5.35±3.62)%,P=0.047 2],稳定组RA与对照组之间无明显差异(图1F)。

图 1 RA患者外周血ILC亚群细胞
2.3 ILCs亚群与临床和实验室指标间的相关性
相关性分析发现,RA患者外周血总ILCs和ILC1与DAS28呈正相关(P<0.05),而ILCP、ILC2和ILC3与DAS28呈负相关(P<0.05);ILC1与TJC和ESR呈正相关(P<0.05),而ILCP和ILC3与ESR(P<0.05)和抗CCP抗体(P<0.05)呈负相关(P<0.05)。余临床和实验室指标与ILC亚群无明显相关性(表2)。
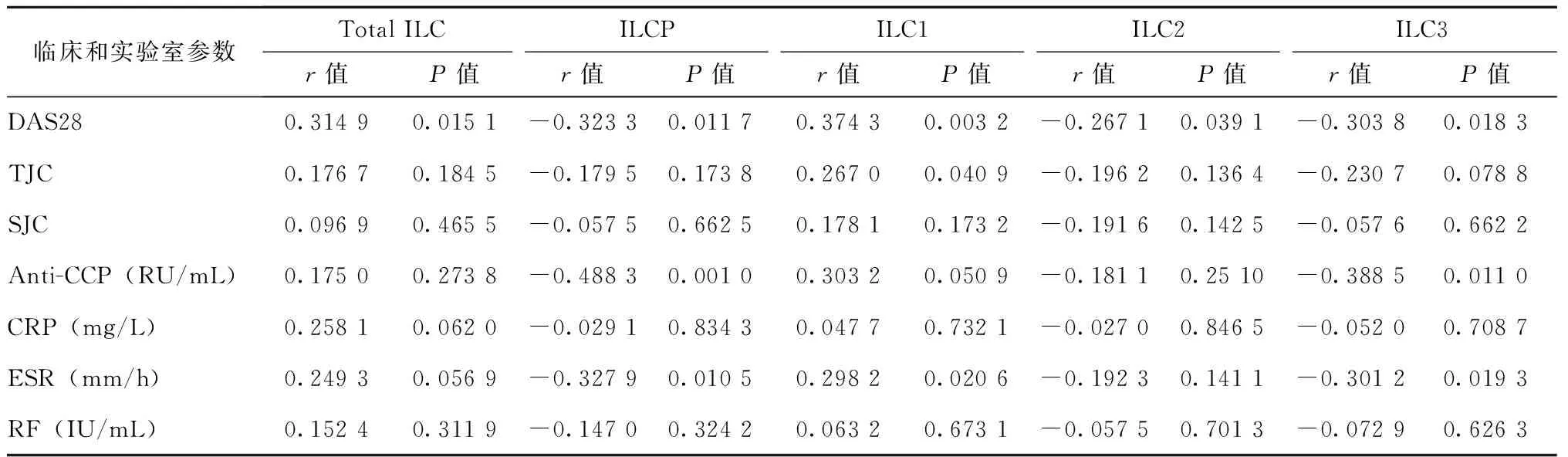
表2 ILCs亚群与临床和实验室指标间的相关性Table 2 Correlation of ILC subsets with clinical and laboratory parameters
2.4 ILCs亚群与其他免疫细胞间的相关性
进一步分析RA患者外周血CD4+T细胞、CD8+T细胞、CD19+B细胞和调节性T细胞(Treg)的比例,发现ILCP和ILC3与Treg呈正相关(P<0.05),而ILC2与CD19+B细胞呈负相关(P<0.05)(表3)。

表3 ILCs亚群与其他免疫细胞间的相关性Table 3 The association of ILC subsets with other immune cell populations
3 讨论
越来越多的证据表明,ILCs参与多种炎症性关节病的发展。早期研究发现,RA患者关节液中ILC3明显升高,可产生IL-22和TNF-α,且与疾病活动呈正相关[7]。另一项在日本RA患者的研究结果[8]与之相似。Leijten等[9]报道,与银屑病关节炎(psoriatic arthritis,PsA)不同,RA患者关节液中ILC1是主要的ILC亚群。另一项研究发现,幼年特发性关节炎患者关节液中ILC1和ILC3均明显扩增,且ILC3的比例与临床特征呈正相关[10]。上述研究结果不一致可能与不同的研究入选患者的疾病活动状态、ILC设门策略各异有关。
本研究检测RA患者和健康对照者外周血ILCs各亚群的百分比,根据RA患者DAS28分为活动组和稳定组,分析其与患者临床表现、实验室检查及其他免疫细胞等的相关性,初步探讨其在RA发病中的作用。发现活动组RA患者总ILCs和ILC1百分比高于健康对照者,而ILC3百分比低于健康对照者。相关性分析发现,外周血总ILCs和ILC1与DAS28呈正相关,而ILC3与DAS28呈负相关,提示ILC1可能参与了 RA患者的发病过程。Rosser等[10]报道,幼年特发性关节炎ILC1、ILC3在患者的滑膜液中均有扩增,其中NKp44- ILC3与临床特征呈正相关。另一项研究发现,日本RA人群中CCR6+ILC3在患者滑膜液中的比例与TJC、SJC正相关,且是IL-17和IL-22的主要来源[8]。本研究ILC3分布与上述文献不一致,可能与不同研究对ILC3表面分子标记的定义、患者人种及病情活动性、用药情况等存在差异有关。
与ILC1和ILC3的促炎作用不同,ILC2被认为在关节炎中发挥抑炎效应。Omata等[11]报道,ILC2在稳定期RA患者的外周血及滑液中增多,且与疾病活动度呈负相关。进一步动物实验结果表明,ILC2可能通过分泌IL-4/IL-13抑制TNF-α和IL-1β的效应而发挥缓解关节炎症及骨破坏的作用。与前期报道[6, 11]一致的是,本研究也发现RA活动组ILC2低于稳定组和健康对照组,且与疾病活动指数呈负相关,提示ILC2减少和(或)功能障碍参与了RA的发病。笔者近期研究还发现,小分子肽神经介素U可通过活化ILC2缓解胶原诱导的关节炎,提示调控ILC2活化促进关节炎缓解有望成为RA治疗的新策略[5]。
最近有研究发现人外周血存在CD117+ILCP,可在体内和体外产生所有的ILC亚群[4]。尽管调控ILCP分化成ILC亚群的机制尚不明确,但普遍认为其最终分化是在组织内[4]。目前ILCP在炎症性关节病中的意义尚不明确。本研究显示活动组RA患者外周血ILCP较稳定组和健康对照组明显减少,而稳定组患者和健康对照组无明显差异;与此同时,活动组患者ILC1百分比升高,提示ILCP可能通过迁移到炎症部位分化为ILC1发挥致炎效应。本研究RA活动组ILC3百分比低于健康对照组,但与稳定期RA患者之间没有差异,不排除ILC3因为较强的异质性和可塑性,从而向ILC1转换的可能性[12]。
综上,本研究发现ILCP和ILC亚群在RA患者外周血中分布失衡,且与疾病活动度、部分实验室指标及免疫学指标相关。虽然目前ILC在RA中的发病机制尚不明确,但现有的研究提示调控某些ILC亚群能为未来RA的免疫治疗提供可能。本研究仍存在一定的局限性。首先,患者来源于单中心,初发未治疗的患者较少,可能存在某些治疗药物对ILC的影响。其次,本研究为观察性横断面研究,尚未有足够的治疗前后对比研究,也限制了其在发病机制中作用的深层次探究。

