腐殖酸/Fe2+/PMS体系降解DMP的研究
张敏,周思婕,王平,谢林蓓,李奥
(南京林业大学 生物与环境学院,江苏 南京 210037)
邻苯二甲酸酯类(PAEs)是全球用量最大的增塑剂(占比约70%)[1],大量研究在人类经常接触的物品以及水体和大气中发现PAEs,且属于内分泌干扰物[2-6]。因此,研究PAEs的高效降解具有重要意义。
活化过硫酸盐是目前具有广泛应用前景的新型氧化技术。常见的活化方法中亚铁离子活化应用最为广泛,但为保持体系中持续存在活化过硫酸盐的Fe2+,通常会添加羟胺、柠檬酸等还原剂,促进生成的Fe3+转换成Fe2+[7-8]。研究表明,在黑暗中腐殖酸(HA)可将Fe3+还原为Fe2+[9-10]。因此,本文研究了添加腐殖酸的Fe2+/PMS体系对邻苯二甲酸二甲酯(DMP)的降解,以期为腐殖酸/Fe2+/PMS体系的原位修复应用提供理论依据。
1 实验部分
1.1 试剂与仪器
邻苯二甲酸二甲酯、腐殖酸、过一硫酸盐(PMS)、硫酸、氢氧化钠、叔丁醇(TBA)均为分析纯;甲醇,色谱纯;实验用水均采取超纯水。
Ultimata 3000高效液相色谱仪;MS-M-S10平板磁力搅拌器;THD-0515低温恒温槽;Rios Essential 5+Milli-Q超纯水机;SHB-III真空抽滤机。
1.2 实验方法
反应条件:DMP=5 μmol/L,Fe2+=0.05 mmol/L,PMS=0.5 mmol/L,腐殖酸=10 mg/L,初始pH值7.0,反应温度(25±0.5) ℃。
所有实验均在暗箱下锥形瓶(150 mL)中进行,利用MS-M-S10磁力搅拌器持续搅拌。采用低温恒温器控制温度在(25±0.5) ℃。每个反应瓶中加入所需剂量的DMP、腐殖酸和FeSO4溶液并用氢氧化钠或硫酸溶液调节pH值后,加入所需剂量的PMS溶液,启动反应。一定时间间隔取1 mL样品,用0.22 μm有机滤膜过滤,用200 μL甲醇淬灭。所有实验都进行3次,取平均值。
1.3 分析方法
采用高效液相色谱法测定DMP的浓度,配备Thermo Syncronis C18柱(5 μm×4.6 mm×150 mm)。色谱条件:流动相为60%甲醇∶40%超纯水,测量波长230 nm,柱温35 ℃,流速1 mL/min;进样体积50 μL。
2 结果与讨论
2.1 DMP在不同反应体系中的降解率
分别探究了腐殖酸/PMS、Fe2+/PMS和腐殖酸/Fe2+/PMS体系对DMP的降解效能,结果见图1。
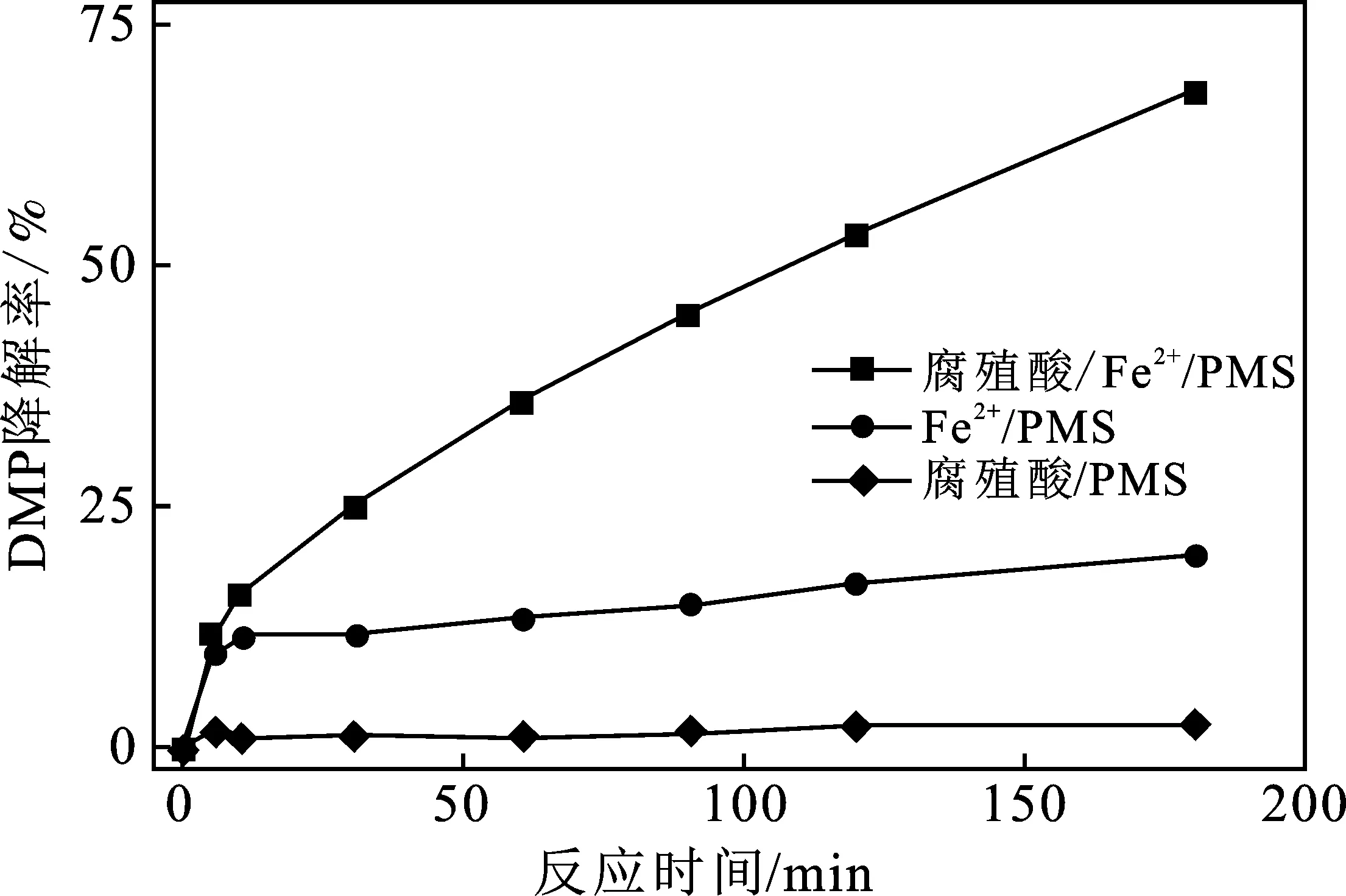
图1 不同反应体系降解DMP的效能Fig.1 DMP degradation in different reaction systems
由图1可知,腐殖酸/PMS体系对DMP基本没有降解效果;Fe2+/PMS体系在反应5 min时,对DMP的降解率达到9.8%,但继续反应至3 h时,DMP的降解效率也仅有20.0%。这主要是因为Fe2+浓度过低,Fe2+快速活化PMS后转化成Fe3+,虽然Fe3+能够通过反应(1)生成一定量的Fe2+,但是Fe2+生成速率过小,导致Fe2+/PMS体系对DMP的降解速率大幅度降低[11]。在Fe2+/PMS体系中加入腐殖酸后,体系对DMP的降解速率明显提高,3 h时DMP的降解率达到68.2%,表明投加腐殖酸可以明显提高Fe2+/PMS体系对DMP的降解。这与Liao P等[9]研究结果一致,腐殖酸中的醌基使得腐殖酸具有氧化还原活性,可以促进体系中Fe2+/Fe3+的循环,持续活化PMS生成活性自由基降解污染物。
(1)
2.2 不同浓度DMP的降解效能
由图2可知,延长反应时间,腐殖酸/Fe2+/PMS体系能够完全降解浓度在1~20 μmol/L范围内的DMP,表明该体系具有充足的降解DMP的容量。但DMP浓度越大,完全降解所需时间越长。这主要是因为体系反应条件固定时,PMS被活化产生活性自由基的速率和数量是一定的,并不会随着DMP浓度的增加而增加。通过降解率换算可得不同浓度DMP在相同时间内的降解量,结果见表1。
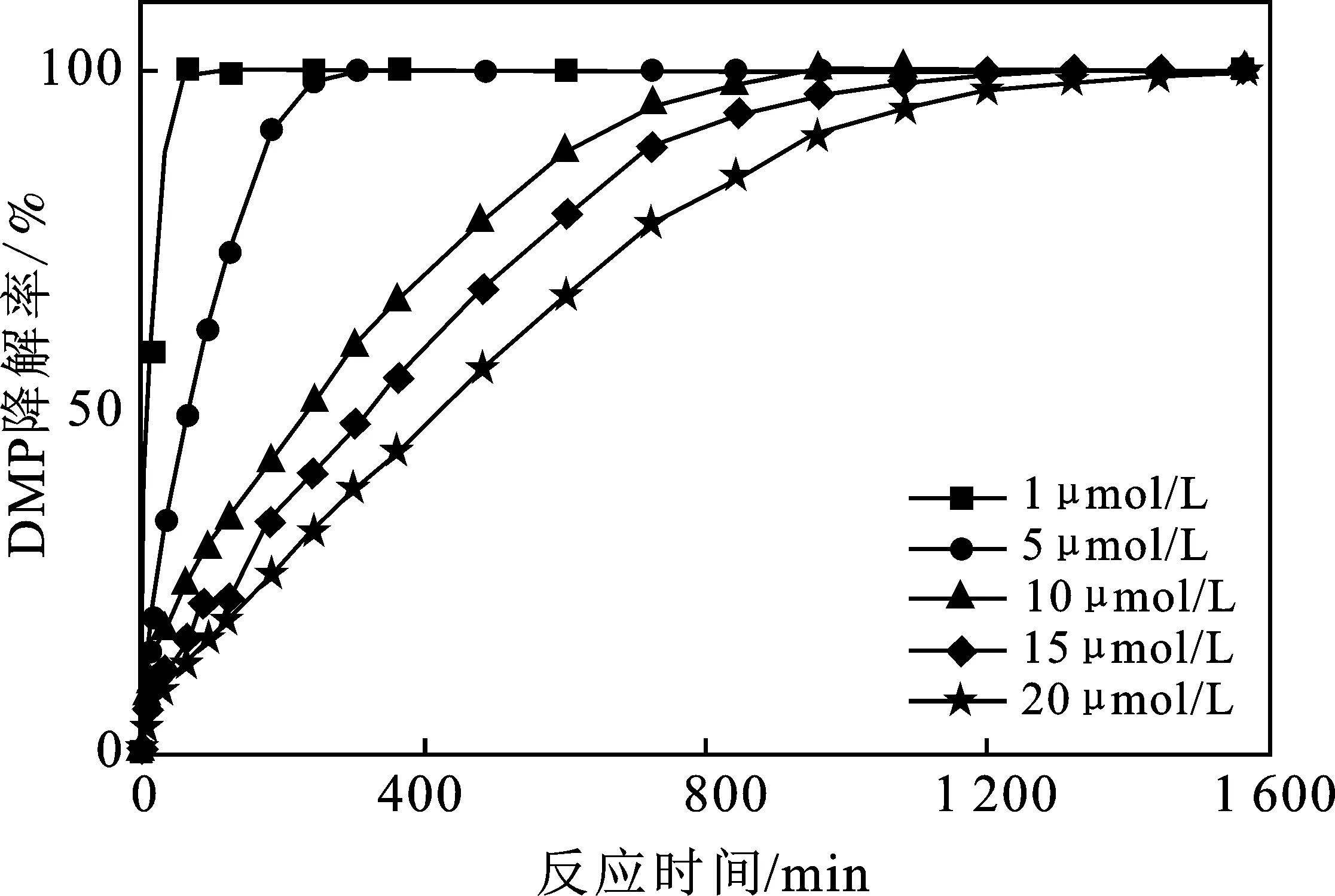
图2 不同浓度DMP的降解Fig.2 The degradation of different concentration DMP in the HA/Fe2+/PMS

表1 相同时间内不同浓度的DMP在体系中的降解量Table 1 Degradation of DMP at different concentrations in the same time
由表1可知,相同时间内,体系中被降解的DMP的量几乎一样,证明污染物的初始浓度并不会影响体系的降解能力。
实验中通过添加过量甲醇和过滤沉淀物研究体系中生成的沉淀物的作用,结果见图3。
由图3可知,体系中加入甲醇后,DMP基本没有被降解,因为甲醇会与DMP竞争消耗体系中生成的自由基,从而抑制DMP的降解,但甲醇没有阻止沉淀物的产生,说明沉淀物对DMP无吸附作用。反应30 min后过滤沉淀物,滤液继续反应,DMP降解速率大幅度降低。30 min到3 h之间,正常体系中DMP的降解率增加了43.22%,而被过滤掉沉淀物的体系中DMP的降解率仅增加了9.99%,表明沉淀物是促进体系降解DMP的重要物质,这与Vione D等研究结果相反[10],可能跟实验中所使用的腐殖酸分子量大小、溶液离子强度等实验条件有关,导致腐殖酸与铁的络合物溶解度有差异[12]。本研究中腐殖酸与铁的络合物溶解度小,导致大部分络合物析出。但腐殖酸与铁的络合物有利于高级氧化体系中污染物降解的研究结果与大量研究结果相似[10,13]。因为腐殖酸与Fe2+的络合物使得Fe2+更稳定。另外,腐殖酸中的还原性基团能够还原Fe3+。

图3 沉淀物对体系降解DMP的影响Fig.3 The effect of precipitate on DMP degradation

表2 腐殖酸的原子百分量Table 2 The atomic ratio of humic acid

表3 沉淀物的原子百分量Table 3 The atomic ratio of precipitate
2.3 沉淀物作用分析及鉴定
在实验结束时过滤收集沉淀物,用0.1 mol/L的HCl和超纯水依次清洗后,烘干24 h备用。利用XRD对沉淀物进行结构分析,对比Fe(OH)3三个JCPDF(No.38-0032,No.22-0346,No.46-1436),排除沉淀物是Fe(OH)3的可能。图4是腐殖酸样品和沉淀物的SEM-EDS图像。(a)腐殖酸SEM,(b)腐殖酸元素映射图,(c)沉淀物SEM,(d)沉淀物的元素映射图。
由图4(a)、4(c)可知,腐殖酸和沉淀物呈块材状,分别选取了一个平面作为EDS的范围。

图4 腐殖酸与沉淀物的SEM图像和选取的EDS范围Fig.4 SEM images and selected EDS range of humic acid and precipitate
由图4(b)可知,腐殖酸自带的Fe含量很少。由图4(d)可知,与腐殖酸的元素映射图相比,沉淀物中Fe含量明显增加。且两种物质中的Fe和C在空间上基本都均匀分布。上述内容支持了沉淀物是腐殖酸与铁络合产物的可能。对比表2和表3的腐殖酸与沉淀物的元素原子百分量也可进一步验证该猜测。腐殖酸和沉淀物都以C和O为主,C、O原子百分量总和都超过90%,且单个元素的原子百分量也相似,C的原子百分量为56.29%和51.65%,O的原子百分量为42.81%和40.82%。腐殖酸中除了含有C、O之外,只含有很少量的Fe,原子百分量仅为0.91%。沉淀物中Fe的原子百分量为5.57%,含量明显增加,应该是铁与腐殖酸络合的结果。沉淀物中新增了S元素,可能是PMS与腐殖酸作用导致的。
2.4 腐殖酸浓度对DMP降解的影响
由图5可知,腐殖酸的浓度对DMP的降解速率具有极大影响。当腐殖酸的投加量分别为1,5,10 mg/L时,体系降解DMP的一级动力学常数分别为0.000 9,0.003 5,0.016 3。说明当腐殖酸浓度范围为1~10 mg/L时,DMP的降解速率与腐殖酸浓度成正比,投加的腐殖酸浓度越高,DMP降解越快。但进一步提高腐殖酸浓度至20 mg/L时,DMP的降解速率降低。主要是因为腐殖酸虽然是Fe3+的还原剂,增加腐殖酸的投入量能够加速Fe3+向Fe2+的转化,但腐殖酸同时也是自由基清除剂[13-14],过量时会与污染物竞争消耗活性自由基,导致DMP的降解速率下降。


图5 (a)腐殖酸浓度对体系降解DMP效能的影响,(b)腐殖酸浓度对体系中DMP降解速率常数的影响Fig.5 (a)The influence of humic acid concentration on DMP degradation efficiency,(b)the effect of humic acid concentration on DMP degradation rate constant
2.5 降解过程推测
为初步确定腐殖酸/Fe2+/PMS体系中产生的活性物质,本实验采用甲醇(Me)和叔丁醇(TBA)作为自由基捕获剂探究反应中生成的自由基[15],见图6。

图6 甲醇和叔丁醇对体系降解DMP的影响Fig.6 Effects of methanol and tert-butanol on DMP degradation
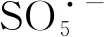

图7 腐殖酸/Fe2+/PMS体系中DMP的降解过程Fig.7 The degradation process of DMP in the humic acid/Fe2+/PMS system
3 结论


