乳酸菌群体感应的研究进展
李雷兵,朱寒剑,郑 心,李 琴,穆 杨,徐 宁,胡 勇,吴 茜,柳志杰,李 玮,汪 超,周梦舟*
(湖北工业大学 工业发酵湖北省协同创新中心 湖北省食品发酵工程技术研究中心,湖北 武汉 430068)
乳酸菌是我国传统发酵食品中的重要微生物,除了可以提高食品的质量和营养外,还可通过多种机制对人体产生有益影响[1-4]。但是,乳酸菌是如何适应复杂的发酵体外环境和宿主体内环境并发挥其益生特性的分子机制并未完全阐明。最近,有研究表明群体感应(quorum sensing,QS)可能与乳酸菌的应激及益生功能有关[5]。群体感应是细菌的一种调节机制,指当菌体密度达到一定量后,细胞通过分泌和感应特定的化学信号分子(称为自诱导分子)进行细胞间的交流。这种交流会诱导特定基因的表达,激活相关的行为,如生物膜的形成、胞外多糖的产生、细菌的毒力性、细菌素的生物合成和对各种环境压力的抗性等,这种信号交流对细菌的功能特性起着重要作用[6-9]。
1 乳酸菌的群体感应
乳酸菌作为革兰氏阳性菌,其QS系统由自身诱导(antoinduction,AI)和双组分信号系统(two component system,TCS)组成。自身诱导用于感知细胞间信息,而双组分信号系统用于接受信号分子[10]。
1.1 乳酸菌群体感应系统的信号分子
乳酸菌的信息交流分为种间信息交流和种内信息交流两种。种间信号交流分子AI-2是呋喃酮酰硼酸二酯[11],AI-2/LuxS群体感应系统在多种细菌信息交流中都起着重要的作用[12-13]。由于AI-2分子不稳定,通常用哈维氏弧菌作标准菌株来测量试验菌株的AI-2分子浓度[14]。在高细胞密度下,AI-2与受体蛋白(LuxP)结合,然后与传感器激酶(LuxQ)相互作用,该复合物引发磷酸化反应,诱导生物发光基因和LuxS的转录[15]。AI-2合成是以S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)为甲基供体,在S-腺苷甲硫氨酸酶的作用下生成了中间产物S-腺苷高半胱氨酸(S-adenosylhomocysteine,SAH),S-腺苷高半胱氨酸核苷酶(S-adenosyl homocysteine nucleosidase,SAHN)迅速水解SAH形成S-核糖高半胱氨酸(S-ribosylhomocysteine,SRH),SRH在LuxS蛋白催化作用下裂解成4,5-羟基-2,3-戊二酮(4,5-dihydroxy-2,3-pentanedione,DPD)和高半胱氨酸(homocysteine,HCY),最后DPD分子重排形成AI-2。LuxS基因是催化AI-2合成的关键基因,如果细菌的LuxS基因未表达,则无法产生AI-2进行细胞间信号传递[16]。AI-2分子的合成路径可见图1A。
种内信息交流的信号分子AI-1是一种小分子自身诱导信号肽(autoinducing signalling peptides,AIPs)。乳酸菌作为革兰氏阳性菌,AIP是种内群体感应系统的信号分子。随着乳酸菌增殖,AIP被不断地合成并转运输至胞外,当其在胞外积累达到一定浓度时即可被受体识别。AIP是由双组分系统的组氨酸激酶蛋白识别,与相应蛋白结合并相互作用,诱导QS调控基因转录[17-19]。AIP分子合成的路径见图1B。
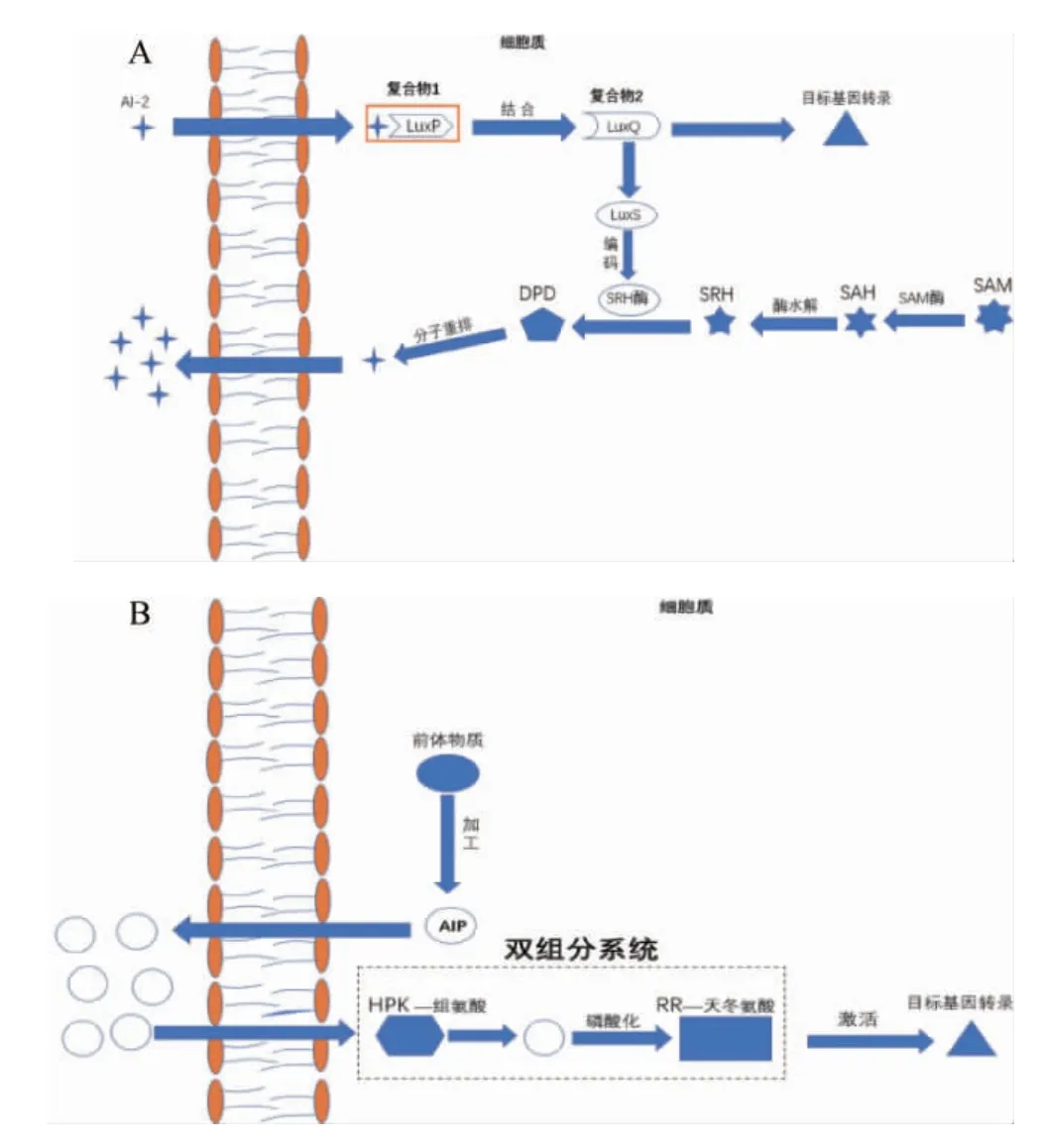
图1 两种类型的群体感应系统Fig.1 Two types of quorum sensing systems
1.2 乳酸菌群体感应中的双组分系统
双组分系统是细菌中广泛存在的信号转导途径,其在适应环境变化方面起着重要作用。双组分系统通常有检测膜反应相关组氨酸蛋白激酶(histidine protein kinase,HPK)和细胞质反应调节子(response regulator,RR)[20]。HPK通常由一个不稳定的N端信号输入结构域和一个稳定的C端自激酶结构域组成(见图1B)。RR通常由调节结构域和脱氧核糖核酸(deoxyribonucleic acid,DNA)结合结构域组成,调节结构域有一个可接收磷酸基团的天冬氨酸残基。HPK可以感知特定的环境刺激,RR则介导细胞的反应,最终的输出反应是激酶和磷酸酶活性平衡的结果[21]。乳酸菌的双组分系统对其生长有着重要的作用。有研究表明,野生型乳酸菌株与通过基因敲除构建的双组分系统(TCS)突变型菌株相比,突变菌株出现耐酸性下降[22]、自溶率升高[23]等结果,TCS也会参与其他生理过程,如调节氮代谢、苹果酸代谢、磷酸盐代谢、胆盐胁迫、抗菌耐药性等[5]。双组分信号转导系统对乳酸菌细胞生理学起着重要的作用,但是这些信号转导通路的研究受到的关注相对较少。
1.3 不同种属乳酸菌的群体感应系统
现有乳酸菌的QS系统主要是由信号分子和双组分系统构成,而不同种属的乳酸菌会有不同的QS调节方式。乳酸菌群体感应研究的类型主要是种间LuxS/AI-2系统,种内调节信号分子AIP和双组分系统研究相对较少。STURME M H等[25]在植物乳杆菌WCFS1中发现另一种QS系统——lamBDCA系统,lamBDCA系统与金黄色葡萄球菌(Staphylococcus aureus)中调控生物膜形成有关的QS系统——agr BDCA系统相似。不同种属乳酸菌的群体感应系统见表1。
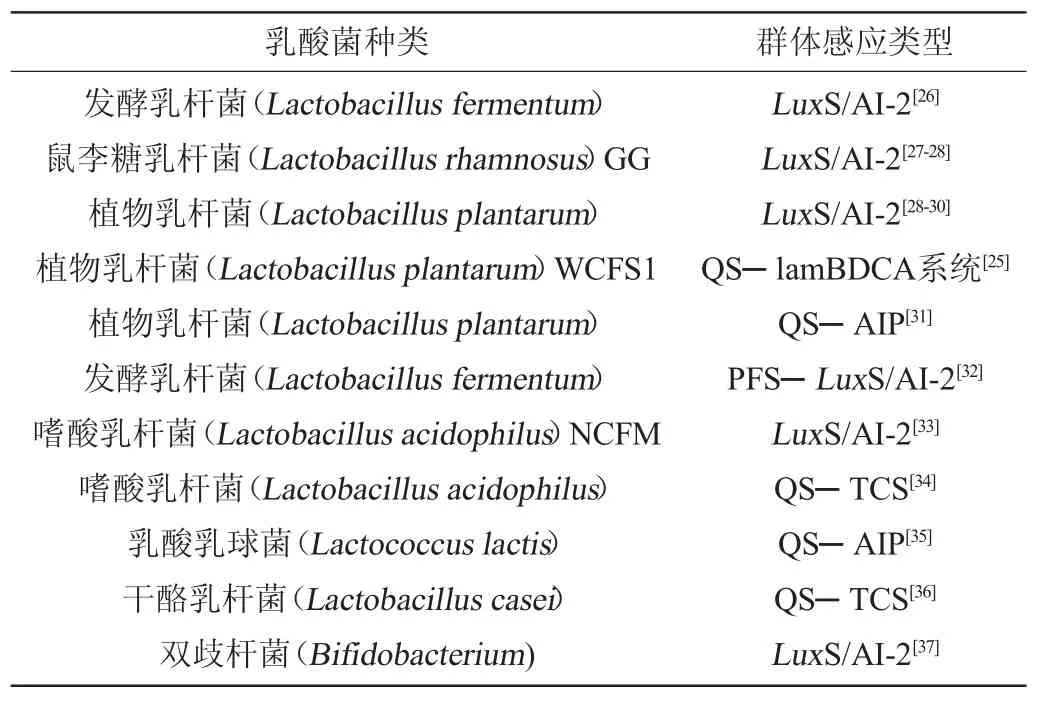
表1 不同种属乳酸菌的群体感应系统Table 1 Quorum sensing system of different species and genera of lactic acid bacteria
2 群体感应系统对乳酸菌适应环境的调控
乳酸菌被广泛应用于食品发酵,对提高发酵食品的感官品质起着重要作用。但是,在发酵过程中,乳酸菌需要在不同的环境条件下生存,如不同的温度、不同类型的糖、酸和盐浓度[38]。虽然乳酸菌对不良环境有一定的耐受性,但是其背后的分子机制并未完全阐明。有研究发现乳酸杆菌在酸休克、高温和饥饿胁迫下,AI-2活性升高,而低温和高渗透压胁迫导致AI-2活性下降[26]。同时,酸休克、低温、高渗透压和营养胁迫诱导了LuxS和PFS基因的过度表达,证实了LuxS相关反应在乳酸菌中确实起作用,并且这种反应可以被特定的应激因子改变[28]。这些研究结果暗示QS系统可能参与乳酸菌对环境应激的响应。群体感应系统对乳酸菌环境适应的调控见图2。
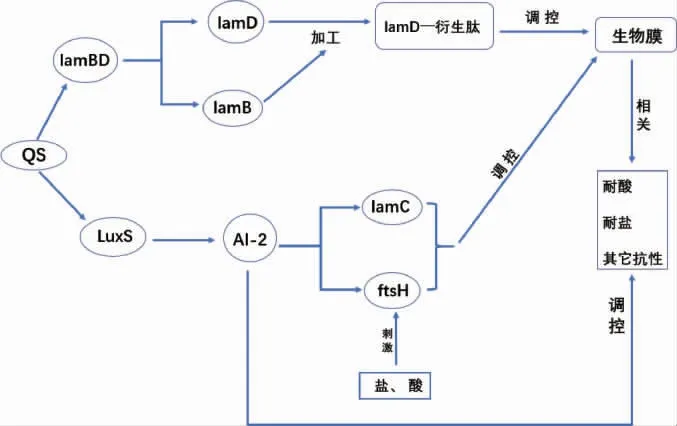
图2 群体感应系统对乳酸菌环境适应的调控Fig.2 Regulation of quorum sensing system on the adaptation of lactic acid bacteria to the environment
2.1 群体感应系统对乳酸菌生物膜形成的影响
生物膜作为近年来的研究热点,对其研究大多集中在致病菌,而对乳酸菌等益生菌的生物膜的研究还不够深入。生物膜的形成可以提高乳酸菌的耐酸、耐盐和抗菌等能力[39-40],并且可以促进乳酸菌在宿主粘膜的定植和持久性,从而避免病原菌的定殖[41],对发酵食品的质量产生积极作用[42]。但是近几年来,对乳酸菌形成生物膜能力的研究表明,只有少数菌株具有这种特性[43-44],并且有研究表明QS可能与乳酸菌形成生物膜有关[45]。
乳酸菌在生长期间伴随着大量的基因表达和信号分子传递来调控生物膜的形成[46]。燕彩玲[29]研究发现,乳酸菌在稳定期后期生物膜产量达到最大且趋于稳定,其中植物乳杆菌5-4-1、10-2、5-1-2在稳定期生物膜的形成量显著高于其他菌株,且这三株乳酸菌的AI-2浓度也比其他菌株高。这表明了乳酸菌中信号分子AI-2可能参与调控其生物膜的形成。有研究表明,LamC和金属蛋白酶FtsH(filamentation temperature-sensitive H,FtsH)蛋白可能调控细菌生物膜的形成,并且FtsH蛋白还可以调控植物乳杆菌WCFS1耐酸、耐胆盐等抗性[47-48];吴荣[30]研究发现,植物乳杆菌5-4-1在前期生长时,外源添加信号分子AI-2会显著促进lamC和ftsH基因的表达,促进乳杆菌生物膜的形成;STURME M H等[25]研究发现,植物乳杆菌WCFS1中的lamBDCA系统和生物膜形成有关。在lamBDCA系统中,LamB蛋白可以加工自诱导肽前体LamD成为LamD衍生肽,LamD衍生肽是一种与AIP结构类似的环状硫内酯五肽。LamB和LamD蛋白都是由lamBD基因表达而来,lamBDCA系统调节环状硫代内酯自诱导肽的合成,并参与生物膜的粘附。这些研究结果表明QS很可能参与调节乳酸菌生物膜的形成,帮助其更高效的发挥其益生特性。
2.2 群体感应系统调控乳酸菌耐酸特性
乳酸菌能发挥其益生功能的前提条件是能很好地通过胃肠道并在肠道定植,而人体胃液的pH值一般低于3.0,因此乳酸菌需具备较好的耐酸能力。有研究表明,乳酸菌可以利用LuxS/AI-2群体感应响应环境刺激,调节生长代谢[49]。顾悦[32]研究发现,酸胁迫可以诱导发酵乳杆菌(Lactobacillus fermentum)2-1分泌信号分子AI-2,同时,促进LuxS和PFS基因的转录。OVERBECK T J等[36]研究发现,烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)脱氢酶、磷酸转运腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)结合蛋白PstB和双组分系统中组氨酸蛋白激酶可以共同作用来增加干酪乳杆菌(Lactobacillus casei)12A对酸的耐受性;LEBEER S等[27]利用缺失LuxS基因的鼠李糖乳杆菌(Lactobacillus rhamnosus)突变株在小鼠模拟胃液中生存,结果显示出较低的存活率。这表明AI-2信号似乎与鼠李糖乳杆菌胃酸应激和定殖有关。另外,AZCARATE-PERILM A等[33]通过全基因组芯片技术分析发现,嗜酸乳杆菌(Lactobacillus acidophilus)HPK突变菌株相对于野生菌株对酸更加敏感,酸胁迫环境下包括基因LuxS在内的80多个基因表达水平呈上调趋势。这表明在酸胁迫环境下,嗜酸乳杆菌可通过提高LuxS基因转录水平使信号分子AI-2的活性增强,适应酸环境。因此乳酸菌可通过群体感应中的LuxS/AI-2信号系统增强其对酸的耐受性来适应宿主生态系统和肠道环境。
2.3 群体感应系统调控乳杆菌耐盐特性
胆盐会影响人体内渗透压的平衡,在肠道中胆盐的水平一般在0.03%~0.30%,乳酸菌如果要在肠道定植,需具备较好的耐胆盐能力。PFEILER E A等[34]研究了嗜酸乳杆菌胆汁应激反应时基因的表达情况,发现操纵子能显著诱导胆汁的表达,当胆盐存在的情况下,双组分系统中RR的失活导致操纵子的诱导作用增强,表明RR起阻遏作用。相反,在胆盐存在的情况下,同源HPK的失活对操纵子的诱导没有影响;LIU L等[50]研究发现,植物乳杆菌L-zs9的LuxS基因过度表达会调节多个转运蛋白和转录调节因子来促进其耐盐能力;顾悦[32]研究发现,当NaCl浓度较低时,发酵乳杆菌信号分子AI-2活性降低,但随后AI-2活性会增强;当胆盐浓度较高时,菌株信号分子AI-2活性显著降低且不会随培养时间的延长而增高,但是LuxS和PFS基因转录水平均会随渗透压增大而提高;YEO S等[28]研究植物乳杆菌和鼠李糖乳杆菌在NaCl渗透胁迫的情况下AI-2活性的变化,发现随着NaCl浓度的增加,所有供试菌株的AI-2活性均升高。因此,可能不同菌株对渗透压的耐受性存在差异,导致NaCl渗透胁迫的情况下AI-2的活性可能升高也可能降低。此外,吴荣[30]在测外源信号分子AI-2对乳酸菌耐盐性的影响时发现,在含较低浓度胆盐的乳酸菌培养基中添加不同浓度的信号分子AI-2后发现会促进菌株的生长,且添加浓度与菌体生长量呈现正相关,这说明QS系统可以提高乳酸菌的耐胆盐能力。因此,乳酸菌可通过群体感应中的LuxS/AI-2信号系统增强其对盐耐受性来适应宿主生态系统和肠道环境。
3 群体感应系统对乳酸菌益生特性的调控
大多数乳酸菌因有较好的耐受性使其在胃肠道中能够存活并增强宿主的免疫系统[51-53]。此外,乳酸菌还具有降血脂、降肝脂、抗菌以及治疗不同并发症等益生功能[54-56]。但是,胃肠道微生物种类和数量繁多,乳酸菌对肠道微生物区系的调节机制并未完全阐明。近年来,有大量的研究证明QS系统参与调控乳酸菌在人体的益生功能[57-58]。群体感应系统对乳酸菌益生特性的调控见图3。
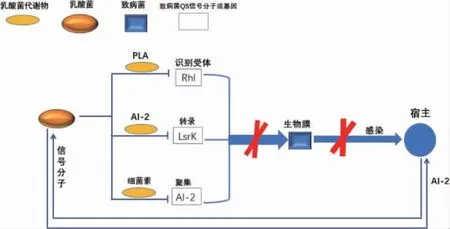
图3 群体感应系统对乳酸菌益生特性的调控Fig.3 Regulation of probiotic characteristics of lactic acid bacteria by quorum sensing system
3.1 群体感应系统调控乳酸菌对致病菌的拮抗作用
一些肠道病原菌会通过利用QS系统激活毒力因子、毒素合成、生物膜形成来对抗共生菌[59-60],导致这些致病菌在人体难以清除。乳酸菌可通过抑制病原微生物的生长及毒力因子的表达,从而降低食源性疾病的发生[61-62],但是其背后机制并未完全阐明。最近有研究表明,乳酸菌和致病菌共培养后,发现乳酸菌的LuxS基因会上调,从而对致病菌产生竞争性排除[63]。这表明乳酸菌很可能通过QS系统对致病菌产生拮抗作用,这种拮抗作用可能使乳酸菌在医疗领域发挥重要作用。
目前,病原菌生物膜已成为人体感染的重要原因。有研究表明,乳酸菌可能通过抑制致病菌的群体感应从而抑制其生物膜的形成[64]。鼠李糖乳杆菌微囊化可以提高AI-2的表达,因为这种聚集的分布促进了细胞间的信号交流,共培养时微囊化的鼠李糖乳杆菌可以明显的抑制致病菌生物膜的形成[65-66]。SONG H Y等[67]研究发现,鼠李糖乳杆菌微胶囊可能产生AI-2抑制大肠杆菌群体感应中LuxS、LsrK和LsrR基因的转录,从而抑制大肠杆菌生物膜的形成。龋齿是由于宿主和微生物群之间的同源性不平衡引起的,而变形链球菌(Streptococcus mutans)是引起龋齿的重要原因。WASFI R等[68]研究发现,乳酸杆菌可能通过抑制变形链球菌双组分中毒力基因vicKR和comCD的表达来抑制其生物膜的形成,抑制蛀牙,控制龋齿。有研究发现,群体感应可以调控乳酸菌产细菌素[69]。MELIAN C等[70]发现乳球菌AL705产生的细菌素可以使李斯特氏菌的AI-2失活,从而抑制其生物膜的形成。铜绿假单胞菌毒力因子的释放和生物膜的形成依赖于QS系统的LAS和RHL系统[71],而人类各种被铜绿假单胞菌感染的毒力机制大多依赖于AHL介导的群体感应。植物乳杆菌中的3-苯基乳酸(phenyllactic acid,PLA)是一种新颖的天然抗菌化合物,对细菌和真菌均具有广谱活性[72],LuxS/AI-2—QS系统调控可调控其生长[73]。CHATTERJEE M等[74]报道了从植物乳杆菌中分离纯化的PLA会干扰铜绿假单胞菌QS的RHL和PQS与受体RhlR和PqsR结合,从而抑制铜绿假单胞菌生物膜形成。所以,目前研究较多的是乳酸菌通过群体猝灭来抑制致病菌生物膜的形成。
3.2 群体感应系统介导乳酸菌与宿主的相互作用
肠道微生物可影响多种细胞和宿主反应,如免疫、神经、能量、储存等。乳酸菌可通过将各种生物聚合物水解成更小的、容易利用的代谢物而对宿主的健康产生有益的影响,并引起竞争性的定植[75-76]。一些群体感应分子除了在细菌内有通信功能外,还可以穿越肠道屏障,在癌症和中枢神经系统疾病中成为潜在的细菌-宿主通信信号[77-79]。SUN Z等[80]研究发现,AI-2在高浓度时,可以促进双歧杆菌对宿主的定植。此外,AI-2已经在人的粪便和唾液中检测到,而AHL已经在人的痰、尿和血浆中被检测到[81]。YEO S等[28]研究发现,鼠李糖乳杆菌受到胆汁酸、温度、渗透压和饥饿等胁迫时,AI-2的活性会降低。这表明AI-2信号分子可能是适应宿主生态系统和在肠道环境中相互作用的一种方式。DE SPIEGELEER A等[82]研究了不同的群体感应分子作为微生物传导者对C2C12肌细胞的影响,结果表明,有乳杆菌的群体感应分子组别有显著效果,尤其对肌肉细胞活性和炎症的影响较大。这项研究表明,乳杆菌的群体感应分子是肠道-肌肉轴的一部分,可能在肌肉萎缩疾病中发挥作用。同样,在植物中也存在乳酸菌与宿主关系,SANTAMARÍA L等[83]研究发现,橄榄苦苷(oleuropein,OLE)会减少一组编码免疫调节成分的基因的表达,并重新定向代谢途径,以增加蛋白质的乙酰化作用,这可能减弱了植物的免疫力。另外,还会触发响应,以抑制乙酰丙酮的转运并缓冲活性氧的积累,这是植物发育中的两个信号。并且OLE还可以作为植物-乳酸菌相互作用的信号分子,并通过抑制植物乳杆菌ABC转运蛋白的表达及QS-lamBDCA系统基因的转录,促进植物乳杆菌在植物宿主中的适应。因此,乳酸菌可以通过群体感应介导其与宿主的联系,使其与宿主形成共生关系。
4 群体感应系统介导乳酸菌的实际应用
目前,关于乳酸菌的研究很多,但是涉及到群体感应精准调控的应用研究相对较少。凡纳滨对虾是一种营养价值丰富的虾类,在储藏期间容易腐烂,导致其营养价值大打折扣[84]。LI J P等[85]在凡纳滨对虾试验中,发现植物乳杆菌AB-1和干酪乳杆菌共培养后,对虾样品中的腐败菌有显著的抑制作用。另外,在冷藏过程中,共培养对虾的AI-2活性显著提高,这表明乳酸菌的协同作用可能受LuxS/AI-2系统的调控,将植物乳杆菌和干酪乳杆菌共培养于对虾是一种有效的保护策略。LIU S L等[86]采用蛋白质组学方法分析了从西藏牛乳气酒中分离出的益生菌植物乳杆菌K25的冷应激反应,发现该乳杆菌QS的双组分系统和ABC转运蛋白参与了细胞的冷适应过程。这说明植物乳杆菌可利用群体感应来抗寒,将来可以应用于低温发酵或腌制食品中。金黄色葡萄球菌感染会对人体健康产生严重威胁,并且对其感染的检测既昂贵又耗时。金黄色葡萄球菌使用一种基于多肽的双组分群体感应系统,称为Agr群体感应系统,产生的信号分子是AIP-1[87]。LUBKOWICZ D[88]提出将金黄色葡萄球菌具有良好特性的Agr群体感应系统改造到罗伊氏乳杆菌中实现对其感染的快速检测。通过构造的生物传感器能实时检测AIP-1水平变化来了解各种条件下金黄色葡萄球菌的动态变化,从而将其应用到医院环境中葡萄球菌污染的检测和高通量药物筛选。乳酸菌作为益生菌在我们生活中发挥着重要的作用,而通过群体感应可以使其更高效的应用到实际生活中去。
5 结语与展望
乳酸菌因其独有的益生特性深受关注,其益生作用的机理更是成为研究的重点与热点。群体感应是乳酸菌感受外界环境变化并做出反应的重要信号转导机制,近些年来引起研究者们的广泛关注。
如图4所示,群体感应系统几乎参与了乳酸菌与外界的所有反应,其通过调控乳酸菌的耐酸基因、耐盐基因和形成生物膜等手段来抵抗不利环境保证生存;在适应环境后,QS系统通过调节乳酸菌产细菌素、抑制致病菌毒力基因表达影响乳酸菌与其他微生物的相互作用;除此之外,QS能通过AI-2调节宿主的健康,并应用于发酵食品。由于乳酸菌群体感应信号分子调控机制的复杂性,仍有很多问题亟待解决,笔者认为主要有以下几个方面:①现在关于乳酸菌QS研究大多是种间LuxS/AI-2系统,种内信号分子AIP主要调控什么,它们之间的关系是什么?②乳酸菌QS调控的下游基因需进一步深入研究。③乳酸菌QS在复杂的菌群(如肠道)中扮演着什么样的角色?④QS是如何调控乳酸菌与宿主的相互作用?因此,在未来研究中,群体感应对乳酸菌的环境适应、与菌群的相互作用、与宿主相互作用的分子调控机制将是乳酸菌基础研究的重要方向,利用QS的精准调控将是工业化与产业化的主要应用方向。
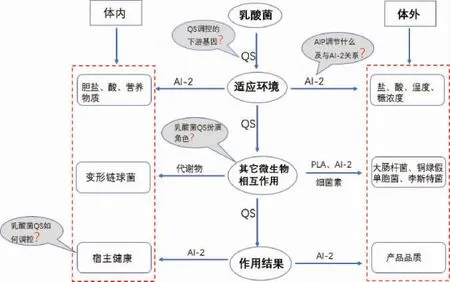
图4 乳酸菌群体感应的总结和思考Fig.4 Summary and thinking of lactic acid bacteria quorum sensing

