βE2上调Nrf2通路抵抗光诱导的大鼠视网膜功能损伤
杜芳英,朱春晖,邓春雷,陈 涛,熊业城,胡成虎,俞小瑞
(1. 西安交通大学医学部基础医学院生物化学与分子生物学系,陕西西安 710061;2. 西安交通大学医学部环境与基因教育部重点实验室,陕西西安 710061)
随着电子信息化社会的飞速发展以及人类寿命延长等因素影响,视网膜神经退行性疾病患病率越来越高,严重影响人类生存质量,是目前全世界都较为关注的重要社会公共卫生问题之一。年龄相关性黄斑变性(age-related macular degeneration, AMD)是临床上常见的视网膜神经退行性疾病[1],其病因复杂,临床缺少有效治疗方案。研究提示,AMD表现为自由基清除能力下降,同时伴有炎性因子升高[2]。因此,激活感光细胞内源性抗氧化蛋白可以延缓AMD的进展,并为AMD提供治疗策略。
17β-雌二醇(17β-estradiol, βE2)是体内循环最丰富、最有效的人类雌激素,并被公认为是中枢神经系统中的强抗氧化剂[3]。神经膜多不饱和脂肪酸的丰富性增加了脂质对氧化损伤的敏感性。因此,近年来,βE2在中枢神经系统中抗氧化神经保护作用是神经科学研究的热点之一[4]。βE2已被证明可以预防脑损伤和神经退行性疾病,例如阿尔茨海默病和帕金森病[5-6]。视网膜是中枢神经系统的外延,雌激素对视网膜主要细胞都显示出保护作用[7],但仍不清楚其中详细的抗氧化分子机制。
NF-E2相关因子2(NF-E2-related factor 2, Nrf2)属碱性亮氨酸拉链的转录因子家族,其介导的抗氧化信号通路是细胞内重要的防御途径[8]。Nrf2的激活受到多个级别的严格调节,Nrf2激活后调控Ⅱ相抗氧化酶的表达,包括超氧化物歧化酶1(superoxide dismutase 1, SOD1)、SOD2、过氧化氢酶(catalase, CAT)、硫氧还蛋白1(thioredoxin 1, Txn1)、Txn2、谷氧还蛋白(glutaredoxin 1, Glrx 1)及Glrx 2。本研究利用光诱导的视网膜退行性变大鼠模型,检测βE2玻璃体腔给药后视网膜功能的变化,以及Nrf2及其下游抗氧化基因的表达,为βE2在视网膜变性疾病(如AMD)的临床治疗提供实验数据。
1 材料与方法
1.1 实验动物雌性SD大鼠,体质量(250±10)g,由西安交通大学医学部SPF动物研究中心提供。本实验所有的动物操作都参照西安交通大学动物实验中心的饲养和实验动物使用指南进行。动物实验前2周行卵巢切除术,以限制内源性雌激素的干扰。所有大鼠首先暗适应18 h,接着按体质量腹腔注射100 g/L水合氯醛麻醉,进行分组干预。βE2光损组(βE2-LD组)玻璃体腔注射4 μL βE2、生理盐水光损组(Saline-LD组)玻璃体腔注射4 μL生理盐水,并立即进行荧光灯(强度为8 000-lux)照射12 h,与此同时Saline组(盐水组,Control)和βE2组分别经玻璃体腔注射Saline、βE2 4 μL后,未进行荧光灯照射;光损伤组(LD组)仅进行了荧光灯照射12 h。最后各组所有大鼠暗恢复1 d,再进行后续检测。
1.2 视网膜电图(electroretinogram, ERG)大鼠麻醉后眼球表面滴加复方托吡卡胺滴眼液进行扩瞳。大鼠平趴于工作支架上,接好负极和接地电极后,两侧角膜电极接触放置于大鼠眼角膜中央,力度轻柔,以刚刚接触角膜为宜,行视杆细胞反应(Rod-ERG)和最大混合反应(Max-ERG)测试。
1.3 标本取材及免疫荧光检测大鼠麻醉后,将含有5 μmol/L 2′,7′-二氯荧光黄双乙酸盐(2,7-dichlorodi-hydrofluorescein diacetate, DCFH-DA,Sigma产品)的平衡盐灌注液行心脏灌注20 min。将分离得到的眼球浸入40 g/L多聚甲醛中过夜后去前节,暴露硬固晶体并取出。剩余的眼杯浸入20%~25%的蔗糖中,约2~3 h后眼球沉入杯底。提前将冰冻切片机打开,设置温度-25 ℃。滴少许OCT包埋剂于冷冻头上,并使得视神经长轴与水平面平行,扶稳眼杯,待下层完全冻住后松手,缓慢在其上面滴加OCT包埋剂,使眼杯刚好完全浸泡在其中即可。待组织及包埋剂完全硬固后开始修切组织,切片厚10 μm,贴片于多聚赖氨酸黏附的载玻片。随后经5 μg/mL的DAPI孵育后加抗荧光淬灭剂,激光共聚焦显微镜(Confocal)下观察拍照。DAPI激发波长340 nm,发射波长488 nm;DCF激发波长488 nm,发射波长525 nm。
1.4 免疫组织化学(immunohistochemistry, IHC)检测大鼠眼球经梯度乙醇脱水,石蜡包埋,经组织切片机获得组织切片(厚度5 μm)。常规复性后,使用免疫组化试剂盒(武汉博士德),将切片与Nrf2(稀释1∶60,Abcam)在37 ℃孵育2 h后,将生物素偶联的二抗孵育20 min,然后再进行SABC处理30 min。使用DAB显色剂试剂盒显色,苏木精复染。
1.5 实时定量PCR(Real-time PCR)使用Trizol试剂(Invitrogen,美国)从大鼠视网膜提取总RNA,随后用First Strand cDNA Synthesis Kit(Fermentas,加拿大)将2 μg的RNA反转录,通过使用iQ5(Bio-Rad,美国)和SYBR Premix ExTaqTMⅡ(TaKaRa,日本)检测基因mRNA表达情况。各基因的引物信息见表1。

表1 Real-time PCR中基因的引物信息Tab.1 Primer of genes for Real-time PCR
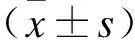
2 结 果
2.1 光损伤后大鼠视网膜功能的变化ERG检测光损情况下大鼠视网膜功能变化,结果显示,LD组的视网膜Rod-ERG和Max-ERG均较Control组a波、b波振幅明显减小(表2)。提示大鼠在光损伤后,视网膜功能受损严重,可为本研究提供较理想的视网膜退行性变模型。
表2 ERG检测光损伤后大鼠视网膜功能的变化Tab.2 Changes of rat retinal function after LD detected by ERG (n=6)
2.2 光损后大鼠视网膜组织活性氧水平及抗氧化基因mRNA表达变化Confocal观察结果显示,与正常去势SD大鼠视网膜相比,光损伤后视网膜组织DCF荧光强度显著升高,主要分布在外节(OS)、内节(IS层)(图1A)。Real-time PCR结果显示,8 000 lux白光刺激SD大鼠12 h经暗恢复1 d后,与正常去势SD大鼠视网膜组织相比,光损伤后视网膜组织的Sod1、Sod2、Cat、Glrx1、Glrx2、Txn1和Txn2的mRNA表达显著降低(图1B)。提示8 000 lux白光刺激去势SD大鼠12 h确实损害了视网膜组织的内源性抗氧化系统。
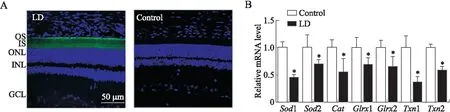
图1 光损伤后视网膜组织氧化应激水平的变化Fig.1 The level of oxidative stress in retinal tissue after LDA:DCFH-DA免疫荧光染色结果;B:抗氧化基因mRNA表达的统计分析。与Control组比较,*P<0.05(n=6)。OS:外节;IS:内节;ONL:外核层;INL:内核层;GCL:神经节细胞层。
2.3 βE2处理可减少ROS产生并增加Ⅱ相抗氧化酶的表达大鼠经玻璃体腔预注射βE2后行光损刺激,荧光探针DCFH-DA测量ROS生成。Confocal观察结果显示,Saline-LD组的大鼠具有较高的ROS荧光强度,而βE2-LD组的ROS荧光强度则明显降低;玻璃体腔注射βE2可以显著上调Sod1,Sod1,Cat,Glrx1,Glrx2,Txn1和Txn2的mRNA表达(图2)。
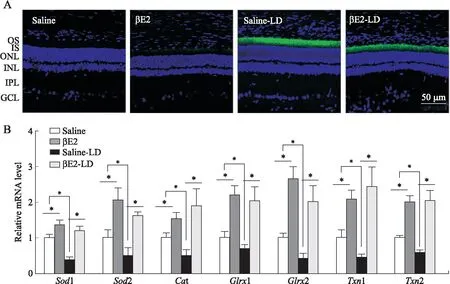
图2 经玻璃体腔预注射βE2对视网膜组织的氧化应激的影响Fig.2 Changes of oxidative stress in retinal tissue after βE2 administrationA:DCFH-DA检测ROS(×400);B:Real-time PCR检测抗氧化基因mRNA表达的比较。*P<0.05(n=6)。
2.4 βE2可上调视网膜组织中Nrf2的表达免疫组化染色结果显示,Saline-LD组在应激条件下,也在一定程度上激活了视网膜细胞Nrf2的表达,其中主要集中在内核层(INL)层,而βE2-LD组内INL、外核层(ONL)层细胞Nrf2的表达都显著升高(图3)。

图3 免疫组化检测βE2经玻璃体腔预注射给药后视网膜Nrf2的表达及定位Fig.3 Expression and localization of Nrf2 after βE2 administration detected by immunohistochemistry与Saline-LD组相比,*P<0.05(n=6)。
2.5 βE2对光损伤后视网膜功能的影响ERG检测视网膜功能的结果显示,大鼠经玻璃体腔单独注射Saline或βE2,视杆细胞反应和最大混合反应a、b波振幅没有明显变化,Saline-LD组与Saline组或βE2组相比,其a、b波振幅均明显降低;与Saline-LD组相比,βE2-LD组a、b波振幅均明显回升(表3)。提示光损伤可影响视网膜功能,而在光损前预注射βE2可一定程度使视网膜功能得以恢复。

表3 ERG检测βE2给药后视网膜功能的变化Tab.3 Retinal function detected by ERG after βE2 administration (n=6)
3 讨 论
视网膜退行性变的病因复杂,是遗传和环境等因素共同作用所导致的复杂性疾病,临床缺少有效的治疗方法。因此,逆转神经视网膜变性的治疗方法具有广泛应用前景,常用的治疗方法主要有干细胞治疗、基因治疗和神经保护治疗。其中神经保护治疗机制是通过为视网膜组织提供神经营养因子、抑制凋亡信号通路等途径而实现[9]。氧化应激在视网膜退行性变的病理生理过程中发挥重要作用,是导致视网膜功能损害的关键机制之一。因此,越来越多的学者关注抗氧化剂在视网膜退行性变中的效用。已有报道一些抗氧化剂如萝卜硫烷、姜黄素等可显著降低光诱导的视网膜损伤风险[10-11]。此外,美国临床评价复合抗氧化剂的治疗效果,结果显示补充复合抗氧化剂超过8年的中期AMD患者,患者转至晚期AMD的发生率下降25%[12]。
过度光照诱导的视网膜变性模型由NOELL等[13]于1966年首次建立。视杆细胞膜盘所含的视紫红质在光能转化为化学能过程中起着极其关键的作用,因此视紫红质是光损伤中的一个重要因素。研究表明,视网膜光损伤模型中视紫红质的吸收光波长与视网膜损伤光的波长一致,视紫红质的漂白产物如全反式视黄醛的吸收光波长与短波长损伤光的光谱相近。与正常光照环境饲养的动物相比,暗环境饲养的动物对光损伤的敏感性更高[14]。基于上述研究,学者推测该模型建模的理论基础为:强光刺激引起感光细胞发生剧烈的视紫红质漂白循环,由此产生大量的ROS,当机体无法有效地清除这些毒性产物时,以视杆细胞为代表的视网膜神经细胞便会激活凋亡通路发生凋亡,最终导致视网膜功能受损[15]。而且与药物诱导神经退行性疾病模型相比,视网膜光损伤模型优点是建模快、模型稳定、全身副作用小。本研究也提示,光损引起SD大鼠视网膜功能显著降低的同时,视网膜组织内产生大量的ROS,因此本模型为研究βE2的抗氧化作用提供很好的研究基础。
AMD病因复杂,发病机制尚不明了,学者多认为视网膜色素上皮细胞(retinal pigment epithelium, RPE)基底膜两侧膜性物质的沉积在AMD的发生发展中起到重要作用。索尔兹伯里眼评估项目评估了激素治疗和女性生殖因素对AMD的影响,结果发现激素治疗与晚期AMD玻璃膜疣的形成概率有关[16]。体外过氧化氢诱导RPE细胞凋亡模拟AMD模型,观察到βE2对RPE有显著保护作用,同时还可以抑制过氧化氢诱导的凋亡相关蛋白的表达[17]。可见,雌激素不仅可以治疗视网膜退行性变和青光眼,对AMD也可能有一定的效果。缺血-再灌注等也可以诱导视网膜退行性视力丧失。研究发现,βE2从病变早期就开始保护视网膜神经节细胞[18]。学者也在短暂性缺血性视网膜损伤模型中发现,βE2可抑制白细胞聚积,改善视网膜功能[19]。本研究提示,βE2可以激活Nrf2在视网膜外核层和内核层的表达,进而为其发挥视网膜神经保护奠定了基础。
Nrf2通路显示出强大的抗氧化潜力,可以预防与氧化应激相关的多种疾病。Nrf2激活后启动Ⅱ相解毒酶和相关抗氧化酶基因的转录,最终提高细胞抗氧化应激能力。本研究发现,玻璃体腔注射βE2可显著激活内源性抗氧化酶Sod1/2、Cat、Glrx1/2和Txn1/2的mRNA表达升高,而这些抗氧化基因受Nrf2转录因子的调控。然而,Nrf2在组织中的表达水平取决于特定组织解毒程度的需求[20]。在光损伤诱导视网膜变性模型中,Saline-LD组大鼠视网膜Nrf2阳性细胞主要分布在INL,而βE2预处理后,Nrf2阳性细胞数量在ONL和INL都显著增加,特别是ONL。据此推测,INL细胞在一定程度上激活内源性抗氧化防御系统,βE2主要激活ONL的Nrf2表达,从而增强视网膜组织清除ROS的能力,其中的具体机制还需要后期进一步研究。
综上所述,在光损伤诱导的视网膜退行性变中,βE2可增强视网膜组织清除ROS的能力,上调抗氧化基因表达,恢复视网膜功能。但有关βE2神经保护作用的具体分子机制如βE2如何激活Nrf2信号通路,尚需更深入的研究,以期为雌激素在神经退行性疾病中的临床应用提供理论依据。

