LncRNA-TDRG1促进宫颈癌细胞恶性生物学行为的实验研究
范 阳,刘明晖,张逢香,张敏阁,田科宁,贺化凤,王 芳,邹余粮
(1. 西安航天总医院妇科,陕西西安 710010;2. 西安交通大学第一附属医院妇产科,陕西西安 710061)
宫颈癌是全球女性癌症相关死亡的第二大原因[1]。据有关统计,全球每年新增宫颈癌确诊病例近53万例,发展中国家与宫颈癌相关的死亡人数显著高于发达国家[1-2]。尽管手术、放疗、化疗等单独治疗或联合治疗方法已取得了一定进展,但仍有相当一部分患者因复发和转移而长期生存率不佳[3]。因此,探索宫颈癌的发病机制,并寻找新的诊断和治疗方法具有重要临床意义。
长链非编码RNA(long non-coding RNA, lncRNA)是一类超过200个核苷酸的转录本家族,这些核苷酸缺乏蛋白质编码能力,但与多种癌症的生物活性密切相关[4]。最近,新发现的睾丸发育相关基因1(human testis development-related gene 1, TDRG1)是一种新的人类睾丸特异性基因,转录本为1.1 kb,位于6p212.1-p21.2,全长1.18 kb,包含2个外显子和1个内含子[5]。TDRG1最初被认为是精子活力的关键调节因子[6],并参与睾丸生殖细胞肿瘤的发生和进展[7]。此外,TDRG1作为生殖器官相关的lncRNA,在上皮性卵巢癌和子宫内膜癌的细胞增殖、迁移和侵袭中发挥重要作用[8-9]。然而,TDRG1在宫颈癌发生发展中的作用及其潜在的分子调控机制尚未充分阐明。
1 资料与方法
1.1 主要试剂RNA提取试剂盒:GenEluteTMTotal RNA Purification Kit(Sigma-Aldrich, Germany)。反转录试剂盒:Prime Script RT Reagent Kit(TaKaRa, Ohtsu, Shiga, Japan)。荧光定量试剂盒:SYBR Premix ExTaqTMⅡ kit (TaKaRa, Ohtsu, Shiga, Japan)。细胞转染:LipofectamineTM3000 Transfection Reagent(Thermo Fisher Scientific,Waltham, MA, USA)。FITC/PI凋亡试剂盒(Thermo Fisher Scientific,Waltham,MA, USA)。TDRG1及管家基因GAPDH引物由上海生工生物公司合成。引物序列:lncRNA-TDRG1(F 5′-TCTTCCCTGGCTTGGC-3′;R 5′-TGGGCTCTTTCGTGGC-3′);GAPDH(F 5′-GCACCGTCAAGGCTGAGAAC-3′;R 5′-TGGTG-AAGACGCCAGTGGA-3′)。
1.2 细胞株宫颈癌细胞株:Siha(目录号:TCHu113)、Hela(目录号:TCHu187)、C-33A(目录号:TCHu176)、Caski(目录号:TCHu137)购自上海中国科学院细胞库;正常宫颈细胞株Ect1/E6E7(编号:BNCC339959)购自北京北纳生物细胞库。细胞复苏后,使用含100 mL/L胎牛血清的DMEM培养基,在含50 mL/L CO2、37 ℃恒温培养箱中培养。取对数生长期细胞接种于6孔板,当细胞铺满培养板70%~90%时,使用Lipofectamine 3000进行转染,转染步骤严格按照说明书进行,转染48 h后处理细胞,验证转染效率。
1.3 实时定量PCR按RNA提取试剂盒说明书,提取培养细胞的总RNA,并进行质控。将总RNA(1 μg)按照Prime Script RT Reagent Kit说明书反转录成cDNA,反应条件:37 ℃,15 min;85 ℃,5 s。按照SYBR Premix ExTaqTMⅡ kit说明书,确定转录反应体系和反应条件,将获得的反转录产物进行扩增,使用FastStart Essential DNA Green Master (Roche)检测lncRNA-TDRG1表达,实时定量PCR(quantitative real-time polymerase chain reaction, qRT-PCR)反应条件:95 ℃变性10 s;60 ℃退火15 s;72 ℃延伸20 s,共40个循环。所有样品均设复孔,实验重复3次。采用2-ΔΔCt计算和标准化lncRNA-TDRG1的相对表达量。
1.4 CCK-8和细胞平板克隆实验采用CCK-8和细胞平板克隆实验检测细胞的增殖能力。CCK-8检测:转染siRNA 24 h后,将细胞接种到96孔板,每孔5 000个细胞。在细胞培养的不同时间点(0、24、48、72 h),每孔加入约100 μL CCK-8稀释液,将培养板放入细胞培养箱中孵育2 h。用酶标仪检测450 nm处各孔的吸光度(A)值,测定细胞活力。细胞平板克隆:将细胞接种到6孔板,每孔300个细胞,正常培养14 d。最后对细胞集落进行成像和计数。所有检测均设置3个复孔,实验重复3次。
1.5 Transwell实验采用Transwell实验检测细胞的侵袭和迁移能力。侵袭实验:将无血清培养基中的2×105个细胞加入到Matrigel胶包被的Transwell小室中。将含有200 mL/L胎牛血清的培养基加入下方腔室。48 h后,用棉签将Transwell膜上表面残留的细胞擦去,将细胞用甲醇固定,然后10 g/L结晶紫染色,在显微镜下成像和计数。迁移实验:将无血清培养基中的2×105个细胞加入无基质胶包被的Transwell小室中,后续操作同侵袭实验。
1.6 流式细胞学检测采用流式细胞学检测细胞凋亡。按照FITC/PI凋亡试剂盒说明书进行,siRNAs转染48 h后收集细胞,用Annexin V结合缓冲液(5×106/mL)重悬。然后细胞与Annexin V/FITC避光混合5 min。在细胞溶液中加入10 μL PI染料和400 μL PBS,采用BD流式细胞仪进行细胞凋亡分析。
1.7 Western blotting检测将TDRG1-siRNA和Negative-siRNA转染Hela细胞48~72 h后,弃去培养上清,用PBS洗涤细胞,置于冰上,每孔加入100 μL的细胞裂解液,10 min后,用细胞刮收集裂解后细胞于EP管,低温(4 ℃)、12 000 r/min,离心20 min,弃上清后向EP管中加入5×的上样缓冲液,100 ℃蛋白变性5 min,BCA测定蛋白浓度。配制120 g/L的SDS-PAGE分离胶和50 g/L的上层胶,加入细胞总蛋白进行凝胶电泳,按照分子量切胶,转膜至PVDF膜,50 g/L的新鲜配制脱脂牛奶封闭,加入一抗孵育,4 ℃冰箱摇床过夜。用TBST洗涤,次数不少于3次,每次大于5 min,加入二抗(辣根过氧化物酶标记)室温孵育约1 h。同样,TBST洗涤3次,进行ECL化学发光。用ChemiDocTM XRS+仪器和配套的Image Lab TM软件检测蛋白条带的灰度值并计算。实验重复3次。
2 结 果
2.1 不同类型宫颈癌细胞株中TDRG1的表达水平qRT-PCR检测4种不同类型的宫颈癌细胞株(Hela、Caski、C-33a和Siha)及正常宫颈细胞株(Ect1/E6E7)中的TDRG1表达水平。结果显示,TDRG1在宫颈癌细胞株(Hela、Caski、C-33a和Siha)中的表达明显高于正常宫颈细胞株(Ect1/E6E7)(Helavs. Ect1/E6E7,t=10.34,P<0.05;Caskivs. Ect1/E6E7,t=11.63,P<0.05;C-33avs. Ect1/E6E7,t=8.49,P<0.05;Sihavs. Ect1/E6E7,t=12.06,P<0.05,图1)。同时,和其他类型宫颈癌细胞株(Caski、C-33a和Siha)比较,Hela细胞株中的TDRG1表达水平相对较高(Helavs. Caski,t=6.22,P<0.05;Helavs. C-33a,t=7.84,P<0.05;Helavs. Siha,t=9.32,P<0.05,图1)。
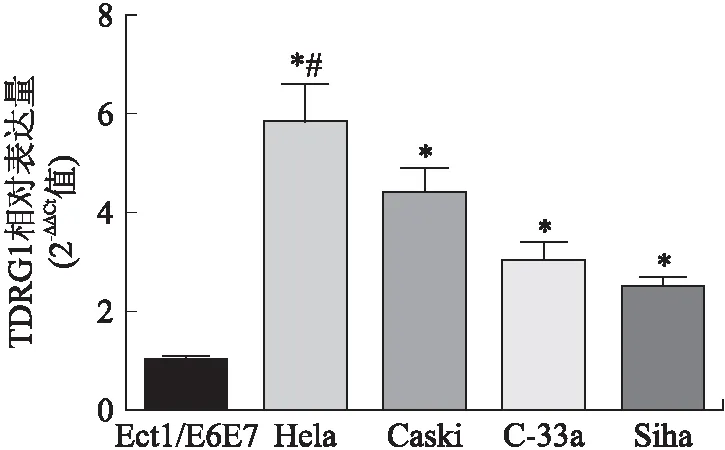
图1 不同类型宫颈癌细胞株中lncRNA-TDRG1的表达水平Fig.1 The expression of lncRNA-TDRG1 in different cell lines of cervical cancer与Ect1/E6E7组比较,*P<0.05;与Caski、C-33a、Siha组比较,#P<0.05。
2.2 下调TDRG1表达抑制宫颈癌细胞增殖和集落形成qRT-PCR检测TDRG1-siRNA转染Hela细胞中TDRG1的表达,结果显示,经TDRG1-siRNA转染后,Hela细胞中TDRG1的表达明显低于对照组(Negative-siRNA)(t=8.51,P<0.001,图2A)。采用CCK-8和细胞平板克隆实验检测细胞增殖能力,结果显示,在培养各个时间点(24、48、72 h),TDRG1-siRNA转染细胞的增殖能力明显低于阴性对照组(24 h:t=4.23,P<0.05;48 h:t=6.16,P<0.05;72 h:t=8.51,P<0.01,图2B)。同时,TDRG1-siRNA转染细胞的克隆数量明显低于对照组[(162±21)vs. (411±33),t=11.53,P<0.05,图2C],提示下调TDRG1表达可抑制Hela细胞的集落形成。
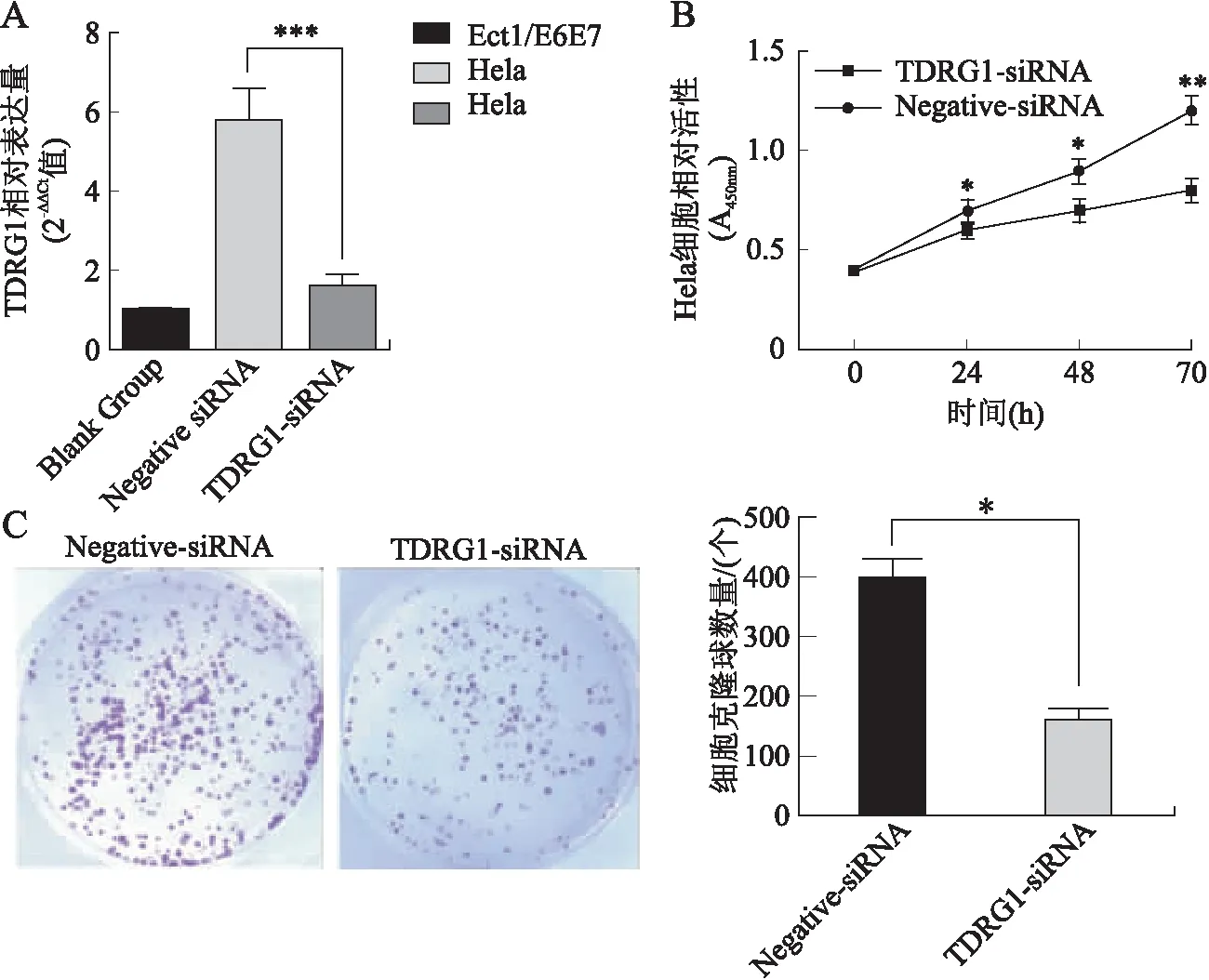
图2 下调lncRNA-TDRG1表达抑制Hela细胞的增殖和集落形成Fig.2 Downregulation of lncRNA-TDRG1 inhibited the proliferation and colony formation of Hela cells与Negative-siRNA组比较,*P<0.05,**P<0.01,***P<0.001。
2.3 下调lncRNA-TDRG1表达抑制宫颈癌细胞的侵袭与迁移能力Transwell实验检测宫颈癌细胞侵袭与迁移能力的结果显示,与阴性对照组(Negative-siRNA)相比,TDRG1-siRNA转染后,Hela细胞的侵袭[(86±13)vs. (315±38),P<0.01]和迁移[(177±22)vs. (406±41),P<0.01]数量均明显减少(图3),提示下调TDRG1表达会抑制宫颈癌细胞的侵袭和迁移能力。

图3 下调lncRNA-TDRG1表达抑制Hela细胞的侵袭和迁移能力Fig.3 Downregulation of lncRNA-TDRG1 inhibited the invasion and migration of Hela cells与Negative-siRNA组比较,**P<0.01。
2.4 下调lncRNA-TDRG1表达抑制Bcl-2蛋白表达并促进宫颈癌细胞凋亡流式细胞学检测宫颈癌细胞凋亡水平,结果显示,与阴性对照组(Negative-siRNA)相比,TDRG1-siRNA转染组Hela细胞的凋亡比例明显升高[(28%±1.5%)vs. (16%±1.2%),P<0.05,图4A]。同时,Western blotting检测宫颈癌细胞中Bcl-2蛋白表达的结果显示,TDRG1-siRNA转染组Hela细胞中Bcl-2蛋白表达量明显减少(P<0.05,图4B),提示TDRG1下调会促进宫颈癌细胞的凋亡水平。

图4 下调lncRNA-TDRG1表达抑制Bcl-2蛋白表达并促进宫颈癌细胞凋亡Fig.4 Downregulation of lncRNA-TDRG1 inhibited the expression of Bcl-2 and induced apoptosis of cervical cancer cells与Negative-siRNA比较,*P<0.05。
2.5 下调lncRNA-TDRG1表达抑制宫颈癌细胞的自噬活性Western blotting检测宫颈癌细胞中细胞自噬活性相关蛋白表达的结果显示,与阴性对照组(Negative-siRNA)相比,TDRG1-siRNA转染组Hela细胞中LC3-Ⅱ蛋白表达减少,LC3-Ⅰ蛋白向LC3-Ⅱ蛋白的转化明显减弱[LC3-Ⅱ/LC3-Ⅰ:(2.2%±0.2%)vs. (4.8%±0.5%),P<0.05];同时,细胞中p62蛋白的蓄积明显增加(P<0.05,图5),提示下调TDRG1表达会明显抑制宫颈癌细胞的自噬活性。

图5 下调lncRNA-TDRG1表达抑制宫颈癌细胞的自噬活性Fig.5 Downregulation of lncRNA-TDRG1 inhibited the autophagy activity of cervical cancer cells与Negative-siRNA组比较,*P<0.05。
3 讨 论
宫颈癌是常见的妇科恶性肿瘤之一,在世界范围内有很高的发病率和致死率[10]。对于宫颈癌患者而言,能够早期诊断和治疗是获得良好预后的关键。因此,寻找新的临床生物标志物或者可干预靶点,对于宫颈癌的早期诊断和治疗以及预后判断非常重要。
近年来的研究证实,宫颈癌中存在多种lncRNAs的异常表达,其作为癌基因或抑癌基因,参与了宫颈癌的病理进程[11]。例如,高水平的lncRNA-AFAP1AS1和lncRNA-CASC15与宫颈癌患者预后有关[12-13]。LINC01305沉默靶向宫颈癌细胞中的TNXB,抑制PI3K/Akt信号通路,阻碍癌细胞的EMT、侵袭和迁移过程,为宫颈癌的潜在治疗靶点提供了新的见解[14]。宫颈癌细胞中人乳头瘤病毒E6/E7基因与lncRNA-TMPOP2的表达具有协同促进作用[15]。lncRNA-ZFAS1在宫颈癌组织中表达上调,沉默ZFAS1可抑制细胞增殖、迁移和侵袭,增强肿瘤对顺铂的化学敏感性[16]。本课题组的前期研究发现,与正常组织相比,lncRNA-TDRG1在宫颈癌组织中呈现出相对高表达状态,并且其表达水平和宫颈癌患者的临床病理分期和预后显著相关[17]。本研究在不同的宫颈癌细胞株中证实了lncRNA-TDRG1的表达,发现与其他类型宫颈癌细胞株(Caski、C-33a和Siha)比较,Hela细胞株中的lncRNA-TDRG1表达相对较高,这可能和肿瘤细胞的恶性程度高低有关。利用筛选出的宫颈癌Hela细胞株,成功构建了TDRG1-siRNA,并下调了Hela细胞中lncRNA-TDRG1的表达水平。进一步检测发现,lncRNA-TDRG1下调后,Hela细胞的增殖、侵袭和迁移能力均明显减弱,且细胞集落形成能力也大为降低。这说明lncRNA-TDRG1可能通过促进宫颈癌细胞的恶性生物学转变,对患者的临床进展和预后产生不良影响。
多项研究表明,lncRNA表达水平可影响宫颈癌细胞的凋亡水平。例如,利多卡因通过调控lncRNA-MEG3/miR-421/BTG1通路,抑制宫颈癌细胞增殖,诱导细胞凋亡[18]。ARFHPV E7癌基因、lncRNA HOTAIR、miR-331-3p及其靶标NRP2形成负反馈环调控细胞凋亡,促进HPV阳性宫颈癌的发生发展[19]。本研究发现,lncRNA-TDRG1下调会增加Hela细胞凋亡;同时,Bcl-2蛋白表达减少。Bcl-2是重要的癌基因,在多种肿瘤的发生发展过程中起重要作用,例如,microRNA-744通过调控Bcl-2诱导的细胞凋亡,抑制宫颈癌的生长和进展[20]。Bcl-2蛋白高表达的癌细胞具有更强的耐药性[21]。因此,推测lncRNA-TDRG1可能通过促进Bcl-2翻译抑制宫颈癌细胞的凋亡。进一步研究发现,Hela细胞中lncRNA-TDRG1的表达会对肿瘤细胞自噬活性造成影响。自噬是细胞的一种自我保护机制,在细胞中形成自噬小体,实现物质和能量循环利用。但也有学者发现,肿瘤细胞的自噬行为有可能是细胞Ⅱ型程序性死亡,称为过度自噬现象[22]。在本研究中,lncRNA-TDRG1表达被抑制时,Hela细胞的自噬活性明显降低,这和TDRG1促进精原细胞瘤TCam-2细胞自噬活性作用一致[23]。结合Hela细胞凋亡明显增加,提示lncRNA-TDRG1可促进宫颈癌细胞产生自我保护性自噬行为,利于维持肿瘤细胞稳态。
研究表明,lncRNA具有多种生物学功能[24],如介导染色质重构、组蛋白修饰,干扰下游基因表达;结合蛋白编码基因转录本,形成互补双链DNA复合体,干扰mRNA切割或导致选择性剪接,或产生内源性siRNA;与特定蛋白结合以调节其活性;与蛋白质形成核酸蛋白质复合体;结合特定蛋白质改变蛋白质细胞定位等。因此,lncRNA-TDRG1在宫颈癌中以何种方式作用于下游信号通路发挥生物学功能,其分子机制仍需进一步探索。
综上所述,lncRNA-TDRG1可明显影响宫颈癌细胞的恶性生物学行为,在宫颈癌的发生发展中起积极作用,并与患者的不良预后直接相关。lncRNA-TDRG1可能作为潜在的诊断和治疗靶点,为宫颈癌的治疗带来新的希望。

