南京地区犬细小病毒基因型鉴定
方光远,樊金云,谈福利,金海燕,黄心昱,王喜国,张玉红,陈俊红,王楠楠,戴鼎震
(1. 金陵科技学院动物科学与技术学院,江苏 南京 210038;2. 乾元浩生物股份有限公司南京生物药厂,江苏 南京 210012)
犬细小病毒(canine parvovirus,CPV)属于细小病毒科细小病毒属,病毒粒子大小为20~22 nm,病毒核酸为单股DNA,基因组全长为5 323 bp,基因组包含2个基因开放阅读框,分别编码结构蛋白(VP1和VP2)和非结构蛋白(NS1和NS2),其中衣壳蛋白VP2(基因长度为1 755 bp)主要影响CPV的抗原性和感染宿主范围[1-3]。犬细小病毒主要感染6个月龄以内的幼犬,特别是1~3月龄的幼犬,感染病犬表现为心肌炎型、肠炎型、心肌炎肠炎混合型。心肌炎型主要发生于8周龄以下的幼犬,多见于4~6周龄幼犬,常无先兆性症状,或仅表现轻微腹泻,继而突然衰弱、呻吟、黏膜发绀、呼吸极度困难,常在数小时内突然死亡,发病率50%~100%,死亡率60%~100%。肠炎型1~6月龄幼犬最为易感,占CPV感染犬总数比例可高达75%,发病率20%~100%,死亡率50%~100%。该病50%以上感染表现为心肌炎肠炎混合型,感染率可达100%,死亡率80%~100%。大于1岁成年犬发病率相对较低[3]。
CPV最早发现于美国[4],Kelly[5]和Thomson等[6]同时从病犬粪便中用犬肾MDCK细胞分离获得该病毒,并将该病毒命名为CPV-2。研究表明,CPV-2与猫瘟热病毒(feline panleukopenia virus,FPV)、貂肠炎病毒(mink enteritis virus,MEV)非常相似,家犬和野生犬均可感染,但不会感染猫。Parrish等[7]报道,CPV-2自1978年发现以来,不断进化变异产生出新毒株,1979—1982年之间,原始CPV-2型毒株进化变异为CPV-2a基因型,1984年又进化变异为CPV-2b基因型。Nakamura等[8]报道,1984—2000年间又相继产生了2种新型变异毒株New -CPV-2a和New -CPV-2b基因型。Martella等[9]报道,2001年,在意大利又发现新的进化变异毒株CPV-2c基因型。目前,CPV-2a、CPV-2b、New-CPV-2a、New-CPV-2b和CPV-2c 5种变异基因型已经取代了原始CPV-2基因型,在世界范围内广泛流行和传播。本试验收集2012—2019年南京市某宠物医院43份犬细小病毒粪便病料,通过测定VP2基因进行了基因型分析,以期为南京地区预防和治疗犬细小病毒病提供理论依据。
1 材料与方法
1.1 病料
南京市某宠物医院2012—2019年临床症状表现为呕吐、腹泻或排出番茄酱样有特殊腥臭味的血便,并经过韩国百易奥生物公司安捷犬细小病毒抗原胶体金快速检测试纸板检测CPV为阳性的病犬粪便样品43份。43份病料每次收集后保存在-20 ℃冰箱冷冻室备用。43份病料患犬信息见表1。
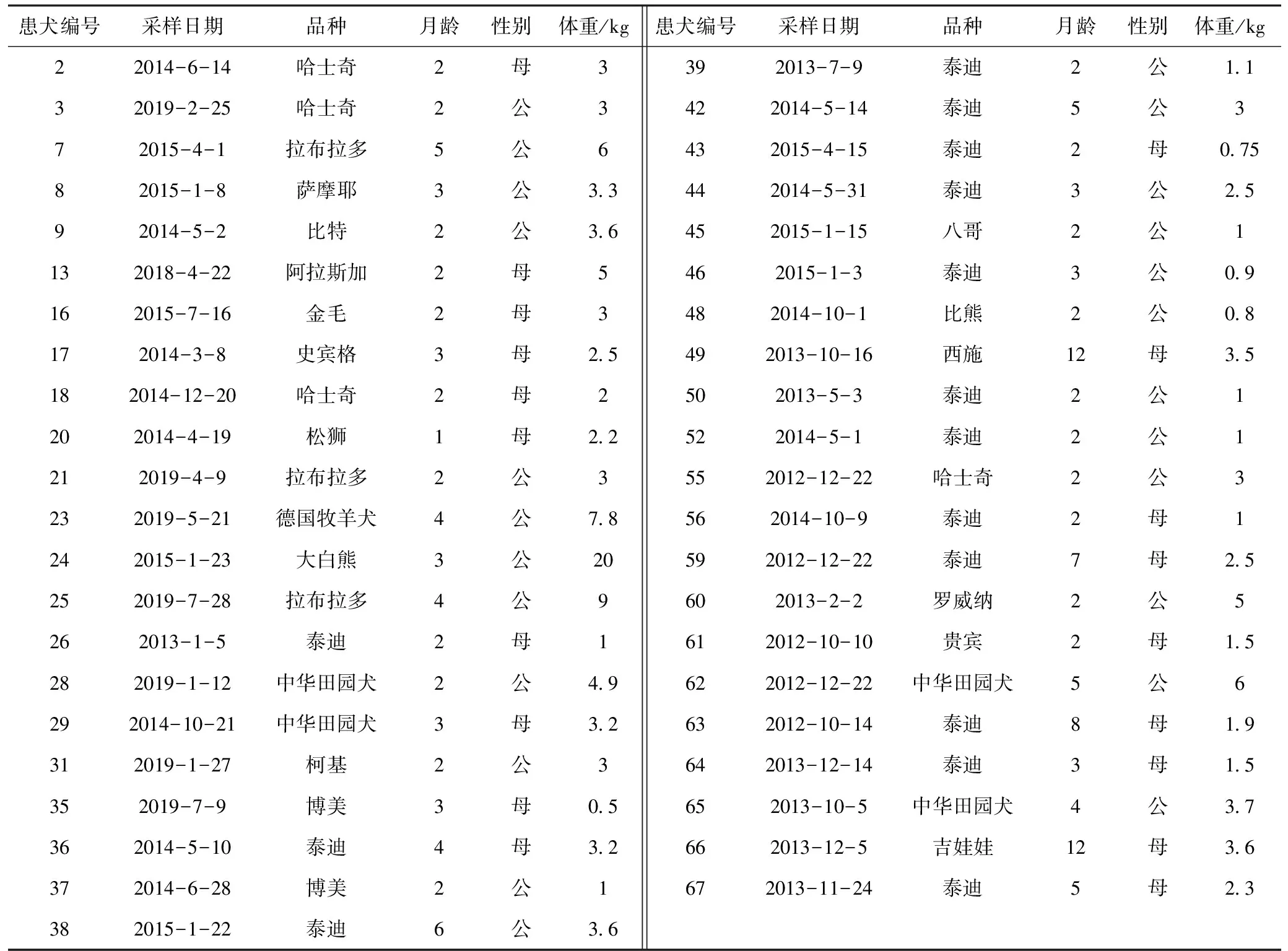
表1 43份犬细小病毒病病例患犬信息
1.2 CPV VP2基因片段PCR检测试验试剂
2×TaqPCR Master Mix、Goldview、Agarose、超纯水、DL2000 DNA Marker,购自南京擎科生物有限公司。
1.3 CPV VP2基因片段序列测定
引物设计:根据GenBank中的一株基因型为CPV-2a(登录号为KT382542)的VP2基因序列,设计1对引物,序列如下:上游引物CPV-F:5′-GATTTCTACGGGTACTTT-3′,下游引物CPV-R:5′-TAGGTGCTAGTTGAGATTTT-3′,预计扩增片段大小为1 625 bp。引物由南京擎科生物有限公司合成。
DNA模板制备:取43份CPV粪便病料用生理盐水稀释100倍,然后用Thermo冷冻离心机4 ℃ 12 000 r/min离心5 min,取上清液 4 ℃保存备用。
目的基因片段的扩增:采用25 μL体系:2×TaqPCR Master Mix 12.5 μL,上下游引物各1 μL,DNA模板0.5 μL,双蒸水10 μL。PCR反应程序为:94 ℃预变性5 min;94 ℃变性1 min,50 ℃退火1 min,72 ℃延伸1.5 min,40个循环;72 ℃延伸10 min。取5 μL PCR产物用加入Goldview 5 μL/100 mL 1.2%的琼脂糖凝胶进行电泳(电压为140 V,电流为200 mA,电泳时间为45 min),紫外检测仪下观察扩增条带并拍照。
测序分析:取30 μL PCR产物送南京擎科生物有限公司测序。得到测序结果后,使用Lasergene软件将43份测序结果与GenBank中已知CPV基因型VP2蛋白基因进行比较,分析43份样品CPV基因型。同时将获得的43份测序结果向NCBI申请GenBank登录号。
2 结果与分析
2.1 VP2基因检测
43份CPV患犬粪便病料经过PCR扩增均扩增出1 625 bp的目的片段。部分检测结果见图1。
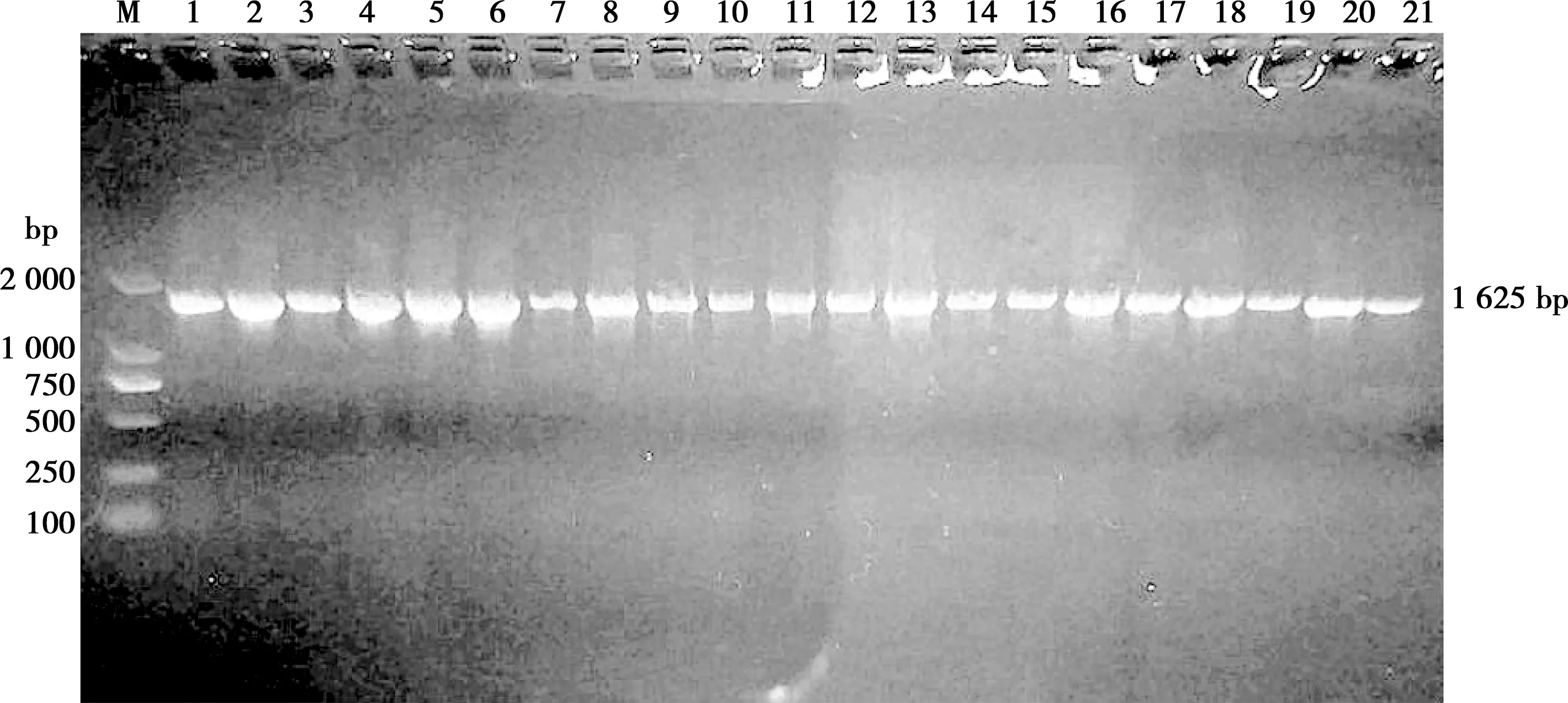
M. DL2000 DNA Marker;1~21. 部分样品
2.2 VP2基因测序及分型
将43份PCR产物送南京擎科生物有限公司测序,测序结果经ContigExpress基因拼接软件拼接均获得1 548 bp核苷酸序列片段,经过向NCBI申请获得43个GenBank登录号,为MW242345~MW242387。使用MegAlign软件将43份核苷酸序列片段编码的变异VP2蛋白氨基酸与GenBank中已知CPV基因型(FPV、CPV-2、CPV-2a、CPV-2b、New-CPV-2a、New-CPV-2b、CPV-2c,每个基因型各选取2个)VP2变异蛋白氨基酸进行比较,CPV基因型结果见表2。
从表2可以看出,FPV基因型VP2蛋白关键氨基酸位点依次为80K、87M、93K、103V、267F、297S、300A、323D、324Y、370Q、375D、426N、440T、564N、568A;CPV-2基因型VP2蛋白关键氨基酸位点依次为80R、87M、93N、103A、267F、297S、300A、323N、324Y、370Q、375N、426N、440T、564S、568G;由FPV变异为CPV-2主要是VP2蛋白中7个氨基酸位点80K→R、93K→N、103V→A、323D→N、375D→N、564N→S、568A→G发生了变异。
CPV-2a基因型VP2蛋白关键氨基酸位点依次为80R、87L、93N、103A、267F、297S、300G、323N、324Y、370Q、375D、426N、440T、564S、568G;由CPV-2变异为CPV-2a主要是VP2蛋白中3个氨基酸位点87M→L、300A→G、375N→D发生了变异,其中375N→D是发生了回复突变的变异。

表2 CPV VP2蛋白氨基酸序列变异和基因型分析

续表2
CPV-2b基因型VP2蛋白关键氨基酸位点依次为80R、87L、93N、103A、267F、297S、300G、323N、324Y、370Q、375D、426D、440T、564S、568G;由CPV-2a变异为CPV-2b主要是VP2蛋白中1个氨基酸位点426N→D发生了变异,其中意大利FJ005263毒株还发生了297S→A的关键变异,但由于没有发生267F→Y 、324Y→I、440T→A的关键变异,该毒株应属于介于CPV-2b与New-CPV-2b之间类型,因此本文仍将该毒株归属于CPV-2b基因型。
New-CPV-2a基因型VP2蛋白关键氨基酸位点依次为80R、87L、93N、103A、267Y、297A、300G、323N、324I、370Q、375D、426N、440A、564S、568G;由CPV-2a变异为New-CPV-2a主要是VP2蛋白中3个氨基酸位点267F→Y、324Y→I、440T→A发生了变异。
New-CPV-2b基因型VP2蛋白关键氨基酸位点依次为80R、87L、93N、103A、267Y、297A、300G、323N、324I、370Q、375D、426D、440A、564S、568G;由CPV-2b变异为New-CPV-2b主要是VP2蛋白中3个氨基酸位点267F→Y、324Y→I、440T→A发生了变异。
CPV-2c基因型VP2蛋白关键氨基酸位点依次为80R、87L、93N、103A、267Y、297A、300G、323N、324I、370R、375D、426E、440T、564S、568G;由New-CPV-2b变异为CPV-2c主要是VP2蛋白中3个氨基酸位点370Q→R、426D→E、440A→T发生了变异,其中440A→T是发生了回复突变的变异。
基于上述标准,本试验中所检测的43份VP2蛋白氨基酸序列,可确定26株CPV为New-CPV-2a基因型,占比60.5%;其中67号毒株VP2蛋白关键氨基酸位点依次为80R、87L、93N、103A、267F、297A、300G、323N、324I、370R、375D、426N、440T、564S、568G,该毒株VP2蛋白关键氨基酸位点发生了324Y→I的关键变异,但由于没有发生267F→Y、440T→A的关键变异,该毒株应属于介于CPV-2a与New-CPV-2a之间类型,本文暂定该毒株归属于New-CPV-2a基因型;9株CPV为New-CPV-2b基因型,占比20.9%;8株为CPV-2c基因型,占比18.6%。
2.3 VP2基因遗传演化分析
应用MEGA5软件将 43份样品的VP2基因氨基酸序列与国内外部分参考毒株进行比较并绘制系统进化树,结果见图2。

图2 VP2蛋白氨基酸序列遗传演化分析
从图2可以看出,25株CPV毒株与GenBank中MH476590、MK518017两株New-CPV-2a基因型毒株在同一分支;67号毒株既不与GenBank中M24003、MN451670两株CPV-2a基因型在同一分支,也不与GenBank中MH476590、MK518017两株New-CPV-2a基因型毒株在同一分支,经VP2蛋白关键氨基酸位点分析应属于介于CPV-2a与New-CPV-2a之间类型,本文暂将该毒株归属于New-CPV-2a基因型。9株CPV毒株与GenBank中KT162028、MH476588两株New-CPV-2b基因型毒株在同一分支;8株CPV毒株与GenBank中MH660525、MK806284两株CPV-2c基因型毒株在同一分支。
3 讨论
本试验研究结果表明,南京市某宠物医院2012—2019年43份犬细小病毒病患犬的CPV基因型中,New-CPV-2a占比最高,为60.5%;其次为New-CPV-2b(20.9%)和CPV-2c(18.6%)。从采样时间来看,2012—2015年35份样品CPV基因型为New-CPV-2a和New-CPV-2b,其中New-CPV-2a占比74.3%,New-CPV-2b占比25.7%;没有检测出CPV-2、CPV-2a、CPV-2b和CPV-2c基因型。2016—2017年没有采集到犬细小病毒病病料,因此这两年发病情况和基因型分布情况无法得知。2018—2019年8份病料CPV基因型全部为CPV-2c基因型,主要原因可能由于2016—2017年南京市采取全市犬只基本免疫接种荷兰英特威犬细小病毒、犬瘟热病毒、犬传染性肝炎病毒、犬副流感四联弱毒疫苗,这样可能对CPV形成一种免疫压力,导致2018年后CPV基因发生突变,从而使CPV-2c基因型大幅度增加。经调查,本试验中43只犬细小病毒病患犬发病前均没有注射过犬细小病毒疫苗。
邱薇等[10]在长春、沈阳等地区2005年检测发现6 株CPV-2a基因型和3 株CPV-2b基因型毒株,但病料采集年份未交代;缪勤等[11]2005年检测发现南京1982—2004年5株毒株为CPV-2b基因型;2009年郭伟等[12]在上海鉴定到New-CPV-2a基因型CPV-SH毒株;2010年刘志强等[13]在新疆鉴定到New-CPV-2a 基因型CPV-SHZ毒株;2016年王建科等[14]从长春检测到一株New-CPV-2b基因型 毒株CPV-JL13-1。CPV-2c基因型国内最早于2010年由张仁舟等[15]报道,通过检测2009年收集的12份CPV阳性患犬粪便样品,鉴定到2株CPV-2c基因型。近年来CPV-2c基因型陆续被报道,根据徐闰等[16]2018年报道,2016—2017年从广西南宁地区宠物医院采集的12份CPV阳性患犬粪便中,检测到3株New-CPV-2a、3株New-CPV-2b和6株CPV-2c基因型毒株。施鹏飞等[17]报道,从2019年武汉某宠物医院CPV阳性患犬粪便中检测到1株CPV-2c基因型毒株。上述报道与本文检测的43份南京犬细小病毒基因型发生年份基本相符合。但根据张淮瑜等[18]报道,2018年5月至2019年5月从银川市某宠物医院收集的14份CPV 阳性病犬粪便样品中,检测到3株New-CPV-2a和2株New-CPV-2b毒株,没有检测到CPV-2c毒株,此结果与本人检测的南京地区2018—2019年8株CPV毒株全部是CPV-2c基因型不相符合,可能是地区差异所导致。
综上,我国在2010年前患犬感染的CPV基因型主要为CPV-2a、CPV-2b,2010—2016年主要为New-CPV-2a、New-CPV-2b基因型,2017年以后则以CPV-2c基因型为主。本研究结果丰富了CPV的流行病学资料,也为南京地区犬细小病毒病的防控提供了科学依据。

