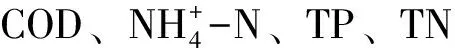猪场污水异养硝化-好氧反硝化菌筛选及性能研究
黄祚建,张瑞昊,王军,陈明银,陶利文,任竹青
(1. 华中农业大学动物科学技术学院,湖北 武汉 430070;2. 十堰市畜牧技术推广站,湖北 十堰 442000;3. 武汉市江夏区农业产业化服务中心,湖北 武汉 430200;4. 武汉市动物疫病预防控制中心,湖北 武汉 430016)
目前传统的生物脱氮技术A/O、SBR、氧化沟等对生活污水和工业污水有比较好的效果。对于猪场污水而言虽然其效果较好但在运行成本和处理价格的压力之下难以在中小型养殖场进行推广应用。传统生物脱氮工艺在整个脱氮流程中必须要经历完整的从氨氮到正硝酸盐之后,从正硝酸盐返回亚硝酸盐,最后经反硝化作用完成脱氮[1]。在这一流程中,制约脱氮效果的主要因素一方面是硝化菌群硝化能力是能否让水中有充足的硝酸盐及衍生物的积累,另一方面就是在反硝化过程中是否能够获得充足的有效碳源供给[2]。硝化菌群繁殖速度慢、代际间隔较长,因此选择较长的污泥龄是处理工艺中侧重脱氮方向的策略之一[3]。然而为了保证达标排放,猪场废水也有较高的除磷要求。磷代谢中,需要通过去除污泥的方式将已经吸收磷盐的聚磷菌去除,因此除磷的压力迫使反应器难以维持较长的污泥龄[4]。因此在有限污泥龄内提高反应器的脱氮效率是工艺改进的重要方向。
另一方面来看猪场废水的实际可生化性并没有达到传统印象中的易于生化废水。在实际应用中,生物反应器处理的废水大多是以沼液的形式作为进水。实际上经过厌氧处理后沼液的可生化性已经变得十分有限,在经过好氧处理后对于脱氮而言碳源也可能成为其限制因素之一[5]。
异养硝化-好氧反硝化(HN-AD)菌的作为一种同时具有能进行硝化反应和反硝化反应能力的细菌,可以为传统生物脱氮工艺降成本改造提供新的思路,也可以为新的脱氮工艺-同步硝化反硝化工艺(SND)提供相应菌株。
自Skerman研究团队在1951年首次发现了好氧反硝化现象,认识到反硝化反应也可以在好氧条件下进行,到Robertson等1985年分离出第1株菌异养硝化-好氧反硝化菌(Thiosphaerapantotropha)。随着人们对异养硝化-好氧反硝化菌的研究在逐渐深入,通过各种材料先后筛选出多种异养硝化-好氧反硝化菌株[6],主要集中在假单胞菌属(Pseudomonassp.)、产碱杆菌属(Alcaligenessp.)、副球菌属(Pracoccussp.)、芽孢杆菌属(Bacillussp.)等[7],但是目前仍还有新的异养硝化-好氧反硝化菌未被发现和认知[8]。
1 材料与方法
1.1 材料选择及试验设计
以猪场污水处理系统中污泥为原材料曝气培养驯化,采用BTB培养基筛选好氧反硝化菌株,再检测是否有异养硝化能力;挑选具有高效能的HN-AD菌株进行形态特征和16S rDNA序列分析,鉴定种属;探讨不同的生态因子(温度、pH、溶氧量)和水体氨氮浓度对筛选HN-AD菌的生长及脱氮性能影响;将筛选的HN-AD菌投入猪场污水中,观察菌株在猪场污水中实际应用效果。
1.1.1 菌株的筛选鉴定
将采集的污泥、污水在硝化富集培养基中进行好氧曝气富集培养2个月后,取反应器内培养后的活性污泥制成细菌悬液,采用倍比稀释法稀释成 10-1~ 10-7梯度的菌悬液;再用灭菌接种环蘸取菌液在 BTB 固体培养基上进行多轮划线培养纯化,直至每次得到的菌落形态特征一致,不会出现其他的杂菌菌落;运用菌株形态学鉴定和16S rDNA序列分析技术,鉴定所筛选的菌株。
1.1.2 探究各生长因子对菌株生长性能的影响
考虑到各类环境因素在菌株实际应用中可能会影响,因此设计以下3组单一变量试验测试菌的最佳生长条件。所有试验所使用的培养基均为异养氨氧化培养基。由于筛选过程中的温度为30 ℃、pH=7、转速为120 r/min等条件,因此在控制单一变量时,其他条件均采用筛选条件进行设定。所得试验组如下:①研究温度对HN-AD菌的生长及脱氮性能的影响,设定3组单因素控制试验反应条件为:分别置于温度为20 ℃、30 ℃、40 ℃、pH=7,转速频率为120 r/min 的摇床中培养;②研究转速对HN-AD菌的生长及脱氮性能的影响,设定试验反应条件为:分别置于温度为30 ℃、pH=7,转速为60、120、240 r/min 的摇床中培养;③研究pH对HN-AD菌的生长及脱氮性能的影响,设定试验反应条件为:分别置于温度为30 ℃、pH=5、6、7、8、9,转速频率为120 r/min 的摇床中培养。
1.1.3 菌株耐氨氮能力测定
1910年夏,俄国派以波波夫为首的考察队前往唐努乌梁海进行详细考察,在途中成员奥古斯图斯焚毁了唐努乌梁海西南边境察布齐雅勒达坝的界牌⑥ 樊明方.唐努乌梁海历史研究〔M〕.北京:中国社会科学出版社,2007.第215页。,然后俄国政府开始公然提出乌梁海是“有争议地区”,无视历史上中俄条约的规定,为以后侵占唐努乌梁海制造根据。1911年初,俄国出现大量有关唐努乌梁海的书籍和报刊,歪曲事实,鼓吹侵占唐努乌梁海。
1.1.4 菌株对猪场污水实际处理效果
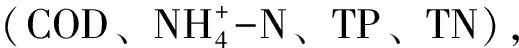
1.2 试验药品和测定指标方法
1.2.1 试验中所用到的培养基及成分配比
硝化富集培养基:(NH4)2SO40.5 g;柠檬酸三钠 4.08 g;KH2PO41.0 g;氯化亚铁0.5 g;硫酸镁1.0 g,蒸馏水定容至1 000 mL。
溴百里酚蓝(BTB)筛选培养基:KNO31.0 g;L-天冬酰胺1.0 g;柠檬酸三钠8.5 g;KH2PO41.0 g;氯化亚铁0.05 g;硫酸镁1.0 g;氯化钙0.2 g;琼脂20 g;0.1%溴百里酚蓝酒精溶液(BTB)5 mL,蒸馏水定容至1 000 mL。
异养氨氧化培养基:(NH4)2SO40.472 g;柠檬酸三钠4.902 g;K2HPO40.2 g;硫酸镁0.05 g;硫酸亚铁 0.01 g;硫酸锰 0.01 g;NaCl 0.12 g蒸馏水定容至1 000 mL。
以上3种培养基灭菌前均需调节pH 7.0~7.5,灭菌条件为 121 ℃,20 min。
1.2.2 试验中测定指标方法
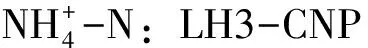
1.3 数据统计与分析
试验数据用Excel 2007和SPSS 18.0进行统计分析,主要进行t检验来判断组间数据差异显著性,所有结果用“平均值±标准差”表示。
2 结果与分析
2.1 菌株的筛选和鉴定
通过对富集到的菌株提取DNA并进行16 s测序比对,结果与开塞利节杆菌(ArthrobacterKeyseri)相似度达99%。革兰染色显示该菌为革兰阳性菌,明场观察该菌呈现短杆棒状,菌落呈淡黄色不透明点状分布,具有产碱能力。根据细菌生长形态特征参照《伯杰氏系统细菌学手册》和《常见细菌系统鉴定手册》确证与测序结果一致,该菌为开塞利节杆菌。在明场下的菌落形态和革兰染色结果分别为图1(A)和图1(B),图1(C)为系统进化树Target为本试验中筛到的菌株。
2.2 常见因素对菌生长及除氮性能影响
为探究该菌最佳生长条件而设置的温度、pH值、转速三组单因素试验。结果如表1所示,开塞利节杆菌除氮性能最佳生长条件分别为温度为30 ℃,转速120 r/min,pH为7,最适生长条件下经过36 h处理后,培养基中氨氮浓度由110.0下降至6.4 mg/L,去除率可达94.2%。
2.3 高氨氮浓度废水对菌生长性能影响
为探究开塞利节杆菌对氨氮浓度的耐受能力而设计5组试验。结果如表2所示,开塞利节杆菌具有很强的耐高氨氮浓度能力,可以在氨氮浓度达2 000 mg/L的环境中生长,且有一定氨氮出去率,在氨氮浓度为200~800 mg/L 的环境条件下,氨氮去除率均超过70%。
2.4 菌株对猪场废水实际处理效果测定
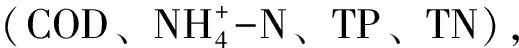
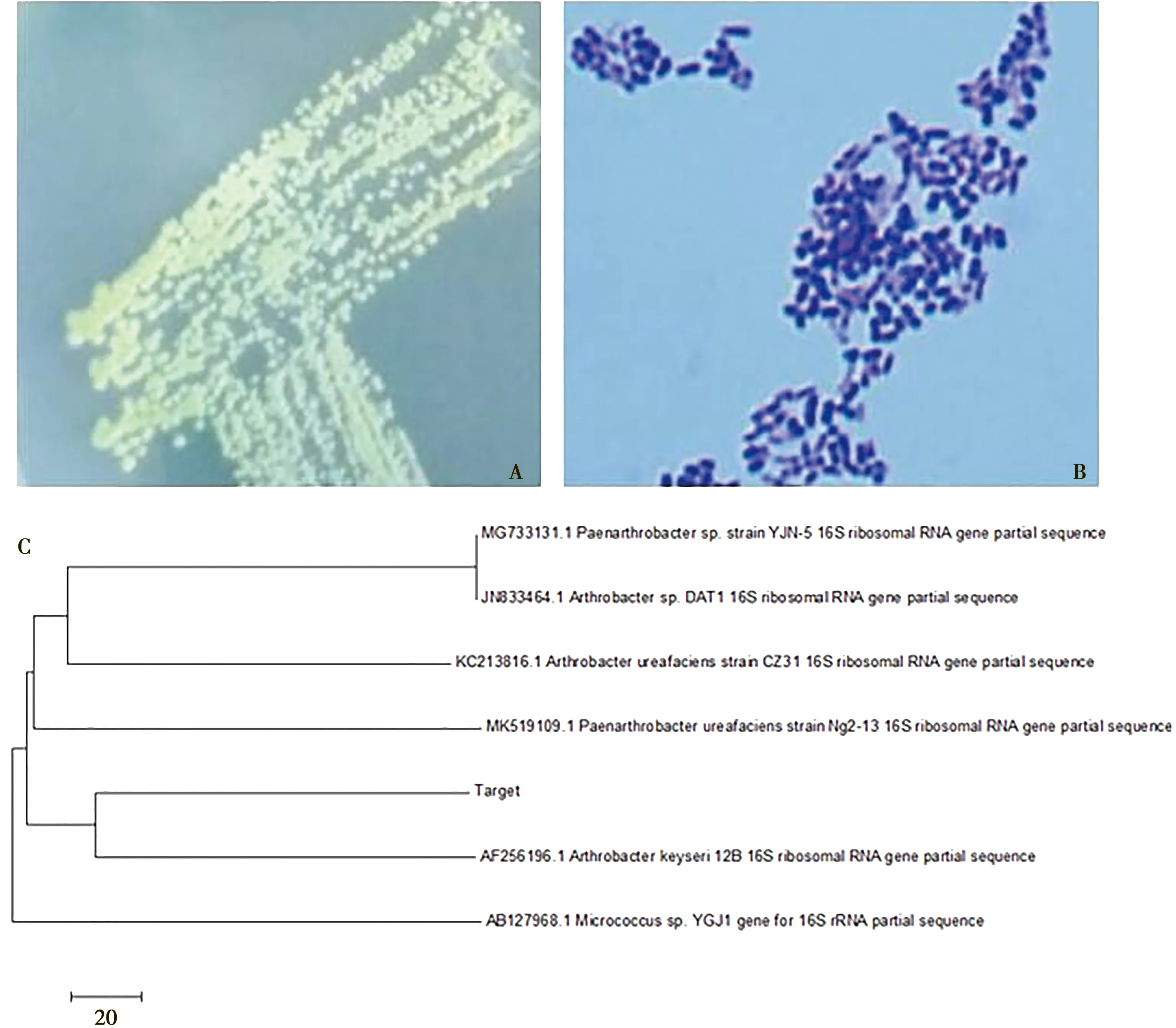
图1 开塞利节杆菌的形态与系统进化树
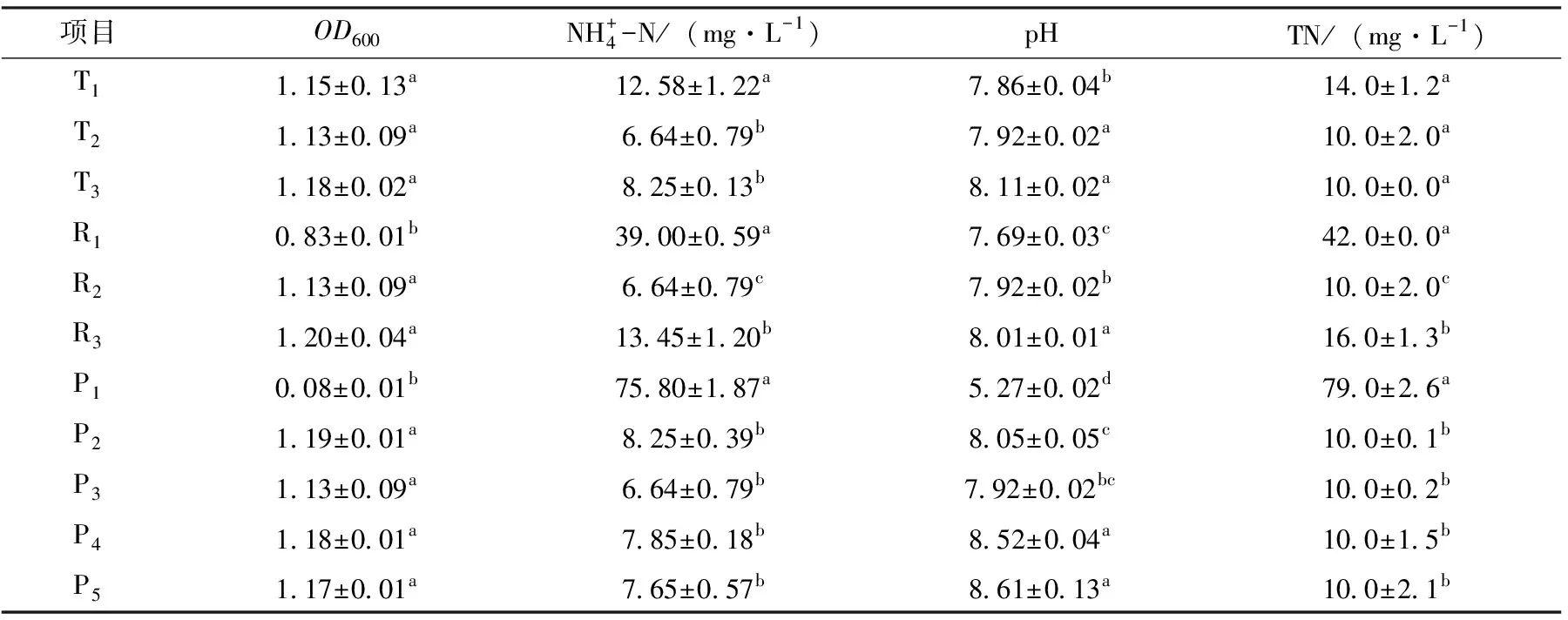
表1 温度、转速、pH对菌株生长及性能影响

表2 不同浓度的氨氮含量对菌生长及性能影响
3 讨论
本试验利用控制变量法分别测定温度、转速、pH及氨氮浓度4种生长影响因子对开塞利节杆菌的生长发育及氨氮去除率影响,数据分析结果显示,开塞利节杆菌在温度为30 ℃,pH=7和转速为120 r/min时生长最佳,36 h氨氮去除率可达94.28%;在较低的温度(t=20 ℃)、低转速(r=60 r/min)、酸性条件(pH=5)条件下,开塞利节杆菌生长较慢,甚至在36 h振荡培养后还未进入平台期,氨氮去除率也大幅度下降。可见在低温、低溶氧量和pH过低的条件下开塞利节杆菌的生长发育都会受到一定程度的抑制,影响处理系统的脱氮效率。一方面低温、过酸条件的环境可能会降低影响HN-AD菌体内相关酶的活性,从而影响系统的脱氮性能;另一方面温度还会影响该过程中作为基质的游离氨浓度。4种HN-AD菌株在生长发育和脱氮的过程中,pH会有一定程度的上升,其中开塞利节杆菌在30 ℃条件下36 h振荡培养后pH从6.07增长至8.02,可见HN-AD 过程产碱进而导致体系pH值升高,与潘丹研究P9菌(申氏杆菌属Shinellasp.)在脱氮的同时pH值从6.8迅速升至8.9,最后趋于稳定的结果相一致[9]。本次试验筛选的开塞利节杆菌耐受pH能力在6~9,与廖小红等[10]研究的BacilluscereusWXZ-8和严新杰等[11]研究Delftiasp. pH 耐受范围在5~9一致。
猪场污水作为一种含高浓度氨氮有机物废水,利用生物脱氮技术来处理含高浓度氨氮污水,不仅考虑到微生物自身的脱氮能力的强弱,还应该考虑猪场废水的水质条件是否会因其毒性作用而对处理菌群产生不利影响。众所周知猪场废水中的污染物浓度偏高,即使是经过一轮厌氧处理后残留的沼液,其中的氨氮、总磷、COD等污染物浓度较高且生物毒性较强,严重影响污泥反应器去除效果。本研究中的菌株初始筛选的环境就是直接收纳猪场废水的兼性塘,在筛选过程中分别对低氨氮水平(200 mg/L、400 mg/L)、中氨氮水平(800 mg/L)与高氨氮水平(1 600 mg/L、2 000 mg/L)进行了不同的耐受性验证。结果显示在低氨氮浓度组中开塞利节杆菌完全能够正常生长发育,并在36 h前到达平台生长状态,氨氮处理去除率在80%以上;中等氨氮水平下开塞利节杆菌生长受到一定抑制,尽管相比低氨氮组氨氮去除率降低,但其去除率仍能维持在75%以上;高氨氮浓度组开塞利节杆菌生长繁殖受到显著抑制,当氨氮负荷为1 600 mg/L时,开塞利节杆菌仍维持 52.07% 的氨氮去除率;当氨氮负荷增加至2 000 mg/L时,由于本身试验组的生物毒性较强,此时开塞利节杆菌的氨氮去除率仅为33.64%。但是通过对氨氮去除的绝对量进行计算,我们认为在高氨氮试验组中处理能力的下降不仅是因为高氨氮带来的生物毒性对生长的抑制,同时还可能是试验条件中C/N比值的改变迫使菌群调整了生长代谢的主要途径,碳源供给不足对开塞利节杆菌的脱氮效果产生了影响。在氨氮耐受试验中,氨氮的浓度作为该试验中唯一变量,导致随着氨氮水平的升高C/N比值不断降低,针对试验中氨氮去除绝对量进行分析,可以认为本菌在高氨氮水平下仍有较好的耐受能力和处理效率。
通过添加外源菌群提高活性污泥法处理效果的过程当中,外源菌群定植并成为优势菌群仅是一种情况;另一类则是在各类因素(外源菌群、处理药剂等添加或工艺调整等)综合作用下优化了菌群的组成结构,从而获得处理效果的提升。本试验以猪场废水兼行塘中污泥为原材料,筛选获得的菌株并进行了相应的氨氮耐受试验,证明了其在猪场废水中能够有效的适应生长。实效试验中,通过在猪场废水处理系统中添加菌液,对前后进出水状况和处理效果进行综合评判,最终证明了其确实能够在一定程度上提高该系统的氨氮和总氮去除效果。
4 结论