miR-27a-3p靶向HOXA5基因通过Wnt/β-catenin信号通路调控糖尿病患者创面愈合*
葛嘉媛, 温立霞, 李 勤△
(1广州中医药大学,广东广州510000;2湖北省宜昌市第一人民医院,湖北宜昌443000)
糖尿病创面愈合不良是糖尿病患者最常见的并发症,拥有较高的发病率和复发率,是世界范围内非创伤性截肢的主要原因[1-2]。然而糖尿病患者伤口愈合不良的原因尚不清楚。血管生成是指从现有血管中生成新的血管,在伤口修复中起着重要的作用。各种类型的细胞,特别是内皮细胞,有助于血管生成[3]。微小RNA(microRNA,miRNA,miR)是高度保守的内源性小的非编码RNA 分子,长度在18~25个核苷酸之间,参与到包括糖尿病伤口愈合在内的许多生物过程[4],如miR-26a 在糖尿病小鼠创面组织中表达增多,抑制miR-26a表达可诱导创面血管的新生和肉芽组织形成,从而促进创面愈合[5]。研究表明,miR-27a-3p 的下调增加了大鼠脑微血管内皮细胞单层的通透性,降低了细胞的增殖和迁移[6]。抗血管生成同源异型盒基因A5(homeobox A5,HOXA5)基因的mRNA和蛋白水平均在乙二醛酶1敲除小鼠中升高,沉默HOXA5基因可促进主动脉内皮细胞迁移和侵袭[7]。Wnt/β-catenin 信号是高度保守的信号转导途径,在调节血管生成方面发挥关键作用[8-9]。激活的Wnt/β-catenin信号通路与糖尿病伤口愈合有关[10]。然而miR-27a-3p 对糖尿病创面愈合的影响及机制尚不清楚。基于此,本研究利用高糖诱导人微血管内皮细胞(human microvascular endothe⁃lial cells,HMECs)模拟糖尿病内皮细胞损伤,考察miR-27a-3p 在内皮细胞活力、迁移和侵袭能力中的作用,并结合HOXA5基因和Wnt/β-catenin 信号通路,初步探讨其分子机制。
材料和方法
1 细胞和试剂
HMECs 购自北纳生物公司。内皮细胞培养基ECM 购自Sciencell;葡萄糖购自Sigma;miR-27a-3p mimic、HOXA5 siRNA(si-HOXA5)、pcDNA-HOXA5及各自阴性对照序列购自广州锐博生物有限公司;抗HOXA5、细胞周期蛋白D1(cyclin D1)、基质金属蛋白酶2(matrix metalloprotease 2,MMP2)、MMP9和β 连环蛋白(β-catenin)抗体及辣根过氧化物酶标记的Ⅱ抗购自Abcam。
2 临床组织标本
9 例糖尿病和非糖尿病创面愈合组织标本来自于本院糖尿病患者和志愿者。在无菌环境中,切取创面愈合组织标本置于液氮保存。所有实验和方案均获得患者的知情同意。
3 方法
3.1 细胞培养、细胞转染与处理 HMECs在内皮细胞培养基ECM 中培养,ECM 培养液包含500 mL基础培养基、25 mL 胎牛血清、5 mL 内皮细胞生长因子和5 mL 青霉素/链霉素溶液,于37℃、5% CO2的培养箱中生长。转染前,HMECs中加入30 mmol/L的葡萄糖进行处理,模拟糖尿病HMECs 损伤,记为高糖(high glucose,HG)组,并以正常培养的细胞为正常对照(normal control,NC)组。HMECs 转染时,按照Lipo⁃fectamine 2000 试剂说明书的步骤,将miR-27a-3p mimic、si-HOXA5、pcDNA-HOXA5 及各自阴性对照序列转染至细胞,并使用30 mmol/L 的葡萄糖进行处理。转染48 h后,收集细胞备用。
3.2 检测miR-27a-3p 和HOXA5 mRNA 的表达 收集糖尿病、非糖尿病创面愈合组织或HMECs,根据制造商的方案,采用Trizol试剂提取总RNA。然后通过逆转录试剂盒进行cDNA 的合成,SYBR Green 试剂盒用于进行qPCR 检测。得到的数据均使用2-ΔΔCt方法进行分析。miR-27a-3p 的引物序列为5'-CGC⁃GTTCACAGTGGCTAAGT-3'( 正 向)和 5'-GTG⁃CAGGGTCCGAGGTATTC-3'(反向);内参照U6 的引物序列为5'-CTCGCTTCGGCAGCACA-3'(正向)和5'-AACGCTTCACGAATTTGCGT-3'(反向);HOXA5 的引物序列为5'-AGATCTACCCCTGGATGCGC-3'(正向)和5'-CCTTCTCCAGCTCCAGGGTC-3'(反向);内参照β-actin 的引物序列为5'-GGAGATTACTGCCCT⁃GGCTCCTAGC-3'(正向)和5'-GGCCGGACTCATCG⁃TACTCCTGCTT-3'(反向)。
3.3 MTT 法测定细胞活力 收集各处理组的HMECs,调整密度为1×108/L,接种到96孔板中,每孔100 μL,培养48 h,每孔加入20 μL MTT 溶液,孵育4 h,加入100 μL 二甲基亚砜,酶标仪测定490 nm 处的吸光度(A)值,以评估细胞活力。细胞活力(%)=实验组A值/对照组A值×100%。
3.4 Transwell 小室法检测细胞迁移和侵袭能力(1)检测细胞迁移:HMECs 用无血清培养基稀释后接种于上室,同时在下室添加500 μL 含胎牛血清的培养基作为引诱剂。于37℃、5% CO2的环境中孵育24 h。无菌棉签抹去多余细胞,加入4%甲醛固定后采用1%结晶紫染色,置于光学显微镜下计数。(2)检测细胞侵袭:上室用Matrigel 覆盖,静置3~4 h,然后将无血清培养基稀释的HMECs 接种于上室。后续步骤与细胞迁移检测步骤相同。
3.5 双萤光素酶活性检测miR-27a-3p 和HOXA5 的靶向关系 用StarBase(http://starbase. sysu. edu.cn/)预测miR-27a-3p和HOXA5的结合位点。构建含有miR-27a-3p 结合位点的HOXA5-3'UTR 野生型(HOXA5-WT)及突变型(HOXA5-MUT)报告基因载体,通过Lipofectamine 2000 试剂在HMECs 中共转染miR-27a-3p mimic 和野生型及突变型报告基因载体。48 h后进行双萤光素酶活性的测定。
3.6 Western blot 测定HOXA5、cyclin D1、MMP2、MMP9 和β-catenin 的蛋白表达 HMECs 总蛋白的提取使用RIPA 缓冲液进行,并通过二喹啉甲酸(bicin⁃choninic acid,BCA)蛋白质测定试剂盒量化提取的蛋白。之后吸取等量蛋白,上样到新鲜制备的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)凝胶的每个泳道中,以分离蛋白。2 h 后将胶上蛋白转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。PVDF 膜加入5%脱脂牛奶封闭1 h。然后将膜与抗HOXA5、cyclin D1、MMP2、MMP9 和β-catenin抗体或内参照β-actin 抗体4℃孵育过夜。次日,PVDF 膜放至Ⅱ抗中孵育2 h,用增强化学发光试剂显影,ImageJ 软件分析,计算HOXA5、cyclin D1、MMP2、MMP9 和β-catenin 蛋白条带灰度与β-actin 蛋白条带灰度的比值。
4 统计学处理
采用SPSS 22.0 软件统计和分析实验数据。计量资料以均数±标准差(mean±SD)表示。两组间数据差异比较采用t检验;多组间数据差异比较采用单因素方差分析,组间多重比较采用SNK-q 检验。以P<0.05为差异有统计学意义。
结 果
1 糖尿病患者和非糖尿病患者创面愈合组织中miR-27a-3p和HOXA5的表达
qPCR和Western blot检测结果显示,同非糖尿病患者创面愈合组织相比,糖尿病患者创面愈合组织中miR-27a-3p 表达量显著减少(P<0.05),而HOXA5的mRNA 和蛋白表达量显著增加(P<0.05),见图1、表1。
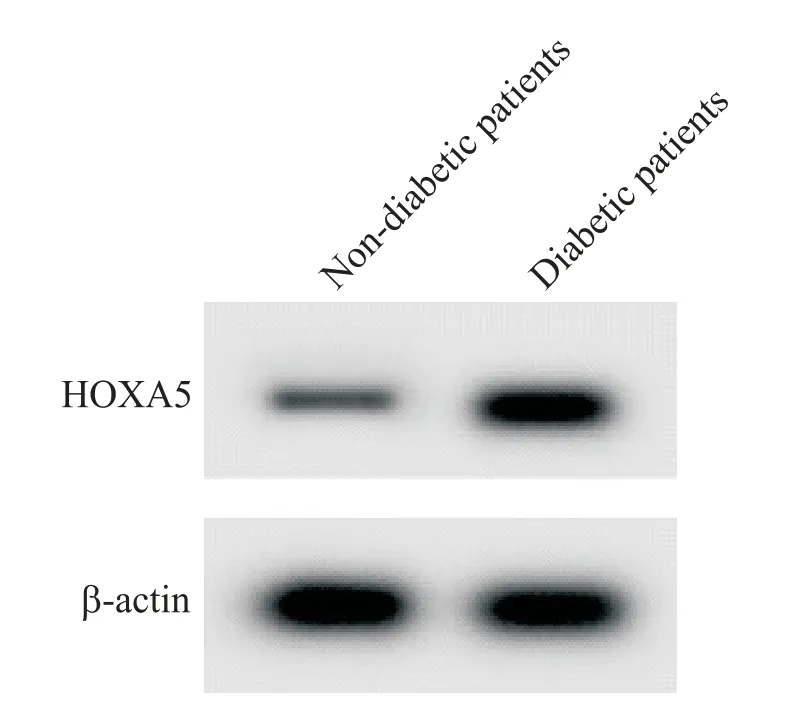
Figure 1. Western blot detection of HOXA5 protein expression.图1 Western blot检测HOXA5蛋白的表达

表1 糖尿病患者和非糖尿病患者创面愈合组织中miR-27a-3p和HOXA5的表达Table 1. The expression of miR-27a-3p and HOXA5 in wound healing tissues of diabetic and non-diabetic patients(Mean±SD. n=9)
2 高表达miR-27a-3p 对高糖处理的HMECs 活力、迁移和侵袭的影响
与NC比较,HG诱导后HMECs的miR-27a-3p表达量显著减少,细胞活力、迁移细胞数量、侵袭细胞数量及cyclin D1、MMP2 和MMP9 的蛋白水平显著降低(P<0.05);与miR-NC+HG 组比较,高表达miR-27a-3p 明显增加HG 处 理后HMECs 中miR-27a-3p 表达量、细胞活力、迁移细胞数量、侵袭细胞数量及cy⁃clin D1、MMP2 和MMP9 蛋白表达量(P<0.05),见图2、表2。
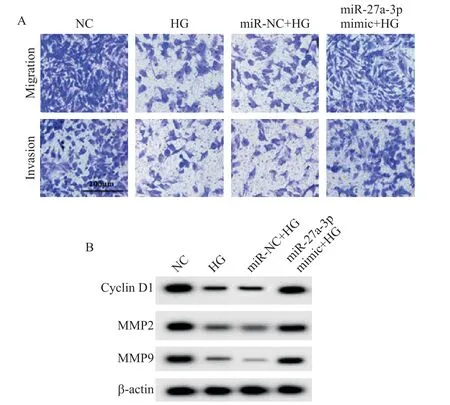
Figure 2. Effects of high expression of miR-27a-3p on the migration and invasion of HMECs treated with high glucose. A:Transwell assay was used to detected the migration and invasion of HMECs;B:Western blot was used to detect the protein expression of cyclin D1,MMP2 and MMP9.图2 高表达miR-27a-3p对高糖处理的HMECs迁移和侵袭的影响
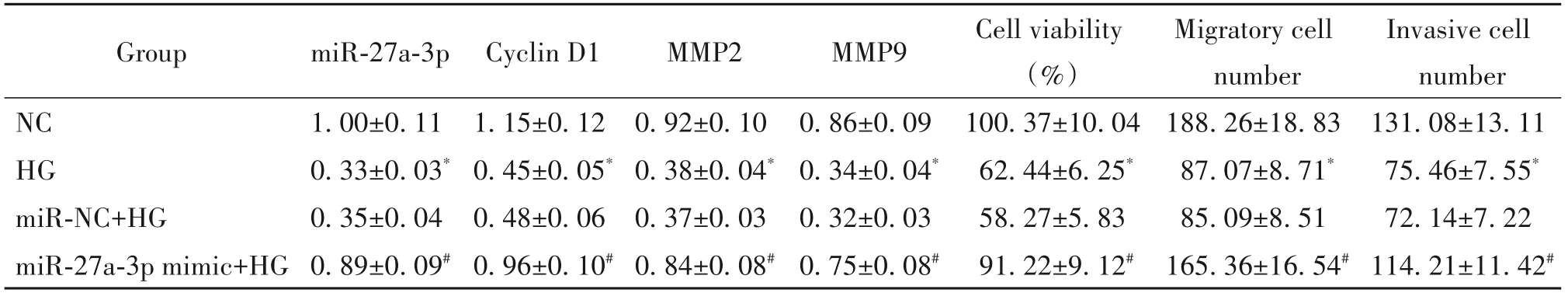
表2 高表达miR-27a-3p对高糖处理的HMECs活力、迁移和侵袭的影响Table 2. Effects of high expression of miR-27a-3p on the viabilityy,migration and invasion of HMECs treated with high glucose(Mean±SD. n=9)
3 改变HOXA5 的表达水平对高糖处理的HMECs活力、迁移和侵袭能力的影响
与si-NC+HGzu 比较,低表达HOXA5 明显降低高糖处理的HMECs 中HOXA5 的蛋白水平,显著提高细胞活力、迁移细胞数量、侵袭细胞数量及cyclin D1、MMP2 和MMP9 蛋 白 表达量(P<0.05),见图3、表3。
高表达HOXA5 可以部分逆转miR-27a-3p mimic对HG 处理的HMECs 活力、迁移和侵袭的影响。与miR-27a-3p mimic+pcDNA-NC+HG 组比较,miR-27a-3p mimic+pcDNA-HOXA5+HG 组HMECs 中HOXA5的表达量明显增加,细胞活力、迁移细胞数量、侵袭细胞数量及cyclin D1、MMP2 和MMP9 蛋白水平显著降低(P<0.05),见图3、表4。
4 miR-27a-3p靶向HOXA5
StarBase 预 测 发 现,HOXA5-3'UTR 中 含 有 与miR-27a-3p 互补的碱基序列(图4A)。相较于miRNC 与HOXA5-WT 共 转 染,miR-27a-3p mimic 与HOXA5-WT 共转染显著降低HMECs 的双萤光素酶活 性(P<0.05),miR-NC 或miR-27a-3p mimic 与HOXA5-MUT 共转染对细胞双萤光素酶活性无明显影响(图4B)。Western blot 检测结果表明,同miRNC 相比,转染miR-27a-3p mimic 明显减少HOXA5蛋白的表达量,与anti-miR-NC 比较,转染anti-miR-27a-3p 则显著增加HOXA5 蛋白的表达量(P<0.05),见图4C。
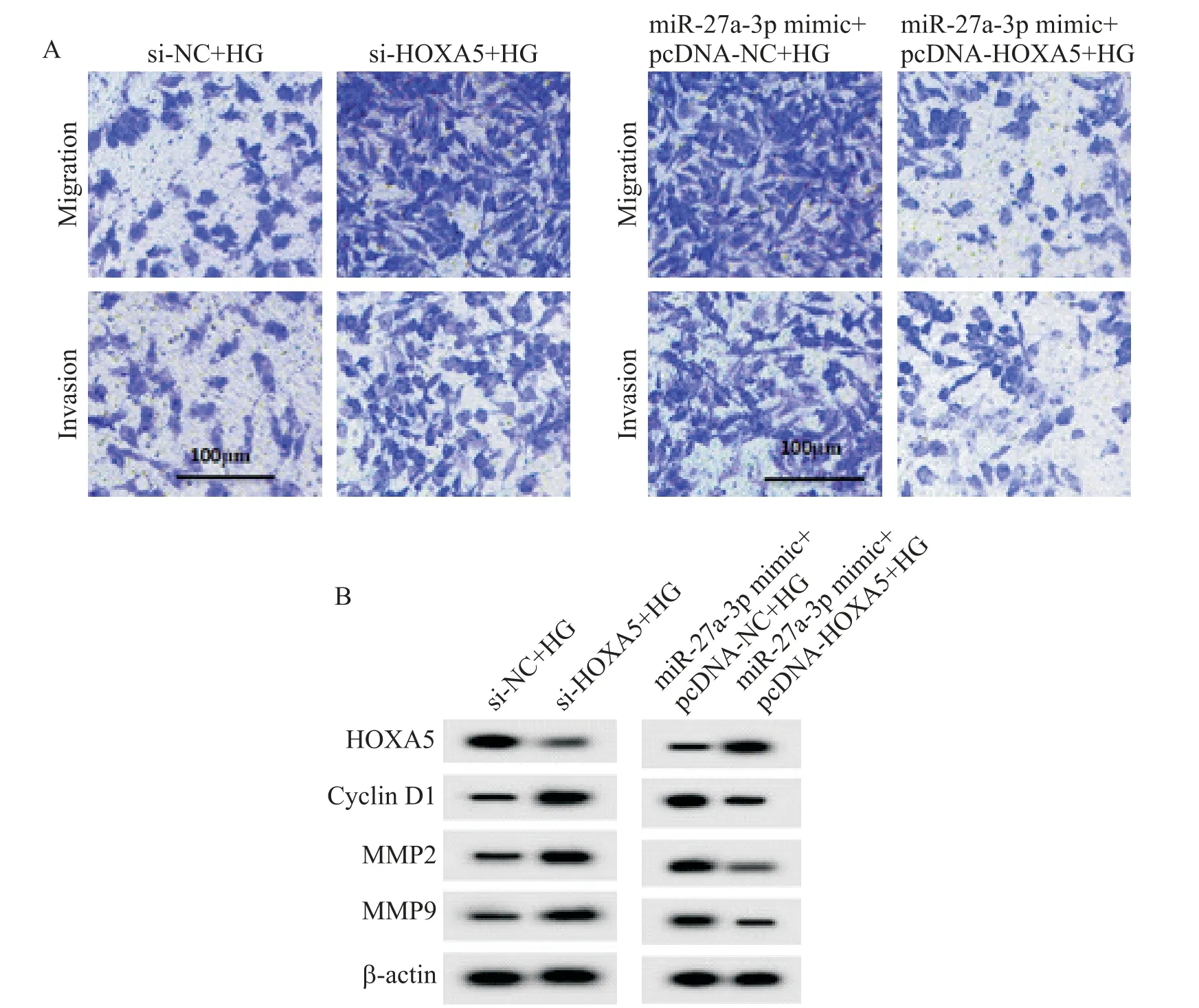
Figure 3. Effects of low expression of HOXA5 on the migration and invasion of HMECs treated with high glucose. A:Transwell assay was used to detected the migration and invasion of HMECs;B:the images of Western blot for determining the protein ex⁃pression of HOXA5,cyclin D1,MMP2 and MMP9.图3 低表达HOXA5对高糖处理的HMECs迁移和侵袭的影响

表3 低表达HOXA5对高糖处理的HMECs活力、迁移和侵袭的影响Table 3. Effects of low expression of HOXA5 on the viability,migration and invasion of HMECs treated with high glucose(Mean±SD. n=9)
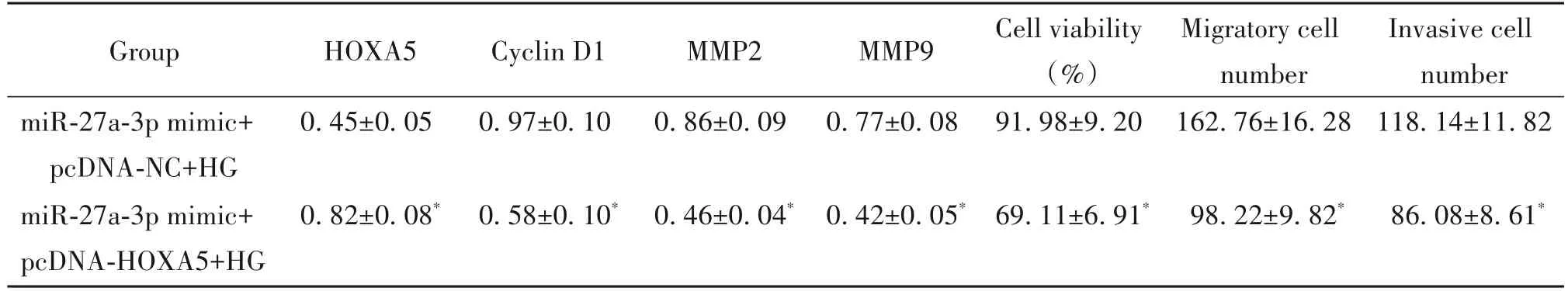
表4 高表达HOXA5可以部分逆转miR-27a-3p mimic对高糖处理的HMECs活力、迁移和侵袭能力的影响Table 4. High expression of HOXA5 partially reversed the effect of miR-27a-3p mimic on the viability,migration and invasion of HMECs treated with high glucose(Mean±SD. n=9)
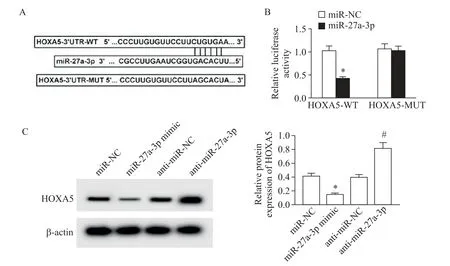
Figure 4. miR-27a-3p regulated HOXA5 expression. A:schematic diagram of StarBase predicting the binding of miR-27a-3p mimic and HOXA5;B:detection of luciferase activity;C:Western blot was used to detect HOXA5 protein expression. Meas±SD. n=3. *P<0.05 vs miR-NC group;#P<0.05 vs anti-miR-NC group.图4 miR-27a-3p靶向调控HOXA5表达
5 Wnt/β-catenin信号通路蛋白的表达
Western blot 检测结果显示,与miR-NC+HG 组比较,高表达miR-27a-3p 明显增加HG 处理的HMECs中β-catenin 蛋白的表达量(P<0.05)。与miR-27a-3p mimic+pcDNA-NC+HG组比较,miR-27a-3p mimic+pcDNA-HOXA5+HG 组HMECs 的β-catenin 蛋白水平显著降低(P<0.05),见图5。
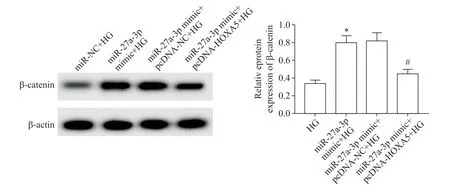
Figure 5. Western blot detection of β-catenin protein expression. Meas±SD. n=3. *P<0.05 vs HG group;#P<0.05 vs miR-27a-3p mimic+pcDNA-NC+HG group.图5 Western blot检测β-catenin蛋白的表达
讨 论
伤口愈合不良是糖尿病患者严重的并发症之一,占糖尿病患者的15%~20%[11]。目前的临床治疗包括清创、抗生素、血糖控制和活皮等效移植等,主要集中在防止创面扩大和感染。虽然这些标准的治疗方法可以达到控制症状的目的,但对于糖尿病创面的有效再生,目前仍缺乏有效的治疗方法。不幸的是,10%的糖尿病患者伤口最终会导致截肢[12]。血管生成是一个包含多个步骤的动态过程,包括基膜和细胞外基质的降解;内皮细胞的刺激、迁移、黏附和增殖;血管重塑和成熟[13],在胚胎发生、机体生长发育过程中起着至关重要的作用。此外,它在许多病理过程中是关键的,如糖尿病视网膜病变,伤口愈合和肿瘤的发生等[14-16]。由于与伤口愈合有关,越来越多的研究致力于血管内皮细胞功能涉及的因素的探讨。本研究利用高糖模拟糖尿病环境,发现高糖抑制HMECs 的细胞活力、迁移、侵袭能力及增殖相关蛋白cyclin D1、迁移侵袭相关蛋白MMP2 和MMP9 的表达,而miR-27a-3p 对高糖损伤的微血管内皮细胞的活力、迁移和侵袭能力具有明显的促进作用,为糖尿病创面愈合机制的深入研究提供了新的见解。
miRNA 在诸如糖尿病,癌症和慢性伤口等疾病中起关键作用,并且与细胞迁移、增殖、侵袭和凋亡相关[17]。资料显示,miR-27a-3p 作为新型的磷酸二酯酶3a(phosphodiesterase 3a,PDE3A)的调节因子在脑血管内皮细胞中发挥作用[18]。在胶原酶诱导的大鼠脑出血模型中,miR-27a-3p表达下调,miR-27a-3p下调可导致脑出血后脑水肿、血脑屏障破坏、神经元丢失和神经功能缺损,外源性miR-27a-3p 可能通过靶向调控脑毛细血管内皮细胞中的水通道蛋白11(aquaporin 11,AQP11)的表达来预防脑出血后并发症的发生[6]。然而少有研究报道miR-27a-3p 在糖尿病伤口愈合中的功能与机制。本研究发现,糖尿病患者创面愈合组织中miR-27a-3p 表达量明显减少。功能实验结果表明,高表达miR-27a-3p 明显增加高糖处理的HMECs 的活力、细胞迁移数量、细胞侵袭数量和cyclin D1、MMP2 和MMP9 的蛋白表达量,提示高表达miR-27a-3p 对高糖状态下的HMECs 具有保护作用,与前人报道[6]相符。
miRNA 的主要是通过与靶mRNA 结合导致其降解,进而引起翻译抑制或基因激活来调节转录后基因的表达。HOX 基因在胚胎发生过程中是必不可少的,作为HOX 基因家族一员,HOXA5 基因还调控血管形成和血管生成,HOXA5驱动内皮细胞进入静止状态,从而抑制基础血管生成[19]。本实验观察到,HOXA5 的mRNA 和蛋白表达量在糖尿病患者创面愈合组织中显著增加,低表达HOXA5 明显增加高糖处理的HMECs 活力、迁移细胞数量、侵袭细胞数量及cyclin D1、MMP2 和MMP9 蛋白表达量,与高表达miR-27a-3p 的作用一致,下调HOXA5 可以促进高糖处理的HMECs 活力、迁移能力和侵袭能力。此前,已有证据表明,HOXA5 的抑制有助于增强内皮细胞的迁移和侵袭能力[7],与本研究结果相近。另外,通过StarBase 预测和双萤光素酶报告基因检测,将HOXA5 鉴定为miR-27a-3p 的功能性靶标。高表达HOXA5 可以部分逆转miR-27a-3p mimic 对高糖处理的HMECs 活力、迁移、侵袭及cyclin D1、MMP2 和MMP9 蛋白表达的作用,表明miR-27a-3p 减轻高糖损伤HMECs 的作用可能是通过靶向调控HOXA5 的表达而实现的。
在糖尿病伤口愈合过程中,当Wnt/β-catenin 信号传导的关键组成部分Wnt 和β-catenin 增加时,表皮细胞的增殖、分化和迁移会增强,伤口愈合会加快[10]。已经发现越来越多的miRNA 可以调节Wnt/β-catenin 途径。Qiao 等[20]报道了miR-27a-3p 通过靶向SFRP1 蛋白,调节Wnt/β-catenin 信号通路,从而促进口腔鳞状细胞癌干细胞的上皮-间充质转化。为了进一步研究Wnt/β-catenin 信号是否参与miR-27a-3p调节HOXA5改善糖尿病伤口愈合的作用,本实验检测了高表达miR-27a-3p 对高糖处理后HMECs 中β-catenin 水平的影响,发现β-catenin 蛋白表达量明显升高。此外,高表达HOXA5 可以部分逆转miR-27a-3p mimic 对高糖处理后β-catenin 蛋白表达的促进作用。这些结果说明,miR-27a-3p 可能下调HOXA5 表达,增加Wnt/β-catenin 信号通路活性,从而促进高糖处理HMECs的生长、迁移和侵袭。
综上所述,miR-27a-3p 在糖尿病创面愈合组织中表达下调,高表达miR-27a-3p 直接靶向HOXA5 基因,并通过激活Wnt/β-catenin 信号通路促进高糖诱导的微血管内皮细胞生长、迁移和侵袭,从而改善糖尿病患者创面愈合。

