CD44−配体相互作用的生物力学与功能调控1)
李林达 丁奇寒†, 陈深宝†, 吕守芹†,,2) 龙 勉†, 郭兴明,3)
∗(重庆大学生物工程学院,生物流变科学与技术教育部重点实验室,重庆 400044)
†(中国科学院力学研究所生物力学与生物工程中心,中国科学院微重力重点实验室,工程化构建与力学生物学北京市重点实验室,北京 100190)
∗∗(中国科学院大学工程科学学院,北京 101408)
引言
CD44 (cluster of differentiation 44)是一种I 型跨膜糖蛋白,广泛分布在心脏、肝脏、肾脏、脾脏、肺等组织器官中,表达细胞包括内皮细胞、间充质细胞、造血干细胞,以及单核、巨噬、嗜中性粒、嗜酸性粒细胞和淋巴细胞等血细胞,同时还包括中胚层来源的细胞等[1].CD44 在多种生理和病理过程中发挥作用,如器官形成、造血、淋巴细胞活化、肿瘤转移及免疫反应[2]等,同时是淋巴癌、前列腺癌、宫颈癌、肿瘤干细胞及早期动脉粥样硬化的标志物[3].其中通过CD44−配体相互作用介导的细胞−细胞之间或细胞−基质之间的粘附及胞内信号转导通路是CD44在炎症级联反应、肿瘤转移、淋巴细胞归巢等生理、病理过程中发挥作用的重要途径.因此,考察CD44与不同配体相互作用的反应动力学及其介导的细胞粘附动力学与胞内信号通路特征是阐释其功能的基础.同时,炎症级联反应、肿瘤转移或淋巴细胞归巢等过程均发生在血流剪切的力学环境中,血流对细胞的剪切会转化为CD44−配体相互作用的外力,从而调控其分子间相互作用.此外,免疫细胞的募集、归巢或癌细胞的转移还受到基底硬度等其他力学微环境的调控.因此,进一步考察外力作用如何通过调控CD44−配体相互作用反应动力学进而调控细胞粘附动力学从而实现特定生物学功能是理解CD44 功能的另一重要内容.基于此,本文将重点介绍CD44−配体相互作用在免疫反应过程中的作用及机制研究进展.
1 CD44 概述
人源CD44 是由11 号染色体单拷贝编码的跨膜糖蛋白[4],按照转录方式不同可将CD44 前体信使RNA(messenger RNA,mRNA)的20 个外显子分为组成型和变异型拼接外显子,进而分别转录成标准型CD44(CD44s)和变异型CD44(CD44v),而CD44v 又可以通过可变区域的选择性拼接得到不同变异体亚型[4].目前发现人类至少有数十种CD44 的可变剪切体[1],其中最常见的亚型包括CD44v4-7,CD44v8-10,CD44v3-10 和CD44v1-10[5].不同亚型的CD44表达部位不同,CD44s 主要分布于间质及造血源性细胞,而CD44v 主要分布于上皮源性细胞和肿瘤细胞.另外,CD44 可进行N 糖基化、O 糖基化翻译后修饰.最常见的人源CD44s 由361 个氨基酸组成(~37.2 kD),经过糖基化修饰加工[6],蛋白质分子量可达80~100 kD[7];而变异型CD44v 分子量变化范围约为80~250 kD.采用原子力显微镜(atomic force microscopy,AFM)技术扫描CD44 蛋白的大小,结果显示CD44 高度为2.3±1.4 nm,三维尺寸约为25 nm×30 nm×2.5 nm,与免疫球蛋白大小相类似[8-9].
CD44 结构从胞外N 末端至胞内C 末端包含胞外域、跨膜域和胞内域3 部分.胞外域又可分为氨基末端和近膜域.氨基末端是含有6 个保守半胱氨酸残基的球状结构域,其中保守半胱氨酸形成的二硫键是N 末端球状结构域正确折叠及结构稳定性的基础[10].标准型CD44s 的氨基末端球状结构域与跨膜段之间是一段由46 个氨基酸形成的茎状区[11],保守性较低,可被高度糖基化并包含蛋白水解切割位点[12].而不同剪接体CD44v 的可变区可插入在N 末端球状结构域与茎状区之间[13].CD44 跨膜区和胞内区序列高度保守,其跨膜区结构支持其在细胞膜上的寡聚化(oligomerisation),并有助于其定位在富含糖脂的膜微区(glycolipid enriched membrane microdomains)[14],以及其与脂筏的作用[15].CD44 的胞内区含有与细胞骨架锚定蛋白(ankyrin)和ERM(ezrin,radixin,moesin)蛋白的结合位点.Merlin 蛋白(moesin-ezrin-radixin-like protein)也可与CD44 胞内端发生相互作用[16].对于CD44s,ERM 蛋白与细胞骨架锚定蛋白分别与其胞内段的292~300,304~318位氨基酸结合[17].由蛋白激酶C(protein kinase C,PKC)触发,CD44 胞内尾端丝氨酸(Ser)残基的有序磷酸化和/或去磷酸化,将增强ERM 蛋白与CD44 的结合[18].激活的ERM 蛋白N 末端与CD44 胞内域结合,而其C 末端与F 肌动蛋白结合,因此,ERM 蛋白是将CD44 连接至肌动蛋白细胞骨架的桥梁蛋白[19],可启动CD44 下游的胞内信号传导途径,行使特定的生物学功能.CD44 潜在的N 糖基化位点(天冬酰胺(Asn)残基)多数位于胞外域的N 末端结构域或可变区,而O 糖基化位点(丝氨酸(Ser)/苏氨酸(Thr)残基)和GAG 附着物(GAG attachments)(Ser-Gly 多肽)则主要分布在胞外的细胞膜近端区域和可变区[20-21].
2 CD44 −配体相互作用在炎症级联反应中的作用
炎症反应(inflammation)是一种由损害或损伤刺激所诱发的适应性反应(adaptive response),分为急性(acute)和慢性(chronic)炎症反应[22].多数急性炎症反应由病毒感染或者机体组织损伤引起,首先由组织中驻留的巨噬细胞和肥大细胞通过Toll样受体(toll-like receptors,TLRs)和NOD 样受体(nucleotide-binding oligomerization-domain protein-like receptors,NLRs)等启动感染识别[23],随后产生趋化因子、细胞因子、血管活性胺(vasoactive amines)等多种炎性介质,引发局部炎症,进而通过炎症级联反应募集血流中的白细胞迁移穿过毛细血管后微静脉(postcapillary venules)到达炎症部位,吞噬病原体[24].白细胞从血流向炎症部位募集主要包括被血管内皮细胞捕获,在内皮细胞表面滚动、粘附、爬行,最后跨内皮迁移等级联过程.该级联反应由系列受体−配体相互作用介导,同时受到基质硬度、血流剪切等力学微环境调控.已有研究表明,表达在白细胞上的糖蛋白PSGL-1 (P-selectin glycoprotein ligand 1)与表达在内皮细胞上的选择素(selectin)的相互作用主要介导初期的捕获与快速滚动过程,CD44 −配体相互作用则主要介导白细胞的慢速滚动,而整合素−配体相互作用则主要介导后期的稳定粘附、爬行等过程[25].下文将重点介绍CD44−配体相互作用在炎症级联反应过程中的作用.
2.1 CD44 配体——选择素
I 型跨膜蛋白选择素是CD44 介导细胞−细胞粘附的主要配体之一,包括P,E 与L 选择素3 个家族成员,其结构从胞外N 末端至胞内C 末端依次包括钙型凝集素结构域(calcium-type lectin domain,Lectin)、类上皮生长因子样结构域(epidermal growth factor-like module,EGF),起粘附补体蛋白作用的多个重复序列(consensus repeats,CR)、跨膜区域(transmembrane,TM)和胞内区(cytoplasmic,Cyto).三者之间的区别是P,E 与L 选择素分别含有9,6,2 个CR结构域,从而具有不同长度[26-27].尽管具有相似结构,但是3 种选择素具有不同生物学功能.L 选择素在造血干细胞和成熟白细胞上高表达,并且L 选择素容易水解,即使在没有化学因子的刺激下,力学因素如流体剪切即可以使得中性粒细胞(polymorphonuclear neutrophil,PMN)上L 选择素发生水解[28];P 选择素主要表达在血小板和内皮细胞,并分别储存在α 颗粒和Weibel-Palade 小体中,而促炎刺激可促使P 选择素通过细胞内储藏小体与质膜的融合,从而迅速从α颗粒转移至细胞表面;E 选择素主要表达在血管内皮细胞上,其表达水平受到炎症介质的调控.在人源血管内皮细胞中,由肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α),脂多糖(lipopolysaccharide,LPS)和白细胞介素1β(interleukin-1β,IL-1β)诱导上调表达的主要是E 选择素[29].
简言之,CD44−选择素相互作用,尤其是E 选择素,是介导炎症反应中免疫细胞募集的重要分子体系.与E 选择素与E 选择素配体-1(ESL-1)、E 选择素与PSGL-1 相互作用体系相比,三者在炎症反应中具有比较明确的功能分工.PSGL-1 主要在初期白细胞捕获过程中起作用;ESL-1 在初期捕获到稳定慢速滚动过程中起作用;而CD44 则主要介导慢速滚动[35].
2.2 CD44 配体——透明质酸
透明质酸(hyaluronic acid,HA)是脊椎动物中细胞外基质的重要组成部分.HA 是葡萄糖醛酸和N-乙酰氨基葡糖通过交替β-1,4 和β-1,3 糖苷键结合的具有重复二糖单元的线性聚合物,典型分子量约为1 MDa,长度可达微米量级,在多种病理、生理过程(如炎症反应、免疫应答、胚胎发生、肿瘤发展、骨关节炎和动脉粥样硬化)中起重要作用[37-39].目前观点认为,低分子量HAHA(LMW-HA)起到促进炎症的作用,而高分子量HAHA(LMW-HA)具有抑制炎症的作用[40].低分子量HA 与CD44 相互作用可促进细胞释放IL-10 和转化生长因子β1(transforming growth factor-β1,TGF-β1),加剧炎症反应[41].低分子量HA还可以上调CD44 表达,同时增加蛋白激酶δ(PKCδ)和蛋白激酶ε(PKCε)表达,并对软骨细胞产生损伤,增强炎症反应.而中、高分子量HA 对软骨细胞无作用,并且高分子量HA 可抑制PKCδ,PKCε,核因子κB(nuclear factor kappa-B,NF-κB)的活化和炎症反应[42].另外,HA 片段上调CD44 和TLR-4 表达,激活NF-κB易位并增加有害细胞因子TNF-α,IL-6 和IL-1β 分泌.特异性CD44 阻断抗体可降低CD44 和细胞因子表达水平[43].
CD44 可通过两种方式与HA 相互作用,一是细胞膜定位的CD44 通过特异性相互作用将可溶性HA 锚定在细胞膜上;二是免疫细胞或癌细胞表达的CD44 与其他细胞膜表达或锚定的HA 相互作用直接介导细胞粘附.细胞表面高表达的CD44 与富含HA的胞外基质相互作用是介导脑癌细胞侵袭的主要分子体系,并且癌细胞在迁移过程中呈现独特的微触角结构[44].与CD44−选择素相互作用类似,CD44-HA相互作用介导的细胞粘附同样在炎症反应中起重要作用,其中报道最多的是其介导的T 淋巴细胞归巢过程.在化学因子PMA(phorbol 12-myristate 13-acetate)诱导条件下,T 淋巴细胞上CD44 与内皮细胞上HA相互作用介导其滚动粘附[45].而且,T 细胞的活化增加其表面CD44 与内皮细胞上HA 的结合能力.在体研究表明,注射超抗原葡萄球菌肠毒素B 后,T 细胞募集到发炎腹膜部位依赖于CD44 和HA 之间的相互作用[46];TNF-α 诱导的炎症小鼠模型中Th1 和Th2 细胞在体内的滚动粘附同样依赖于CD44-HA相互作用[47].另外,CD44 也是整合素VLA-4(integrin α4β1)-VCAM-1(vascular cellular adhesion molecule 1)相互作用介导T 细胞在内皮细胞上稳定粘附的必要条件[48].此外,CD44-HA 相互作用同样可以介导中性粒细胞向炎症部位的募集[49-50].另一方面,CD44-HA 相互作用受到多种因素的调控.细胞表面HA 延伸形成的缆状结构可促进巨噬细胞在特定炎症组织的定位[51].CD44 胞外域糖基化程度以及CD44 胞质端特定丝氨酸残基磷酸化均会调控其与HA 的结合能力[52].抗原受体、细胞因子(如IL-2)、肿瘤坏死因子(TNF)以及趋化因子(包括MIP-1β(macrophage inflammatory protein 1 β),IL-8 和RANTES 等)均可激活CD44、从而进一步增强其与HA 的结合促进T 细胞粘附[53].而IL-1α,IL-1β,IL-3,粒细胞巨噬细胞集落刺激因子(GM-CSF)、干扰素γ (IFN-γ)和LPS 等均可通过TNF 诱导外周血单核细胞上CD44 与HA的结合[54-55].综上所述,CD44-HA 相互作用是介导生命体免疫反应的重要分子体系.
CD44-HA 相互作用在肝脏免疫中的作用更为凸显.HA 在肝脏中的表达相对于其他器官更高,而且主要分布在肝血窦内[56].肝血窦作为肝脏内特化的毛细血管网络,是肝脏免疫发生的主要场所.与经典炎症级联反应中白细胞的募集动力学不同,白细胞在肝脏免疫过程中的募集主要发生于肝血窦内,仅有20%~30%的白细胞在肝血窦后微静脉粘附.由于肝血窦内皮细胞上极少量表达选择素,白细胞在肝血窦内的募集不会发生滚动粘附[57].根据诱发因素不同,肝血窦内的中性粒细胞主要通过两种途径发生募集.在肝脏无菌炎性损伤中,凋亡细胞释放的DAMPs(damage associated molecular patterns)直接或间接激活中性粒细胞,并刺激内皮细胞上调表达ICAM-1(intercellular cell adhesion molecule-1),进而与中性粒细胞上的粘附分子整合素αMβ2发生相互作用,介导中性粒细胞粘附,随后中性粒细胞在肝内驻留的巨噬细胞— 枯否氏细胞(kupffer cell)等— 分泌的趋化因子梯度引导下进行定向爬行,到达特定位点进行跨膜迁移进入损伤组织.而在有菌炎症(如内毒素血症和革兰氏阴性菌败血症等)过程中,高水平LPS 的刺激促炎因子IL-10 表达上调、进而抑制αMβ2的表达,此时CD44 取代行使功能,通过与HA相互作用介导中性粒细胞募集[58].CD44 敲除可有效降低LPS 刺激条件下中性粒细胞的粘附[59].更进一步,阻断CD44-HA 相互作用有效降低了LPS 小鼠肝血窦内中性粒细胞的粘附,而对其在窦后微小静脉内的滚动粘附过程则没有影响,而且在此过程中起作用的CD44 是中性粒细胞上而不是内皮细胞上表达的CD44[56].另外,一种血清来源的HA 相关蛋白SHAP 通过与HA 共价结合形成HA/SHAP 复合物,可显著增强HA 与CD44 的相互作用[60].
简言之,CD44-HA 相互作用是介导免疫过程中白细胞募集的另一重要分子体系.但是相对于在经典炎症反应中起重要作用的选择素−PSGL-1、选择素−CD44 等分子体系而言,CD44-HA 相互作用更具有其器官特异性,尤其是在肝脏免疫中起重要作用,但是其分子机制尚不明确,其主要原因在于HA 分子量的多样性及不同组装形式.比如,不同分子量的可溶性HA 对炎症反应效果不同,而不同分子量膜定位的HA 对介导细胞粘附有什么样的差异?其不同组装形式对细胞粘附的调控?膜定位条件下CD44-HA相互作用反应动力学特性与其他细胞粘附分子配体相互作用反应动力学之间的区别等问题,目前均不明确.
3 CD44 −配体相互作用的反应动力学及力学调控
受体−配体相互作用反应动力学是调控细胞粘附动力学的基础.分子间相互作用分为三维、二维反应两种形式.三维反应是指特异性相互作用的分子双方至少有一种在溶液中处于游离态(如血液中血浆蛋白和抗体),具有空间三维运动自由度,因而易于与另一种分子发生相互作用;三维反应表征的是大量分子的统计平均性质,通常可用确定性化学反应动力学理论来描述,常用的实验测量方法包括表面等离子共振(surface plasmon resonance,SPR)等.二维反应是指特异性相互作用的分子双方分别被锚定在两个表面上,仅具有沿表面面内扩散的二维运动自由度,但缺乏沿垂直于表面法向运动的自由度(如白细胞或内皮细胞表面的选择素配体相互作用等);因为接触面受限,二维反应中参与作用的分子数目少,表征的是有限数目受体−配体间结合和解离的随机动力学行为;而且,二维反应形成的分子复合物为两个相对表面之间提供了直接的物理连接,因此其反应动力学还受到外力及其他物理因素的调控,具有力学−化学耦合特征.常用的实验测量方法包括原子力显微镜、生物膜力探针(biomembrane force probe,BFP)等典型的分子生物力学测量手段[61-62].
为进一步理解CD44 −选择素、CD44-HA 相互作用介导的细胞粘附动力学差异,以下着重介绍该分子体系的反应动力学特征及其力学调控规律.目前已报道的分子层次三维反应动力学参数汇总于表1 中.在无外力作用下,E 选择素与PSGL-1 相互作用的负反应率koff与E 选择素与CD44 相互作用基本相当,而正反应率kon略低,进而导致其解离常数KD(KD=koff/kon)略高,也就是说E 选择素与CD44相互作用结合更快.虽然不同文献报道的具体数值有差异,但是二者间的相对趋势保持不变.如果是E选择素−PSGL-1,E 选择素−CD44 两对分子体系与CD44-HA 相互作用去比较,后者的正反应率显著升高,而负反应率没有太大差异,最终导致其解离常数KD远低于E 选择素配体相互作用,表明CD44-HA相互作用的结合更快、更稳定.一个例外是当HA 分子量为6.4 kD 时,其与CD44 相互作用的负反应率koff明显高于其他分子量HA,提示特别低分子量的HA 与CD44 相互作用较弱.另外,从已有数据可以看出,当HA 分子量>100 kD 时,其与CD44 相互作用的正反应率从6.4,31 kD 时的~104M−1s−1显著升高至106~107M−1s−1,表明CD44-HA 相互作用能力与HA 的分子量密切相关.而只有HA 寡糖大于20 个残基才能有效与CD44 结合[63].
力学调控下不同分子间相互作用反应动力学参数汇总于表2 中,主要是基于AFM 技术对不同CD44亚型配体相互作用的测量.结果显示:在大致可比的加载率条件下(0.46~4.58 或0.45~5.22 nN/s),不管是单键还是多键相互作用,CD44-HA 相互作用断裂力强度约在20~50 pN,相应的零力下负反应率分别约为0.3±0.5,0.57±0.11 s−1.不管是变异体CD44v或标准型CD44s,其与HA 相互作用的负反应率显著低于其与P 选择素、纤维蛋白或纤维蛋白原的相互作用,说明CD44-HA 相互作用更稳定.对于同样表达CD44 的细胞,AFM 探针上直接包被HA 与探针上固定包被HA 的微珠的测量则表现出明显差异.前者获得的CD44-HA 相互作用的断裂力范围与底板直接包被CD44 或含CD44 的磷脂双分子层的实验体系基本可比,约为几十皮牛.而探针上固定包被有HA 的微珠时,断裂力则增加至nN 量级;这可能与细胞较软,与微珠接触面大,从而导致是多键相互作用有关.另外,比较不同分子量HA 与CD44 相互作用发现,高分子量HA 的断裂力更低[67].从表2 统计也可以看出,二维条件下获得的CD44−配体相互作用负反应率明显高于三维条件下(表1)的结果,表明二维约束及外力作用对其反应动力学的调控作用.另外,针对CD44−选择素、CD44-HA 相互作用体系而言,虽然已有研究报道了二维条件下的相互作用强度及零力下负反应率,但是负反应率随外力的变化规律则鲜有报道.需要说明的是,考虑到不同实验条件、实验手段之间的差异,导致无法对测量结果进行直接比较,所以这里没有将选择素与PSGL-1 相互作用的结果统计在内.
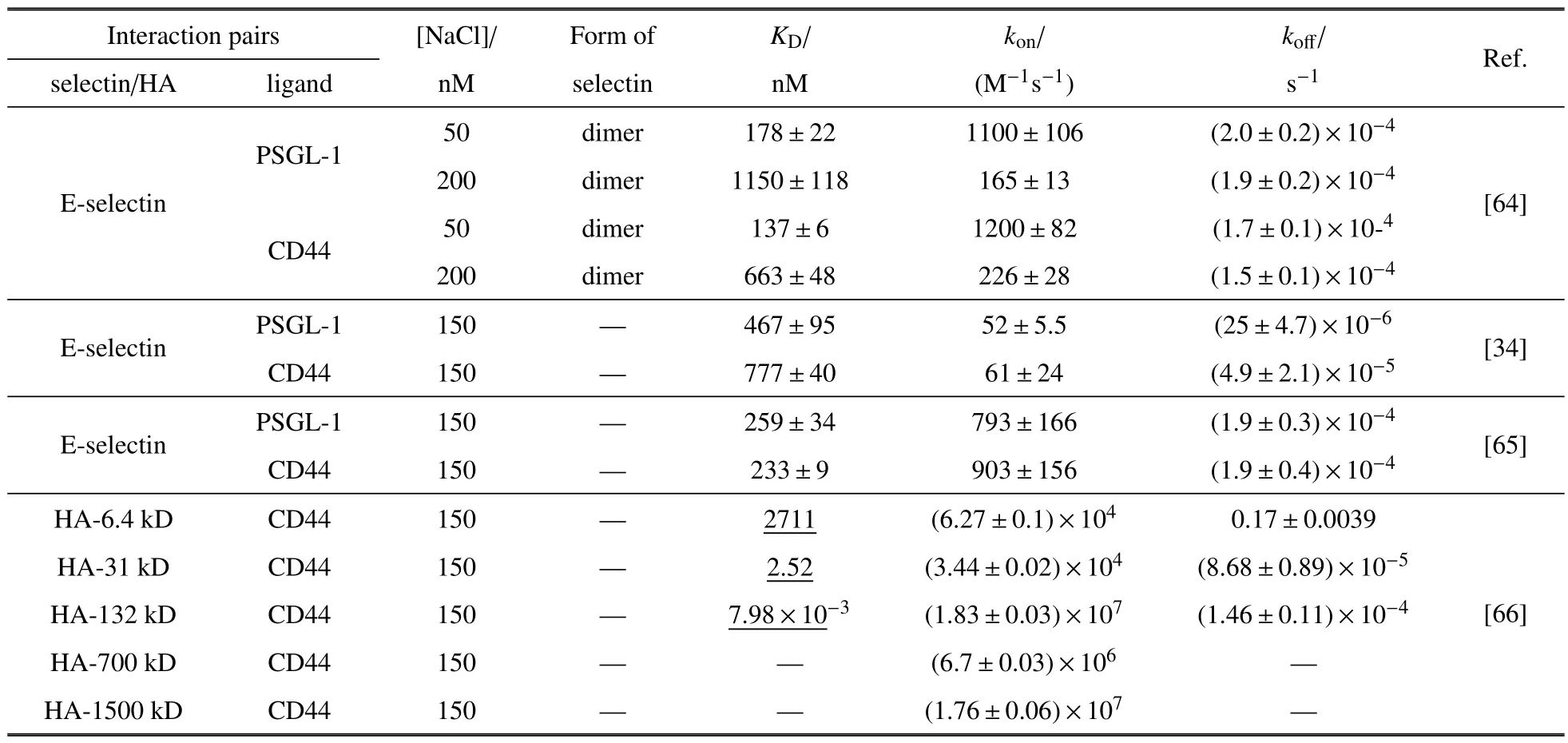
表1 基于表面等离子共振技术的不同分子体系三维反应动力学参数比较Table 1 Comparison of three-dimensional interaction kinetic parameters for different molecular systems based on SPR technology
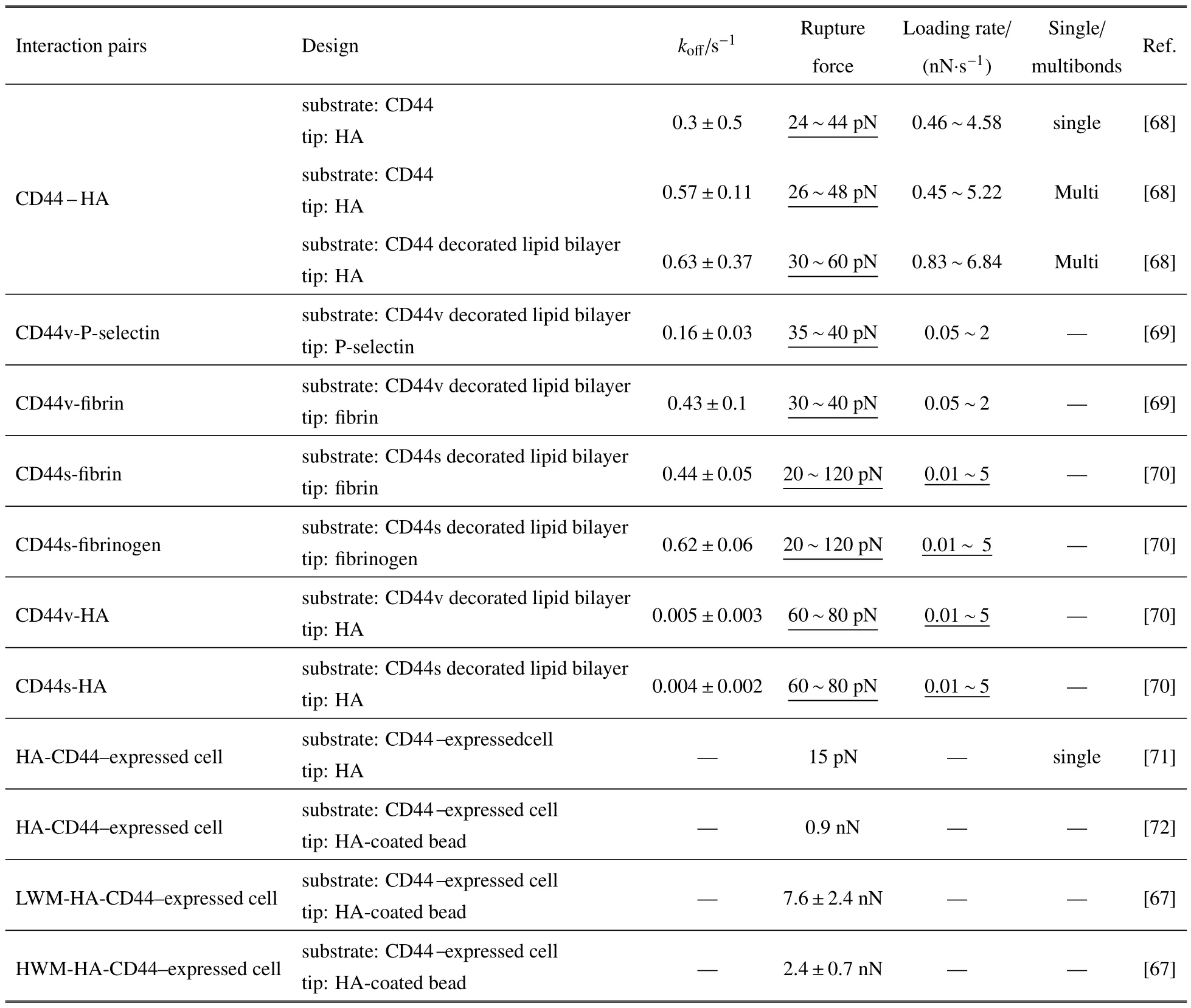
表2 基于原子力显微镜技术的不同分子体系的二维反应动力学参数比较Table 2 Comparison of two-dimensional interaction kinetic parameters for different molecular systems based on AFM technology
除了上述二维、三维条件下分子层次定量反应动力学测量,外力作用下CD44−配体相互作用介导的离体细胞层次粘附动力学也有系列报道,最典型的是模拟血流剪切的平板流动腔技术.已有研究表明,虽然生理条件下CD44 同为三种选择素的配体[73-74],但是其结合强度不尽相同.流体剪切条件下,结肠癌细胞LS17T,T84 等来源的CD44v 与选择素相互作用介导的微珠滚动速度表现为E 选择素最慢,次之是P选择素,而L 选择素最快[75-76].另一方面,流体剪切条件下,表达有CD44 的白血病细胞株KG-1a 在HA包被的底板上呈现多相粘附特征:在约0.2 dyn/cm2下发生滚动粘附,而且滚动细胞数目随着流体剪切的增加而增加,在0.7~1.0 dyn/cm2时滚动细胞数量达到最高,然后随着流体剪切的进一步增加滚动细胞数量逐渐减少,抗剪切能力甚至可达100 dyn/cm2[77].造血祖细胞在包被HA 的底板上也存在类似现象,最优剪切力在1.0 dyn/cm2左右[78].此外,CD44 介导的人源胶质母细胞瘤的粘附和迁移速度取决于HA 水凝胶的硬度[79],表明CD44-HA 相互作用除受流体剪切外,同时受到硬度等力学微环境的调控.值得注意的是,CD44-HA 相互作用介导的细胞粘附动力学随流体剪切呈现的多相特征与选择素−PSGL-1 相互作用介导的细胞粘附动力学类似,而该特征是由外力作用下选择素与PSGL-1 相互作用的逆锁键特征决定的[80].不同流体剪切条件下白细胞滚动动力学改变的研究结果表明,外力可以将HA-CD44 相互作用从低亲和力状态转变为高亲和力状态[81].而CD44−选择素相互作用介导的细胞粘附动力学具有什么样的特征?外力如何调控等问题,则鲜有报道.
2.3 高等数学的内容主要是微积分学,对学生来说,数学概念很抽象,比如数列极限的“ε-N”定义,函数极限的“ε-δ”定义等,数学定理的证明逻辑推理很严密,翻转课堂的课前学习环节如果没有教师的及时有效地引导,仅凭观看视频,不易准确把握视频中的重难点,甚至不能听懂授课内容,使学习效果不佳。
综上所述,CD44 −选择素/HA 相互作用不论是在分子层次的反应动力学还是在细胞层次的粘附动力学,以及力学调控规律的研究还不完善.而CD44不同剪接体或糖基化修饰等的多样性、HA 不同分子量大小或组装方式,以及不同实验条件、手段的差异等,导致现有数据之间难以进行直接比较,从而无法更好地阐释其生物学功能.
4 CD44−配体相互作用的微观结构基础
结构决定功能,分子微观结构特征决定了分子间相互作用反应动力学,进而决定细胞层次粘附动力学及其生物学功能.因此,明确CD44−配体相互作用的微观结构特征有利于更好阐释CD44−配体相互作用的差异以及在炎症级联反应过程中的作用.已有研究通过系列氨基酸位点突变实验表明CD44 胞外氨基末端的球状结构域(32~132 位氨基酸)是CD44 的配体—胶原蛋白,层粘连蛋白,纤连蛋白以及细胞表面受体(如E/L 选择素)—的主要结合位点[82-83],且该结构域内的二硫键对于CD44 与HA 的结合也至关重要[84].此外,CD44 的胞外区有两段高度保守的BX7B 多肽片段,其中一段为38~46 位氨基酸片段,参与其与HA 的结合(其中B 代表精氨酸Arg 或赖氨酸Lys,X7 代表任何7 个非酸性氨基酸).另一个BX7B 片段位于第一个片段“下游”约100 个氨基酸的位置,同样可以与HA 作用[85].但是其微观结构特征尚不清楚.
目前报道的原子层次精细结构主要包括CD44 N-末端的HABD(HA binding domain)结构域[86],以及HABD-HA 相互作用的复合物结构[87-88].通过比较HA 结合前后的构象变化,提出了CD44-HABD结构域存在两种不同程度的变构效应:一是HA 结合导致HABD 结构域的Link domain C-末端扩展区的有序β9-sheet 变成高度无序的loop 区,并从Link domain 脱离,而且HABD 的C-末端片段在HA 结合状态下柔性增加.根据该构象差异,将未结合状态和HA 结合状态下的HABD 构象分别称为“有序(O)”和“部分无序(PD)”构象.超过90%的HABD 被认为在HA 结合状态下采用PD 状态,也就是说PD 构象具有更高的亲和性[89].二是HA 的结合导致HABD上R45 位(人源蛋白对应于R41 位)精氨酸位点附近的loop 区发生取向变化,进而导致其与HA 结合能力的调整[88](图1(a)和图1(b)).CD44-HA 相互作用主要是静电与范德华相互作用,虽然通过结构生物学手段获得的复合物结构显示HA 与HABD 的结合仅存在一种结合模式,而后续的分子模拟则预测HA与HABD 的结合可以存在3 种不同取向,分别是晶体结合模式,平行结合模式和直立结合模式,其中晶体结合模式结合能力最强,后两个是亚稳状态[90],体现出CD44-HA 相互作用的复杂性.
HA 的结合可诱导CD44 构象改变、进而调控其结合能力的观点得到一系列研究的支持,并验证了外力调控其相互作用的重要性.在此基础上考察外力在CD44 介导的细胞(微珠)滚动中的作用,发现当HABD 通过C 末端标签连接到微珠时,滚动行为仅在高剪切应力时才稳定发生,表明高剪切应力下HABD 从O 构象转变到PD 构象,增强了其与HA 的相互作用,从而更好地抵抗流体剪切的作用.而采用O 构象或PD 构象的HABD 突变体包被的微珠则没有上述随流体剪切增高而粘附增强的现象.分子动力学模拟表明,作用于C 末端的外力可破坏C 末端区域和该结构域主体结构之间的相互作用,从而实现了从HABD 结构域从O 构象态到PD 构象态的变构;同时在C 末端施加的外力可更快地诱导高亲和力PD 的构象、增强HABD-HA 相互作用,从而更有效介导白细胞的炎症反应和造血祖细胞归巢[81].此外,CD44-HA 相互作用介导的细胞粘附和迁移速度取决于HA 水凝胶的硬度,提示基于CD44 的信号传导具有机械敏感性[79],进一步支持了力学因素调控CD44 不同亲和态构象进而调控其与HA 的结合能力的观点.
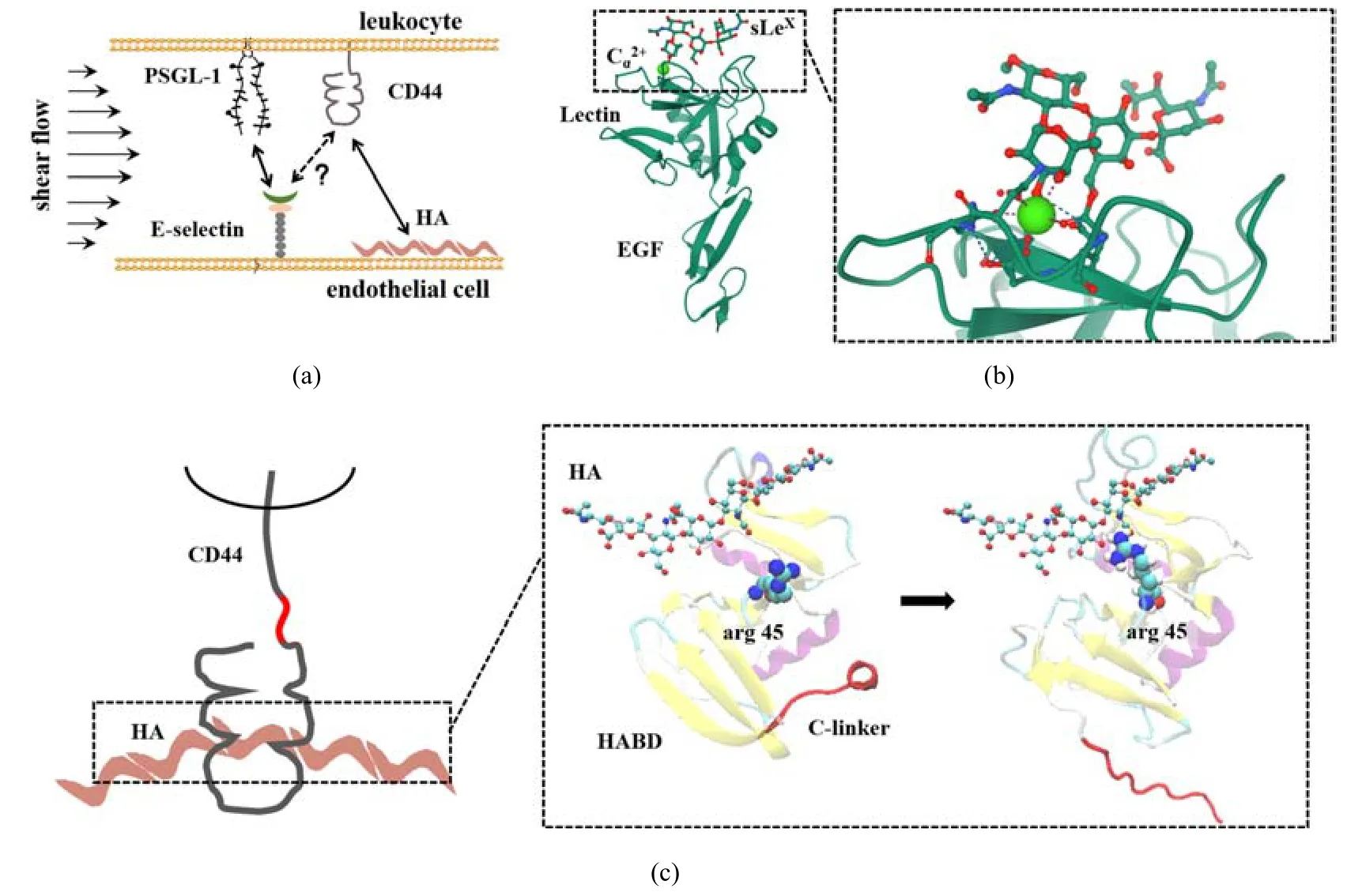
图1 CD44−配体相互作用的微观结构特征:(a)细胞粘附分子PSGL-1、CD44、E 选择素与HA 的分布及相互作用网络;(b)PSGL-1 的N 末端糖基sLeX 作用在E 选择素Lectin 结构域的钙离子附近;(c)HA 作用导致CD44 HABD 结构域发生构象改变Fig.1 Microstructural features of CD44−ligands interactions:(a)Schematic interaction network among PSGL-1,CD44,E-selectin and HA;(b)conformational allostery of CD44 HABD domain induced by HA binding;(c)crystalized E-selectin-sLeX interaction complex
虽然关于CD44 HABD 结构域及HABD-HA 相互作用的微观结构特征有系列报道,但是CD44 其他结构域或不同糖基化的微观结构特征及其对HA 结合的贡献还不清楚.另外,尽管选择素的微观结构研究相对完善,包括构象动力学及其与配体PSGL-1 相互作用的特征[91-94](图1(a)和图1(b)),但是CD44 −选择素相互作用的微观结构特征还尚无报道.因此,进一步从微观结构层次考察CD44−选择素相互作用特征及其力学调控规律,是深入理解其结构功能−关系的基础.
5 CD44−配体相互作用介导的胞内信号通路
HA 是与CD44 结合进而通过胞内信号通路调控细胞迁移、生长与增殖等功能的主要配体之一.在调控细胞迁移方面:CD44 通过其胞内结构域与细胞骨架相关蛋白相互作用进而调控细胞迁移[95-96].ERM 是桥接CD44 与胞质肌动蛋白的主要蛋白之一[5],其结合位点位于CD44 胞质段的碱性氨基酸序列[97].HA 结合CD44 导致蛋白激酶C(PKC)激活,使得CD44 胞内端磷酸化,增强其与ERM 蛋白的结合,进而加强CD44 与细胞骨架的相互作用,促进细胞迁移[18,98-99].另外,HA 与CD44 的结合可以促进c-Src激酶募集至CD44 部位并激活c-Src,继而增加细胞骨架蛋白cortactin 的酪氨酸磷酸化.Cortactin 的酪氨酸磷酸化减弱了其交联丝状肌动蛋白的能力,从而调节细胞的迁移能力,促进细胞的募集[100].HA 与CD44相互作用还可以激活Rho GTPase(如Cdc42,Rac1 等)信号,该信号通过不同的效应分子来调控细胞骨架的重组,进而调控细胞迁移.HA-CD44 相互作用可以通过Cdc42 调节F 肌动蛋白进而调节细胞骨架,促进细胞的募集[101];HA 与某些表达CD44 的细胞结合也可激活Rac1 信号传导,进而调控细胞膜皱褶结构或细胞运动.CD44v3 与Tiam1 之间的相互作用促进了Rac1 信号转导和细胞骨架介导的乳腺肿瘤迁移[102].HA 的结合促进CD44 与癌蛋白Vav 家族成员Vav2 蛋白的相互作用,维持Rac1 和Ras 活化,促进卵巢肿瘤细胞生长和迁移增加[103](图2(a)).另外,HA与CD44 相互作用还可通过不同信号通路调控细胞的生长、增殖、存活等.CD44-HA 相互作用可通过Rho 激活诱导PI3K,再由PI3K 激活丝氨酸/苏氨酸激酶(Akt),进而促进细胞增殖和存活[104].同时,CD44还通过HA 合成酶HAS2,HA 及Akt 信号通路之间的正反馈回路诱导乳腺癌细胞中Akt 信号的持续激活,最终克服凋亡并维持细胞存活[105].外源性HA 通过骨髓巨噬细胞样细胞上两种不同的HA 受体增强造血功能.其中一种是HA−CD44 与激活p38 丝裂原活化蛋白(MAP)激酶的途径相关,CD44-HA 增强了细胞的增殖[106].HA−CD44 相互作用还可通过细胞外信号相关激酶1 和2(ERK1/2)介导内皮细胞的活化和增殖[107];或通过激活ERK2,进一步磷酸化Elk-1,促进细胞迁移以及增殖[101].CD44 也可以作为共同受体而行使生物学功能,通过与肝细胞生长因子HGF 结合,CD44v6 与Met 以及HGF 形成三体复合物并促进Met 激活,去除CD44 胞质尾部依旧可以激活Met,但需有CD44 胞质尾部与ERM 蛋白相互作用、才能激活Ras-MAPK 途径[108].CD44v6-ECM 结合还促进PI3K/Akt 途径激活和Met 转录[109-110].
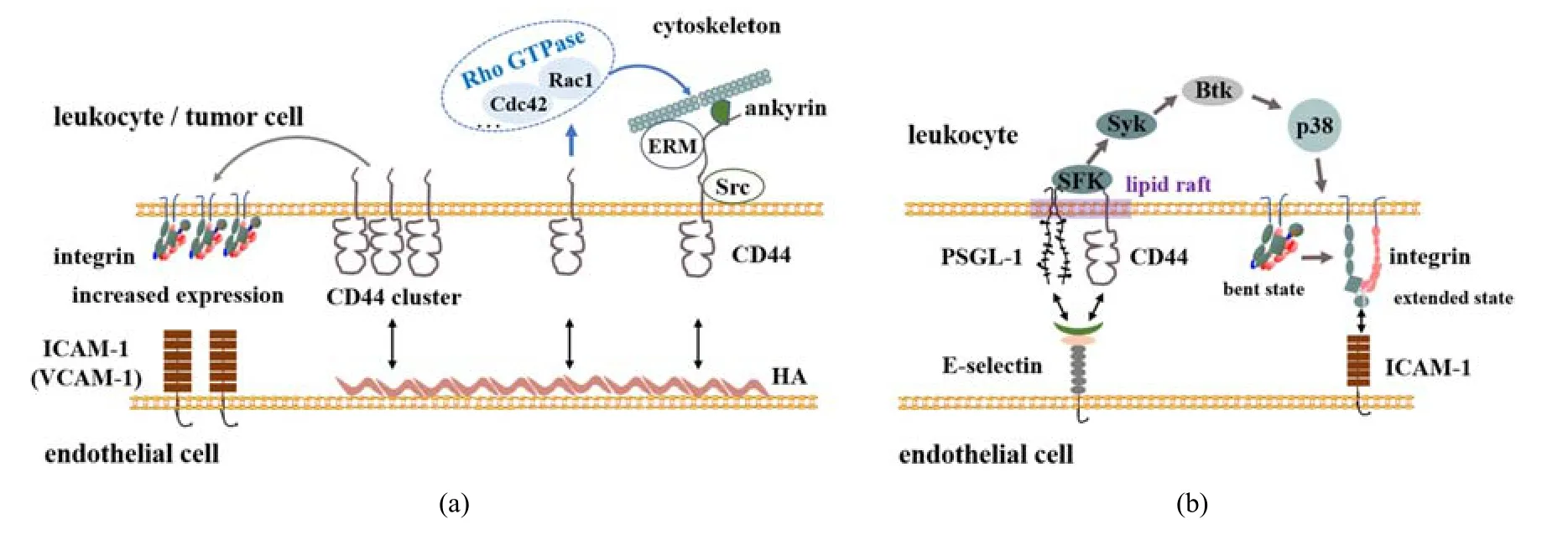
图2 介导细胞粘附与迁移的CD44 胞内信号通路:(a)HA 与CD44 相互作用启动的CD44 胞内信号通路;(b)E 选择素与CD44 相互作用启动的CD44 胞内信号通路Fig.2 CD44−mediated intracellular signaling pathways for cell adhesion and migration:(a)CD44-HA interaction mediated intracellular signaling pathways;(b)CD44−E-selectin interaction mediated intracellular signaling pathways
另一蛋白Merlin 在CD44 胞内端的结合位点与ERM 存在竞争性作用,Merlin 的激活发生在ERM 蛋白失活之后.Merlin 的激活引起皮质肌动蛋白细胞骨架的重组,同时阻止Ras 激活以及Ras 依赖性信号转导,并抑制了多种受体酪氨酸激酶的信号传递[5].丝氨酸/苏氨酸蛋白激酶PAK2 可使Merlin 磷酸化[111],但同时导致Merlin 失活并抑制其与CD44 的结合[99].高细胞密度或高分子量HA 的加入会触发Merlin 的去磷酸化,从而导致生长抑制复合物的形成,使得细胞增殖受限[5].因此,ERM 蛋白和Merlin 蛋白具有控制细胞增殖的“开关”作用.
除上述HA 结合启动CD44 胞内信号通路在细胞生长、增殖、细胞骨架重组等过程中的作用外,CD44 作为细胞粘附分子则呈现出不同的信号通路.从现象上来讲,CD44-HA 相互作用介导的T 细胞外渗同时依赖于整合素VLA-4 与配体VACM-1 相互作用[112],而CD44 胞内端缺失则破坏了VLA-4 整合素介导的T 细胞稳定粘附和外渗[113],提示CD44 可能通过胞内某种信号通路与VLA-4 整合素协同作用.CD44-HA 相互作用也可增加整合素信号传导,从而导致细胞铺展[114].高表达CD44 的结肠癌细胞通过CD44 交联或低分子量HA 刺激可诱导β2整合素αLβ2的表达,并进一步通过αLβ2-ICAM-1 相互作用促进癌细胞在内皮细胞上的粘附和跨内皮迁移,通过加入PKC 酶抑制剂,可阻断该过程的发生[115].类似地,CD44 交联导致MDA-MB-435S 或Hs578T 乳腺癌细胞系上整合素αLβ2与VLA-4 表达上调,并进一步通过整合素−配体相互作用促进乳腺癌细胞跨内皮迁移[116](图2(a)).E 选择素结合也可触发CD44 胞内信号、从而激活整合素.E 选择素与CD44 相互作用可以介导中性粒细胞的慢速滚动过程,其原因在于E 选择素的结合可通过脂筏上CD44 胞内端SFK →Syk →Btk →p38 的信号通路激活整合素αLβ2,进而通过αLβ2-ICAM-1 相互作用促进细胞的慢速滚动[31](图2(b)).
正常生理条件下CD44 成簇定位于细胞膜脂筏上,因此脂筏的破坏与否对其与配体相互作用的能力、胞内信号的传递及相应生物学功能有明显调控作用.通过甲基-β-环糊精(MβCD)消耗膜胆固醇、降低CD44 在脂筏中的聚集,可增强T 细胞上CD44与HA 的结合,进而增加了生理流动条件下T 细胞发生滚动粘附的细胞数量[117].而高水平的胆固醇促进CD44 进入脂筏,CD44-Ezrin 结合力减弱,抑制肿瘤细胞的迁移和侵袭[118].另外,多数Src 家族激酶可被特定的脂质修饰,而这些脂质可以将Src 激酶引导至具有高胆固醇和糖磷脂含量的脂筏区域.因此,CD44与脂筏中的c-Src 激酶直接结合可促进HA 介导的c-Src 激酶活性并介导细胞骨架调节的细胞迁移[119].高分子量HA 可以加强CD44 成簇,而HA 片段似乎没有作用[120-121].有趣的是,寡糖HA 孵育细胞后,能够减少先前由高分子量HA 诱导形成的CD44 簇[122].
简言之,CD44 通过复杂的胞内信号网络介导细胞的生长、增殖、迁移等多种生物学过程,而且受到力学、CD44 糖修饰、CD44 簇集及不同配体作用等多种因素调控.作为细胞粘附分子,HA 或E 选择素的结合均可通过CD44 胞内信号通路激活整合素,进而通过整合素−配体相互作用实现免疫细胞募集、癌细胞迁移等过程的级联反应.需要说明的是,就目前的报道可以发现,HA 与CD44 相互作用主要是激活T 淋巴细胞或癌细胞上整合素的表达上调,进而通过增强整合素−配体相互作用的亲和力(avidity),促进细胞间粘附或跨膜迁移;而E 选择素与CD44 相互作用则主要是激活中性粒细胞上整合素构象的改变,进而通过增强整合素配体相互作用的亲和性(affinity),促进细胞间的粘附或跨膜迁移,从而表明不同配体与CD44 相互作用介导不同的生物学功能.作为在肝脏免疫中起重要作用的分子体系,HA 与CD44 相互作用如何调控中性粒细胞在肝血窦内的募集,其与整合素之间存在怎样的协同作用等问题尚不清楚.
6 结论与展望
作为干细胞鉴定或疾病检测、病程发生发展的标志物,胞内多种复杂信号网络的触发分子,以及介导细胞粘附的重要受体,CD44 分子的生物学重要性毋庸置疑,其相应内在机制的研究也日趋深入.随着人们对生命活动规律及内在机制认知的加深,研究者们逐渐认识到力学、物理因素对生命活动的不可或缺性,重要研究进展包括力学因素对发育[123-127]、遗传[128]、免疫[129]等重要生命活动的调控,并催生了力学医学、力学免疫学、力学组学新概念,发展了生物力学与力学生物学等交叉研究领域,但是其内在机制还远不清楚.如上所述,CD44 作为细胞膜表达分子,其与配体HA 或选择素相互作用介导的细胞粘附受到生理力学、物理微环境的调控,包括流体剪切、基质硬度等.
虽然目前关于CD44 与配体相互作用微观结构特征、分子反应动力学、细胞粘附动力学及胞内信号通路均有报道,但是力学因素调控CD44 与配体相互作用的规律及内在机制还远不清楚,均需深入研究.在不同力学因素对细胞粘附动力学的调控规律及内在机制方面:主要包括外力作用下CD44 与选择素相互作用介导的细胞粘附动力学具有什么样的特征;外力作用下不同分子量膜定位的HA 与CD44相互作用介导的细胞粘附动力学差异;其不同组装形式对细胞粘附的调控等.在分子相互作用反应动力学的调控规律及结构基础方面:主要包括分子层次CD44 与选择素/HA 相互作用的力学调控规律,及相互间的差异;不同分子量HA-CD44 相互作用的力学调控规律,及其组装方式的影响;原子层次CD44与选择素相互作用特征及其力学调控特征等.特别地,作为肝脏免疫过程中起重要作用的分子体系,尚待考察的问题包括其独特力学、物理微环境如何调控CD44 与HA 相互作用介导的细胞粘附动力学?其生物学功能如何体现其组织特异性等.

