单纯乳头状甲状腺癌与合并桥本甲状腺炎的乳头状甲状腺癌的临床特点及分析△
祖瓦丽亚古丽·艾合买提,张洁
新疆维吾尔自治区人民医院内分泌科,乌鲁 木齐 830001
甲状腺癌是内分泌系统中最常见的恶性肿瘤之一,占全身恶性肿瘤的1%。甲状腺癌的主要组织学类型有分化型甲状腺癌、未分化型甲状腺癌及髓样癌。分化型甲状腺癌包括乳头状甲状腺癌(papillary thyroid carcinoma,PTC)、滤泡状甲状腺癌。分化型甲状腺癌的初始治疗通常是手术(即甲状腺侧叶切除术或甲状腺全切除术)、放射碘治疗,以及终生促甲状腺激素(thyroid-stimulating hormone,TSH)抑制治疗。研究显示,PTC患者中常常可以发现慢性淋巴细胞浸润,这提示自身免疫因素可能参与肿瘤的发展过程。桥本甲状腺炎(Hashimoto thyroiditis,HT)是最常见的自身免疫性甲状腺疾病,也是最常见的引起甲状腺功能减退的原因,好发于青年女性,甲状腺功能多处于正常状态,少数情况下可发生功能异常,其中以甲状腺功能减退最常见。临床上HT患者甲状腺功能正常时通常没有任何症状,体征主要是甲状腺肿大,超声显示腺体实质回声减低,不均匀呈网格样改变,实验室检查表现为甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)和甲状腺球蛋白抗体(thyroglobulin antibody,TGAb)均为阳性且水平显著升高。HT的病理特点是弥漫性淋巴细胞浸润、纤维化以及甲状腺实质萎缩。目前HT与PTC两者间是否存在联系,受到众多研究者的关注。研究发现,PTC与HT间存在一些共同的分子通路改变,如磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)、CD98、p63等,因此有研究者认为PTC与HT存在联系。本研究通过比较PTC合并HT与未合并HT患者临床特征的差异,分析HT合并PTC的临床特点,现报道如下。
1 资料与方法
1.1 一般资料
收集2018年1月至2019年7月于新疆维吾尔自治区人民医院进行手术后病理明确诊断为PTC的鼠类肉瘤病毒癌基因同源物B1(v-raf murine sarcoma viral oncogene homolog,BRAF)基因阳性患者的病历资料。纳入标准:①年龄≥18岁,初次行甲状腺切除术;②进行全甲状腺切除或单侧切除;③术后均给予左甲状腺素钠片口服;④术后病理证实为PTC;⑤临床资料完整。排除标准:①病理结果证实为除PTC之外的甲状腺恶性肿瘤以及合并其他颈部恶性肿瘤;②术前使用影响甲状腺功能检测及甲状腺功能的药物(胺碘酮、雌激素、糖皮质激素、非甾体抗炎药、呋塞米、抗肿瘤药物等);③合并术后并发症如感染、乳糜等;④既往合并甲状腺功能亢进;⑤随访失访。根据纳入、排除标准,共纳入149例PTC患者,按是否合并HT分为PTC组(n=120)与HT-PTC组(n=29)。HT诊断标准:高水平 TPOAb(>35 U/ml)或 TgAb(>116 U/ml);伴或不伴甲状腺弥漫性肿大;伴或不伴临床和生化甲状腺功能减退;TSH抑制治疗达标(根据2015年美国甲状腺协会成人甲状腺结节与分化型甲状腺癌诊治指南,复发危险分层为高风险患者,指南建议TSH抑制水平<0.1 mU/L;中风险患者,建议TSH控制在0.1~0.5 mU/L;低风险患者,建议TSH控制在0.6~2.0 mU/L)。本研究经医院伦理委员会批准,所有患者均知情同意并签署知情同意书。
1.2 观察指标
①收集患者术前年龄、性别。②术前TSH水平、甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)发生率、术后左旋甲状腺激素剂量、术后TSH抑制治疗达标情况。③术后组织病理报告,整理数据并进行数据分析。
1.3 统计学方法

2 结果
两组患者年龄、PTMC发生率、术前TSH水平、左旋甲状腺激素剂量比较,差异均无统计学意义(P>0.05);HT-PTC组女性患者比例高于PTC组,TSH抑制治疗达标率高于PTC组,差异均有统计学意义(P<0.05)。(表1)
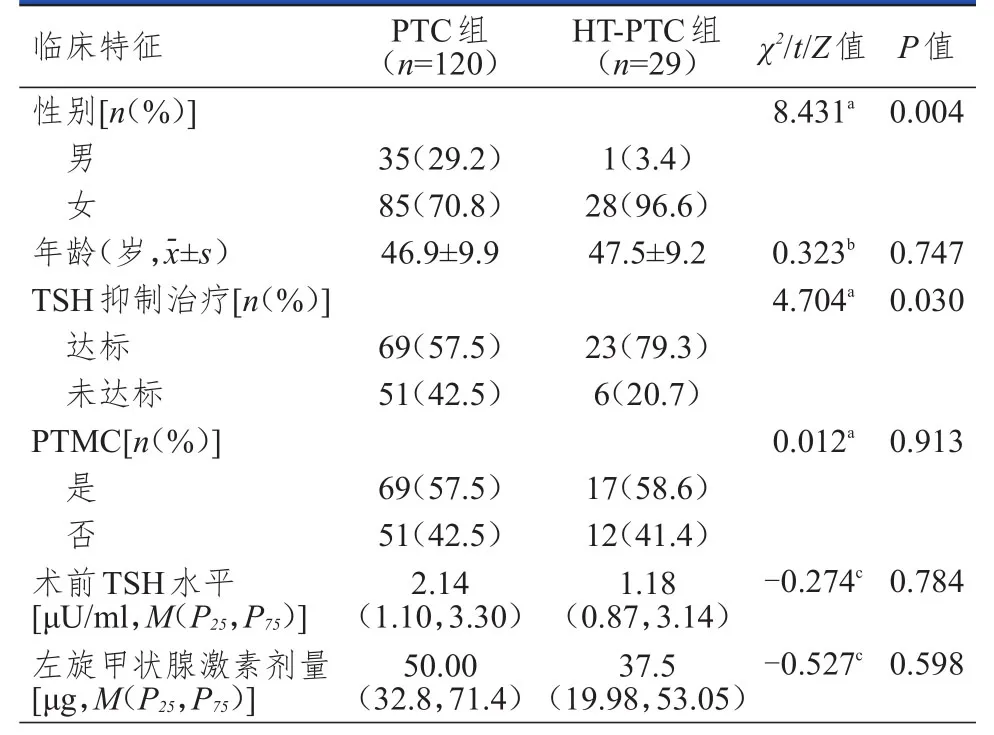
表1 两组患者临床特征的比较
3 讨论
目前临床上对于HT合并PTC的发病机制还没有明确的说明,有文献指出与PTC合并其他甲状腺良性肿瘤的共检率相比,PTC合并HT的共检率更高(10%~58%)。有学者认为,HT淋巴细胞浸润常与PTC相关,并可能是发展这种类型肿瘤的危险因素。但Zeng等研究发现HT与BRAF(V600E)突变、甲状腺外侵犯和淋巴结转移呈负相关,认为HT是PTC的潜在保护因素。故目前尚无统一说法。
邢宝迪等、Lee等研究发现HT合并PTC这一疾病类型更多见于女性患者,本研究中PTC合并HT患者中女性比PTC组更多见,与上述文献报道基本一致,因此,对于青中年女性患者,若发生HT,在临床上应该引起重视,进行密切随访,如果期间出现可疑结节,应该尽早明确结节性质,必要时行甲状腺穿刺活检术协助诊断,争取早期发现并及时给予合理的治疗。
于璐等指出PTC组较PTC合并HT组患者年龄小,而本研究中PTC组与HT-PTC组患者高发年龄类似,差异无统计学意义,这一结果与王尔黎研究成果相同。
TSH是一种由腺垂体分泌的促甲状腺生长因子,具有促进甲状腺滤泡上皮细胞增生、甲状腺激素合成及释放的作用。资料显示,长期TSH分泌增多,刺激甲状腺细胞生长,使肿瘤发生的危险性增加。TSH抑制疗法是PTC患者术后内分泌治疗方法,应用外源性甲状腺激素将TSH抑制在正常低限或低限以下,不但可以补充PTC患者所缺乏的甲状腺激素,还能抑制甲状腺癌细胞生长。国外Diessl等研究后表示晚期分化型甲状腺癌患者未抑制的TSH水平,即>0.1 mU/L,与预后差相关。患者术后如果不抑制其TSH水平,容易导致分化型甲状腺癌复发。同样杨林和赵建国研究发现分化型甲状腺癌患者术后TSH抑制治疗可提升患者的生活质量。本研究中PTC组患者TSH抑制治疗达标率低于HT-PTC组,差异有统计学意义,可以认为HT合并PTC患者术后TSH抑制治疗达标率较单纯PTC患者高。
PTMC是PTC的特殊亚型,世界卫生组织(WHO)中PTMC的定义是肿瘤直径小于1 cm的PTC。作为PTC的特殊亚型,PTMC的总体预后良好,但仍有部分患者显示出侵袭性的临床特点,如有淋巴结转移、术后复发等。本研究中比较两组患者PTMC的发生率,两组间无差异,与陈诚等研究结果相同。
一项研究显示,在结节性甲状腺疾病患者中,血清TSH浓度与肿瘤发生风险呈正比,血清TSH大于1.64 mU/L的患者肿瘤发生风险明显增加。也有学者认为,PTC与HT共同发生也可能与TSH升高对甲状腺的慢性刺激有关,这可能会促进甲状腺肿瘤的生长。本研究中两组之间术前TSH水平差异无统计学意义。
PTC患者术后口服规定剂量的甲状腺激素,将TSH水平降至较低的水平,降低TSH对肿瘤细胞的刺激,可达到降低肿瘤复发率与病死率的目的。本研究比较两组患者术后左旋甲状腺激素剂量,结果提示两组无差异,故不能认为PTC合并HT组需要的甲状腺激素剂量比单纯PTC需要的甲状腺激素剂量多。
综上所述,PTC无论有无合并HT常见于中年,而PTC合并HT这一疾病类型更多见于女性患者,故临床上中年女性发生HT时警惕PTC的发生。鉴于本研究病例数量有限,且观察时间较短,后期仍需大样本、长期的随访观察,以更好地为PTC合并HT患者的个体化治疗提供依据。

