苦豆子SaLDC 密码子偏好性分析、优化及原核表达
洪园淑 周玉梅 李文娟刘 萍∗
(1.宁夏优势特色作物现代分子育种重点实验室,宁夏银川 750021;2.宁夏大学农学院,宁夏银川 750021)
密码子使用偏好性,即编码同种氨基酸的密码子在不同物种中使用频率不完全相同的现象[1]。有研究表明高表达基因倾向于使用最优密码子,密码子使用偏好性与基因表达水平之间的关系已在拟南芥、豌豆和云杉等植物中报道[2-4];对于拟南芥和水稻的密码子使用模式也已得到广泛研究,虽然这2 种植物的密码子使用模式不同,但研究发现其使用偏好性均与基因碱基组成、表达水平和CDS长度等有关[5]。密码子使用偏好性直接影响蛋白的表达,充分利用密码子的使用偏好性策略可提高异源蛋白表达水平[6]。密码子优化技术对一些重要功能蛋白质和关键酶的生物学结构和功能研究有重要作用,可有效提高丙酮酸脱羧酶[7]、脂肪酶[8]、T4 溶菌酶[9]等多种异源蛋白质的表达,也为利用大肠杆菌等模式菌株工业化高效生产异源蛋白质提供了很好的发展前景。
苦豆子Sophora alopecuroides L.中苦参碱和氧化苦参碱具有抗炎、抗肿瘤、调节免疫功能等多种作用[10],赖氨酸脱羧酶基因是合成苦参碱和氧化苦参碱的关键酶基因,有学者对东北石松、蛇足石杉、狭叶羽扇豆、桑树、苦参、野决明等植物的赖氨酸脱羧酶基因开展研究,发现其通过催化赖氨酸脱羧生成尸胺,最终转化为苦参碱和氧化苦参碱[11-15]。目前关于赖氨酸脱羧酶基因的研究大多是探讨基因表达与代谢产物尸胺之间的关系,鲜有从密码子角度研究其在翻译进程中的调控机制和调节自身表达水平。杨毅等[16]克隆获得了苦豆子的赖氨酸脱羧酶基因(SaLDC),发现SaLDC 的表达和氧化苦参碱的积累均受干旱胁迫影响,且该基因的表达量与氧化苦参碱积累呈正相关关系。本研究在已有苦豆子SaLDC 编码区的基础上,从分析SaLDC 和宿主大肠杆菌细胞对密码子的使用偏好性和适应性入手,对SaLDC 进行OptimumGeneTM密码子优化,并将优化后获得的optSaLDC 在大肠杆菌细胞中表达,获得纯化蛋白,为后续深入研究SaLDC 功能奠定基础。
1 材料与方法
1.1 材料 原核表达载体pET-28a(+)由宁夏优势特色作物现代分子育种重点实验室保存;苦豆子SaLDC 完整CDS(Coding DNA sequence,CDS)序列(GenBank 登录号KM249871)由本实验室克隆得到,该CDS 序列位于其mRNA 的44~1 381 bp之间,全长1 368 bp。
1.2 方法
1.2.1 密码子偏好性分析 运用EMBOSS 在线程序(http:/ /vmbioinfo.toulouse.inra.fr/emboss)中的CHIPS、CUSP 及CodonW 软件分析SaLDC 密码子偏好性相关指标,包括有效密码子数(Effective number of codon,ENC)、CDS 序列的GC含量、第3 位碱基的GC 含量(GC3s)、同义密码子相对使用度(Relative synonymous codon usage,RSCU)和密码子使用频率。大肠杆菌(Escherichia coli T.)、酵母(Saccharomyces cerevisiae H.)、烟草(Nicotiana tabacum L.)、水稻(Oryza sativa L.)和拟南芥基因组的密码子偏好性数据来源于密码子使用数据库Codon Usage Database(http:/ /www.kazusa.or.jp/codon/)。
1.2.2 optSaLDC 序列合成及原核表达载体构建参照大肠杆菌密码子使用模式,在不改变基因编码氨基酸序列前提下,综合考虑密码子使用频率、GC 含量、限制性内切酶位点等因素,通过在线软件(http:/ /61.191.165.20:96/CommonTools/Optimization.aspx)对SaLDC 使用频率低的密码子进行同义突变,提高密码子使用指数,改变其mRNA的空间结构并调节与大肠杆菌tRNA 水平的匹配度。优化后的序列命名为optSaLDC,由生工生物工程(上海)股份有限公司合成。原核表达载体pET-28a(+)经NdeI / XhoI 双酶切,回收载体大片段并与optSaLDC(1 377 bp)序列重组连接,构建pET-28a(+)-optSaLDC 重组质粒(6 668 bp),扩繁后用XhoI /ApaI 双酶切,对目的片段测序验证。
1.2.3 重组optSaLDC 蛋白的诱导表达及优化 测序无误的pET-28a(+)-optSaLDC 重组质粒转化E.coli BL21(DE3)感受态细胞,根据预实验设置IPTG 为0、0.2、1.0 mmol/L 3 个终浓度,分别于37 ℃诱导4 h、15 ℃诱导16 h 后收集菌液,SDS-PAGE 电泳分析蛋白上清和沉淀。对表达最优的克隆菌株扩大培养,诱导后离心收集菌体,超声破碎并对上清进行Ni 柱亲和层析纯化。
1.2.4 重组optSaLDC 蛋白的Western blot 检测和LC-MS/MS 鉴定
1.2.4.1 Western blot 检测 诱导获得的蛋白经SDS-PAGE 电泳后转印至聚偏二氟乙烯膜(polyvinylidine difluoride,PVDF ),抗体孵育后用BeyoECL Plus 试剂覆盖PVDF 膜,静置、拍照观察。
1.2.4.2 LC-MS/MS 鉴定 纯化后的重组蛋白用SDS-PAGE 分离,考马斯亮蓝染色,目的条带送上海中科新生命生物科技有限公司做LC-MS/MS鉴定。
2 结果与分析
2.1 密码子偏好性分析
2.1.1 有效密码子数及GC 含量分析 有效密码子数(ENC)反映密码子家族中同义密码子非均衡使用的偏离程度,其范围一般为20~61,越接近20,表明密码子偏好性越强[17];GC3s 表示密码子第3 位碱基中GC 含量与第3 位碱基总量的比值。本研究用CodonW 软件计算获得SaLDC 的ENC 值、GC 含量和GC3s 值分别是55.890、0.489、0.465。ENC 值偏大接近于61,远离20,表明该基因密码子偏好性较弱;GC 和GC3s 含量均小于0.500,表明在整个编码区序列中AT 含量大于GC 含量,且SaLDC 稍微偏好使用以A/T 结尾的密码子。
2.1.2 相对同义密码子使用度(RSCU)分析RSCU 是指一个氨基酸所对应的密码子与该氨基酸所有同义密码子个数的比值,如果RSCU 值接近1,表明该密码子没有偏好性;RSCU>1.00,表示随机使用该密码子的频率相对较高;RSCU<1.00,则随机使用该密码子的频率较低[18]。运用CodonW软件计算SaLDC 中每个密码子的RSCU 值,结果显示,除了起始密码子AUG 和终止密码子UAA外,SaLDC 的所有密码子中有28 个密码子的RSCU值>1.00,其中偏好性最强的密码子是AUC 和AGA(RSCU>2.00),见表1;编码Trp 的密码子UGG 的RSCU 值等于1.00,表明Trp 在SaLDC 中没有偏好性;此外,在28 个密码子中有17 个以A/T 结尾,可见SaLDC 偏好使用以A/T 结尾的密码子,与“2.1.1”项下结果一致。
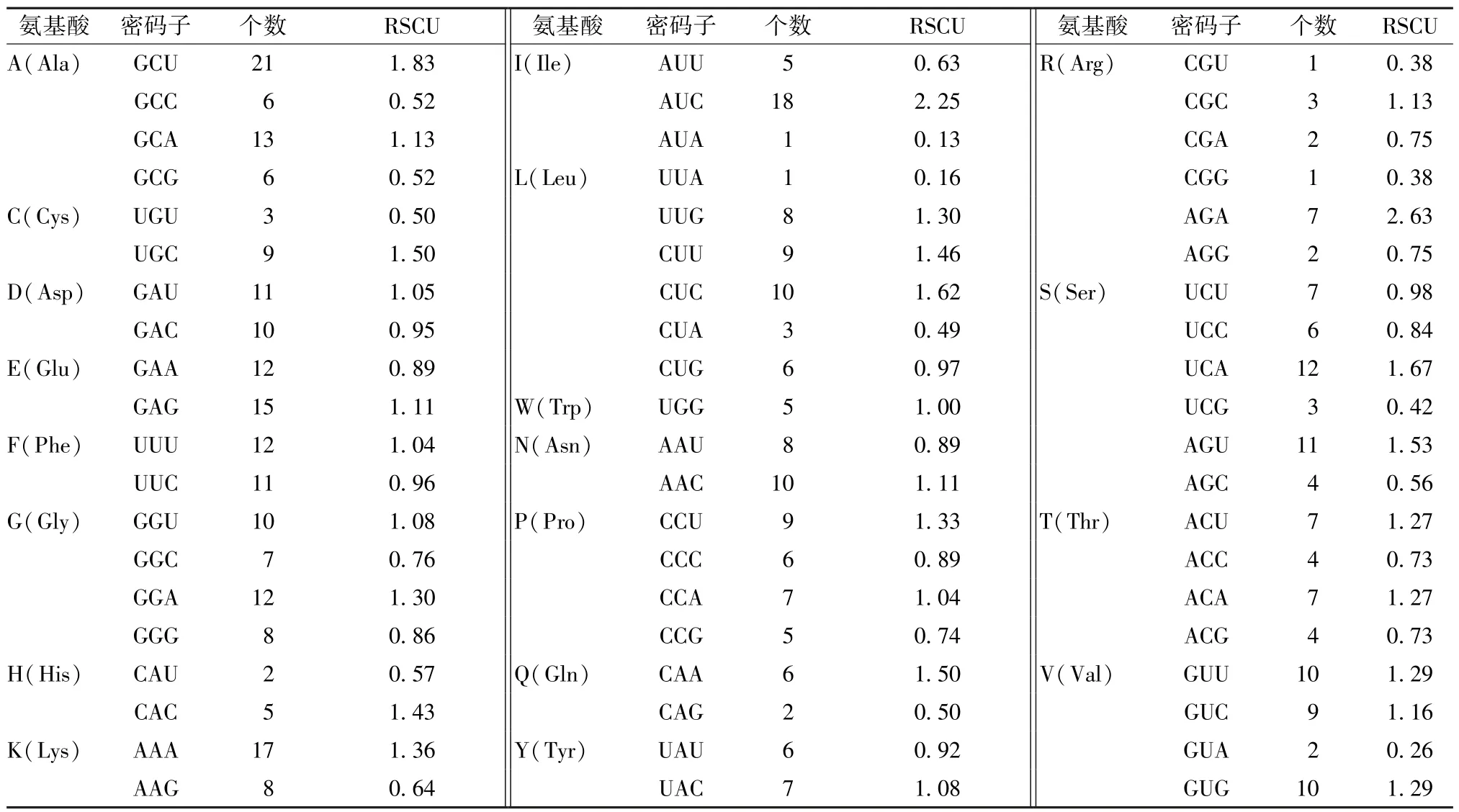
表1 SaLDC 密码子RSCU 值分析Tab.1 RSCU value analysis for SaLDC
2.1.3 SaLDC 密码子与模式生物基因组密码子使用频率比较分析 不同物种间密码子使用偏好性的差异一般用各物种间密码子使用频率比值来衡量,当2 个物种密码子使用频率比值≤0.5 或≥2 时,认为2 个物种间密码子使用偏好性差异较大[19]。比较分析SaLDC 与大肠杆菌、酵母、拟南芥、烟草和水稻5 个模式生物基因组的密码子使用频率,见表2,发现SaLDC 与拟南芥、烟草和水稻基因组差异较大的密码子分别是13、16、20 个,而与大肠杆菌、酵母基因组差异较大的密码子分别有28、21 个,由此可见,SaLDC 密码子使用频率与大肠杆菌基因组密码子使用频率差别甚大,若要使该基因在大肠杆菌中高效表达,必须对其密码子给予优化;拟南芥基因组与SaLDC 密码子使用偏好性最接近,适合作为SaLDC 遗传转化的受体物种,用于后续转基因植株的功能研究。
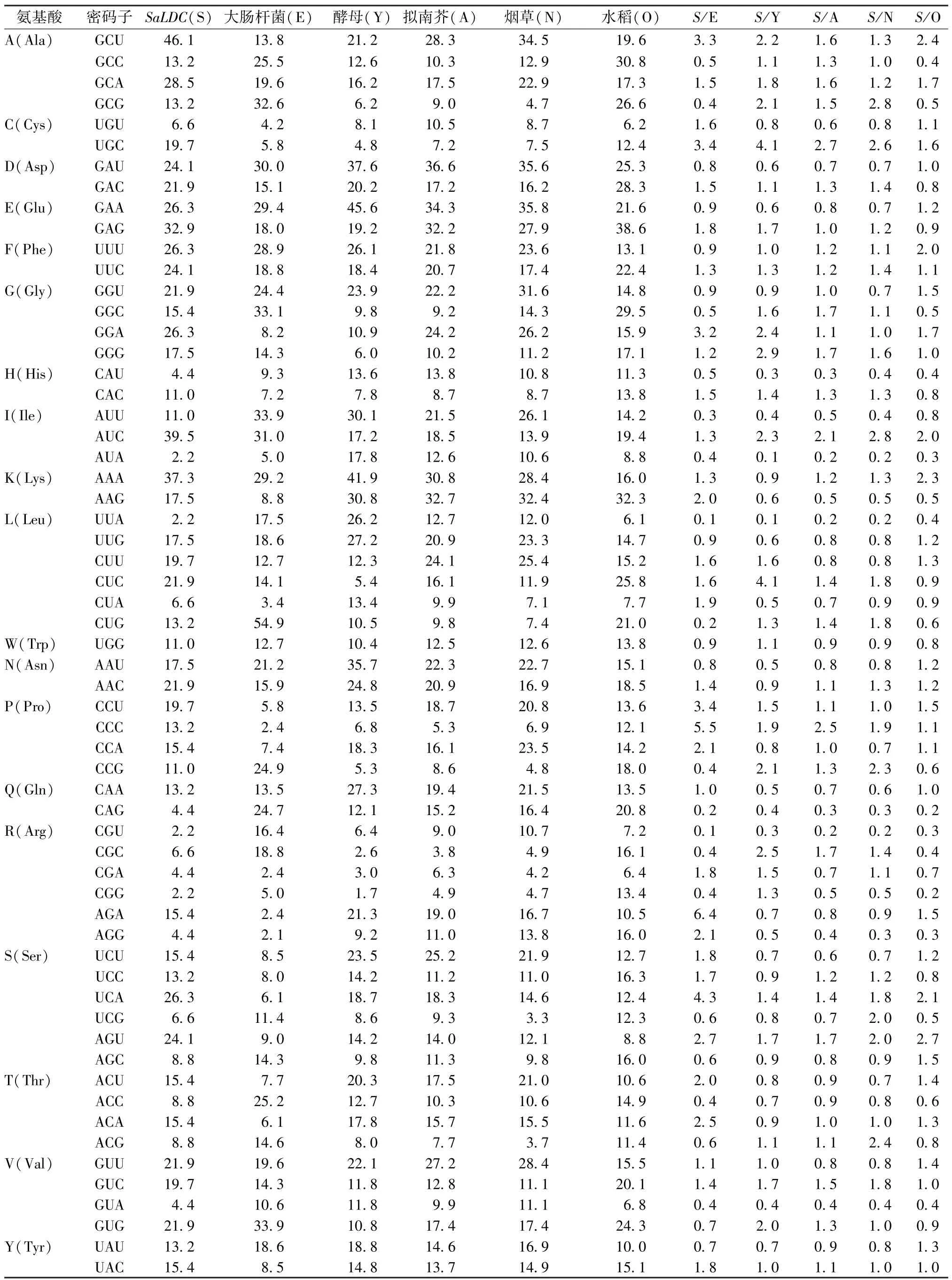
表2 苦豆子SaLDC 密码子与模式生物密码子使用偏好性比较Tab.2 Comparisons of codon usage preference between SaLDC and model organisms
2.2 optSaLDC 序列的获得和原核表达载体构建根据大肠杆菌密码子的偏好性,对SaLDC 序列进行密码子优化,得到新基因optSaLDC 序列。优化后的optSaLDC 核苷酸序列见图1。分析表明优化前SaLDC 密码子的适应指数为0.72,GC 含量为0.489,优化后optSaLDC 密码子的适应指数达到0.97,明显高于优化前,但0.493 的GC 含量与优化前并无明显差异。

图1 优化前SaLDC 与优化后optSaLDC 序列对比图Fig.1 Sequence comparison of SaLDC and optSaLDC
对构建好的重组质粒pET28a(+)-optSaLDC经XhoI/ApaI 双酶切,电泳条带测序结果证实opt-SaLDC 基因序列与设计的优化基因序列完全一致,表明原核表达重组质粒pET28a(+)-optSaLDC 构建成功。
2.3 重组optSaLDC 蛋白诱导表达和纯化 SDSPAGE 电泳发现在终浓度为0.2、1.0 mmol/L 的IPTG 诱导下,37 ℃、4 h 和15 ℃、16 h 均能诱导产生大小约为49 kDa 的重组蛋白,其中以1.0 mmol/L IPTG 在15 ℃下诱导16 h 沉淀中蛋白的表达量最大(图2A),表明optSaLDC 重组蛋白在细胞内表达时主要以包涵体形式存在。在上述条件下对optSaLDC 蛋白进行大量诱导,收集上清液并用Ni 柱亲和层析纯化,得到条带单一的纯化蛋白(图2B)。
2.4 optSaLDC 重组蛋白的Western blot 检测和LCMS/MS 鉴定 Western blot 分析显示重组蛋白opt-SaLDC 在43~55 kDa 间出现1 条特异性条带(图3A)。LC-MS/MS 鉴定结果表明蛋白复杂度高(图3B),肽段序列覆盖度(检测到的肽段氨基酸数目占该蛋白质全部氨基酸数目的比例)高达47.03%,分子量48 990.51 Da,等电点5.60,与预测结果相符,GO 注释认为该蛋白的主要生物学功能是催化赖氨酸脱羧形成尸胺。
3 讨论
核苷酸组成是影响基因密码子使用的重要因素之一,在自然界大多数生物中,密码子的使用具有一定的偏好性,其中密码子的第3 个位置被认为是最有可能反映基因组碱基组成的位置[20]。本研究发现SaLDC 对编码丝氨酸的TCT、TCA、AGT,精氨酸的AGA,赖氨酸的AAA 等密码子偏好性较强,对第3 位碱基为A/T 的密码子使用频率较高。同义密码子使用偏差与基因组AT 或GC 含量有关,在小麦和水稻基因组中富含GC,密码子的第3 位也偏好使用G/C[21]。此外,富含AT 的生物在密码子的第3 位也偏好使用A/T,如苹果和杨梅[22-23],在本研究中 SaLDC 的 GC(48.9%)和 GC3s(46.5%)含量表明该基因AT 含量略高于GC 含量,因而偏好使用以A/T 结尾的密码子,这也恰好符合双子叶植物密码子的使用特性[24]。
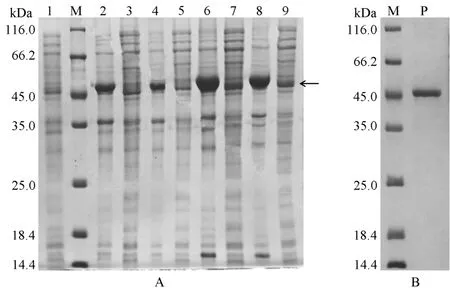
图2 optSaLDC 重组蛋白的表达鉴定(A)和纯化(B)Fig.2 Expression(A)and purification(B)of optSaLDC fusion protein
转基因研究中经常会涉及到基因的异源表达,然而异源受体物种的选择往往会影响外源基因表达效率的高低。因此,适当改造或优化外源基因密码子,使其与选择的受体物种密码子使用特性相似,可有效提高该基因的表达水平[25]。本研究通过比较SaLDC 与5 种模式生物基因组中不同密码子的使用偏好性,发现SaLDC 密码子与大肠杆菌基因组密码子使用偏差最大,若要以大肠杆菌为宿主进行SaLDC 的原核表达,则需要对其密码子进行优化;SaLDC 密码子与拟南芥基因组密码子使用偏好性差异最小,由此表明拟南芥真核表达系统相比其他模式植物更适合作为SaLDC 的外源表达系统。本研究分析的SaLDC 密码子使用偏好性不仅为通过密码子优化提高其在外源表达系统中的表达水平,也可为寻找最佳外源表达系统提供参考。
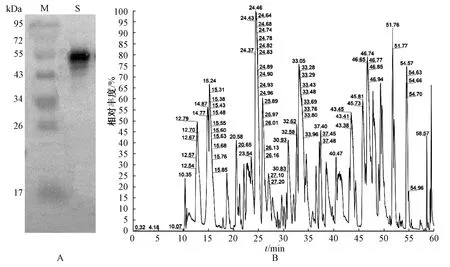
图3 optSaLDC 重组蛋白的Western blot 检测(A)和LC-MS/MS 鉴定(B)Fig.3 Western Blot detection(A)and LC-MS/MS identification(B)of optSaLDC fusion protein
大肠杆菌具有生长迅速、细胞密度高、转化方法简单等特点,在原核蛋白表达系统中最为常用,影响大肠杆菌表达融合蛋白的因素包括表达载体、目的基因密码子偏好性、诱导温度、IPTG 浓度和诱导时间等[26]。pET-28a(+)载体常用于外源基因的诱导表达,具有培养简单、高效和快速等优势[27]。因此,本研究通过对目的基因密码子和诱导条件的优化,成功制备并纯化获得了大量的opt-SaLDC 可溶性蛋白。研究结果表明,苦豆子opt-SaLDC 蛋白最佳诱导条件是 IPTG 终浓度1.0 mmol/L,在15 ℃下诱导16 h;Western blot 分析显示在43~55 kDa 之间出现一条带,由于Western blot 使用的是预染Maker,与在SDS-PAGE胶用的非预染Maker 有一定差距,因而对该蛋白进行LC-MS/MS 鉴定,结果显示分子量是48 990.51 Da,与预测结果吻合。

