卵巢癌肉瘤的1例报告及其各组分分化起源探究
毕莹莹,邢 峰,程忠平
(同济大学附属第十人民医院妇产科,上海 200072)
卵巢癌肉瘤又称恶性中胚叶混合瘤、苗勒瘤,是卵巢恶性肿瘤中一种罕见的组织学类型,其发生率在卵巢恶性肿瘤中占比约1%[1],其组成成分包括恶性上皮成分及肉瘤成分。卵巢癌肉瘤较其他卵巢恶性肿瘤而言,侵袭性强、进展快,大多数肿瘤在诊断时已侵袭至卵巢以外,因此预后不佳,目前尚没有统一、有效的临床治疗方案。由于这类肿瘤的罕见性,目前对于疾病的发生发展过程、各组分的来源及患者预后结果等了解有限。本文将报道1例包括3种组分的极其罕见的癌肉瘤病例(癌成分为低分化子宫内膜样腺癌50%;肉瘤成分以高级别子宫内膜间质肉瘤为主40%,局部含有横纹肌肉瘤成分10%)。并对国内外有关此类卵巢肿瘤各组分分化起源相关的文献进行回顾复习,后续拟对保存的组织标本进行以显微切割为技术基础的基因测序,以期探讨总结卵巢癌肉瘤各组成成分的起源情况。这一病例意义重大,类似病例的记录必须保存,供今后参考,以进一步了解该组织学类型的卵巢肿瘤。
1 资料与方法
1.1 基本情况
患者,女,61岁,因“头晕2个月伴颈部不适”于2018年7月6日收入同济大学附属第十人民医院中医科诊治,入院后完善检查,意外发现盆腔实性肿块,转入妇科进行进一步诊治。患者既往月经规律,现已绝经9年,无绝经后异常阴道流血流液,否认既往有卵巢肿瘤病史,否认近期体重下降,否认家族妇科肿瘤病史。血清肿瘤指标:CA125为147.5U/mL,HE-4为324.8pmol/L。妇科查体:外阴(-),阴道畅,宫颈光,子宫萎缩。左侧附件区可扪及肿块,约7cm,质硬,活动度较差。右附件区未触及明显异常。2018年7月12日盆腔增强MRI示:子宫直肠窝内见约7.9cm×7.1cm×6.7cm的异常信号灶,增强后呈明显不均匀强化,见图1。右侧子宫角前侧见约3.5cm的类似信号及异常强化灶。子宫大小、形态未见明显异常。提示盆腔内多发占位。盆腔较多积液。患者术前胃镜、结肠镜检查正常。
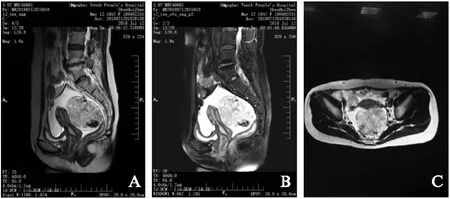
图1 术前盆腔增强MRI图像Fig.1 Preoperative enhanced MRI of pelvisA:矢状位T2加权平扫;B:矢状位增强早期;C:横断面T2加权平扫
1.2 治疗及预后
排除手术禁忌后,患者2018年7月17日全身麻醉下行腹腔镜检查见:子宫前位,萎缩,表面光滑。左侧卵巢囊性增大,大小约8cm,表明凹凸不平,见菜花样组织;右卵巢表面见一约5cm菜花样组织。双侧输卵管外观未见明显异常。肿块与周围组织无粘连。双侧输卵管外观未见明显异常。盆腔见淡黄色腹水约500mL。大网膜、肠壁,盆腹腔腹膜,肝胃未见异常病灶。
术中快速冰冻病理提示右卵巢组织恶性肿瘤,类型待酶联免疫法测定,故予以行卵巢癌分期手术(全子宫、双侧卵巢-输卵管切除+大网膜切除+盆腔淋巴结切除+腹主动脉旁淋巴结取样术)。术中顺铂100mg腹腔内化疗。患者术后石蜡病理报告明确诊断后,予追加紫杉醇180mg静脉化疗,化疗后患者一般情况可,无明显化疗后不适,伤口愈合可。
患者出院诊断为卵巢癌肉瘤,手术-病理分期为IIA期。术后行辅助化疗2次TP方案化疗(紫杉醇+顺铂)+4次TC方案化疗(紫杉醇+卡铂)。化疗第6个周期结束后患者出现不完全肠梗阻症状,入院予以对症支持治疗后缓解。化疗疗程结束后,血清肿瘤指标HE-4由术前324.8pmol/L降至68.17pmol/L;CA125由术前147.5U/mL降至8.18U/mL。随访至2020年4月,未发现其他明显异常,随诊检查影像学及血清肿瘤指标均未发现复发迹象。
1.3 组织病理
术后组织病理(全子宫+双侧附件切除标本)如下。(1) 老年性子宫内膜;(2) 慢性宫颈炎伴鳞状上皮轻度异型增生;(3) 右侧输卵管:子宫内膜样腺癌,伴部分鳞状细胞分化;(4) 右侧卵巢、左侧输卵管、左侧卵巢:癌肉瘤,符合恶性中胚叶混合瘤。癌成分为低分化子宫内膜样腺癌伴鳞状细胞分化(50%);肉瘤成分以高级别子宫内膜间质肉瘤为主(40%),局部含有横纹肌肉瘤成分(10%);(5) 双 侧宫旁组织,未见明确的肿瘤累及;(6) 大网膜未见肿瘤。(腹主动脉旁)淋巴结2枚、(左盆腔)淋巴结8枚和(右盆腔)淋巴结7枚均未见肿瘤。
免疫组化结果:癌成分ck-p(+),ck7(+),p63(+),ck5/6(+),ki67(70%+);肉瘤成分vimentin(+),myod1部分(+),myogenin部分(+),desmin部分(+),S-100(-),ki67(35%+)。
低倍至高倍镜下癌和肉瘤组织病理切片见图2。
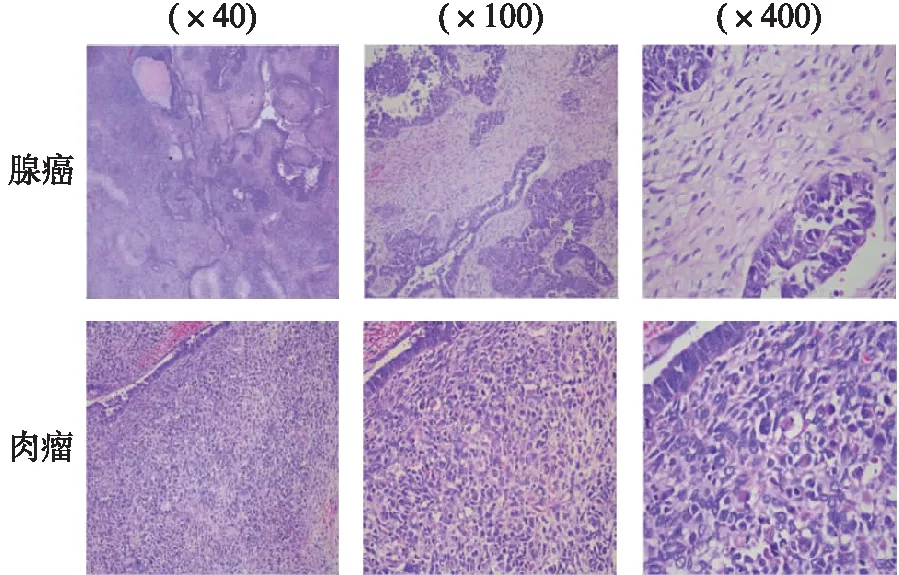
图2 组织病理切片下腺癌和肉瘤成分(H-E染色)Fig.2 Component of adenocarinoma subsarcoma in histopathological section (H-E staining)
2 讨 论
2.1 癌肉瘤两相成分
卵巢癌肉瘤是一种罕见的,侵袭性强的两相肿瘤,从组织学上看其组分包括癌成分和肉瘤成分。该组织学类型在卵巢恶性肿瘤中比例不到2%[2]。癌性成分类型包括子宫内膜样癌、浆液性癌、透明细胞癌、鳞状细胞癌、黏液性癌及未分化癌等。根据是否存在那些常存在于原位肿瘤中的异源性组织成分,肉瘤成分分为同源性的(即具有Müller病理),和异源的(即软骨肉瘤、骨肉瘤、横纹肌肉瘤、血管肉瘤或脂肪肉瘤等)[3-4]。在免疫组织化学检测中,抗细胞角蛋白单克隆抗体和抗上皮膜抗原用于上皮癌性成分的检测。波形蛋白单克隆抗体、CD 10、平滑肌肌动蛋白、肌间线蛋白和肌红蛋白可用于间充质成分的检测。S100蛋白多克隆抗体可用于检测肿瘤内软骨样组织或脂肪组织的分化[5]。既往有研究表明,女性生殖系统癌肉瘤当中的肉瘤成分,特别是异源性肉瘤成分的存在,与不良预后有关[6-7]。相反,另有研究表明,浆液性癌、透明细胞癌这些癌性成分预示着预后不佳[8-9]。总的来说,组织学成分是否影响癌肉瘤的预后尚存在许多争论,需日后更多病例的随访研究。
2.2 卵巢癌肉瘤与卵巢上皮性肿瘤
卵巢癌肉瘤的临床表现、影像学表现及血清学指标是非特异性的,与其他类型的卵巢恶性肿瘤几乎无法区分,因此术前诊断相当困难。卵巢癌肉瘤多见于绝经后老年妇女,有研究指出,与上皮性卵巢癌比较,卵巢癌肉瘤患者平均年龄偏大[10]。卵巢癌肉瘤与一般卵巢上皮性恶性肿瘤在早期症状及体征上无特异性差别,手术-病理分期 Ⅲ、Ⅳ期可表现出腹痛、腹胀和胃肠道症状,盆腔肿块等,明确诊断有赖于术后组织病理。卵巢癌肉瘤的影像学表现是非特异性的,大体表现为盆腔肿物,与其他类型的卵巢上皮肿瘤几乎无法区分。CA-125等肿瘤标志物在某些病例中可能并没有升高。即使是腹水细胞学分析也不一定能发现恶性成分。在Menon等[11]的一项研究中,12例卵巢癌肉瘤中有9例术前CA-125升高。在该病例中,CA-125水平为147.50U/mL,并没有显著升高。据报道,与上皮性卵巢恶性肿瘤相比,早期诊断的卵巢癌肉瘤中血清肿瘤指标CA125水平正常的比例较高。但CA-125对预后的评估并无重要意义[12]。
2.3 分化起源理论解释
卵巢癌肉瘤的发病机制一直是一个具有争论的话题。目前主要有3种理论来解释该类肿瘤的两相现象,见图3。(1) 碰撞理论认为,上皮癌和肉瘤这两种成分是独立进化继而相互碰撞的,表明癌和肉瘤是两个独立的肿瘤,即双克隆性。(2) 联合理论认为共同的干细胞前体分化为癌和肉瘤,即这两种成分均来源于肿瘤演化早期发生分化的单个干细胞。(3) 转化理论认为肉瘤细胞由肿瘤演化过程中的癌成分分化而来,或原始干细胞分化为一种细胞类型,进而分化为第二种细胞类型[13]。

图3 妇科癌肉瘤两相成分的起源假说[14]Fig.3 Origin hypothesis of two-phase components in gynecological carcinosarcoma[14]
Zhao等[15]采用全外显子序列分析了68例子宫和卵巢癌肉瘤的基因突变情况,进行了多区域的全外显子测序,分析了来自6个肿瘤的癌和肉瘤样本,以探究他们的进化史。结果表明,癌性和肉瘤性成分来源于具有典型癌基因突变的共同前驱物。支持癌和肉瘤这两种成分有共同遗传来源,即联合理论。如果联合理论是正确的,那么这些驱动突变很可能存在于分化为癌性和肉瘤性成分的早期干细胞中,表明靶向治疗可能在癌肉瘤的两种成分中都显示出疗效。转换理论在2例卵巢浆液性上皮癌复发为卵巢癌肉瘤的研究中得到证实[16]。许多在妇科生殖系统癌肉瘤中发现的驱动突变曾在子宫或卵巢癌中表达过,这也支持转化理论,即肉瘤成分在进化过程中来源于癌成分。近期的研究中转录组学和DNA甲基化分析证实了上皮间充质转化是肉瘤分化的机制之一,为癌肉瘤的治疗提供了可能性,同时也为理解其发展的分子组织形成机制提供了线索[17]。确定一种注定要发生转化的肿瘤的分子决定因素,可能有助于早期诊断癌肉瘤,并有助于更好地针对这些更具侵袭性的肿瘤进行治疗。Gotoh等[17]对癌肉瘤样本进行基因分型和外显子测序,重点研究了596个基因。这些被检测的样本取自癌与肉瘤成分相邻接的组织,通过激光捕获显微解剖进行了离散捕获。检测的结果证实了先前的发现[15,18],即癌成分和肉瘤成分在很大程度上具有相同的的驱动突变,这支持癌肉瘤成分组织分化的联合理论或转化理论即单克隆性,而不是碰撞理论。然而,关于组织分化起源假说倾向于联合理论还是转化理论仍旧存在争论。
2.4 治疗现状及展望
癌肉瘤的分期是评估预后最重要的标准,因为通常在诊断时已处于晚期,大多数预后极差。一项包括1763名癌肉瘤患者的研究显示,Ⅰ、Ⅱ期患者5年生存率为65.2%,Ⅲ期患者5年生存率为18.2%,Ⅳ期患者5年生存率仅11.2%[19]。该例患者分期为ⅡA,现预后情况可,需进一步随访。
既往报道的卵巢癌肉瘤病例系列认为,最大限度的肿瘤细胞减灭术与无进展生存期和整体生存质量相关,完全的癌细胞减灭应作为手术治疗的目标[13]。完成分期手术后,Ⅰ~Ⅳ期患者都应进行术后辅助化疗,化疗方案与上皮性卵巢癌相同,铂类药物为基础,联合阿霉素、异环磷酰胺、环磷酰胺、紫杉醇等用药。Rauh-Hain等[20]对50例术后使用卡铂联合紫杉醇化疗的卵巢癌肉瘤患者化疗疗效进行评估,化疗总有效率为62%。以铂类药物为基础的化疗方案被推荐为最有效的方案。该病例使用铂类联合紫杉醇化疗,术后将近2年,预后情况可,未见复发迹象,将继续随访。
另外,生物“靶向”疗法在许多癌症治疗方面已得到应用,如果在卵巢癌肉瘤这类肿瘤中找到合适的靶点,那么未来对卵巢癌肉瘤的治疗将有更好的前景。表皮生长因子受体在30%卵巢癌肉瘤中过度表达,是西妥昔单抗等药物的分子治疗靶点[21]。C-kit在16%~25%的卵巢癌肉瘤中过度表达,是咪替尼的治疗靶点,COX-2在部分病例中过度表达,COX-2抑制剂或许可以用于癌肉瘤的靶向治疗。Her-2在40%~56%卵巢癌肉瘤中过度表达,是曲妥珠单抗的治疗靶点[22-23]。血管内皮细胞生长因子在在卵巢上皮性肿瘤中表达增高,在44%卵巢癌肉瘤病例中表达,是贝伐珠单抗的分子治疗靶点[24-25]。然而在评估分子靶向治疗的作用的临床试验中,这类疾病的罕见性是主要障碍,进一步的多中心随机对照试验,或设计良好的非随机研究是必要的。
由于病例的罕见性,目前的研究多停留在病例系列,更多的病例积累,对病理确诊的病例标本进行基因测序,探究卵巢癌肉瘤各组分的分化起源,可最终为卵巢癌肉瘤的治疗提供更多的依据。对基因和分子信号通路的研究可能会提高对这种肿瘤亚型的认识,并有助于确定最有效的辅助化疗方案[26]。
2.5 小结
该病例初步表明全面分期手术,辅助铂基化疗对卵巢癌肉瘤治疗的有效性,需要日后更多的积累总结。我们的讨论提供了对卵巢癌肉瘤两相成分的分化起源更深一步的了解,目前对卵巢癌肉瘤的两相成分分化起源倾向于单克隆性,但是对于两种组分是来源于肿瘤演化早期发生分化的单个干细胞(即联合理论),或是原始干细胞分化为一种细胞类型,进而分化为第二种细胞类型(即转化理论)仍存在较多争议,进一步病例积累研究是必要的。这些发现将为进一步研究该组织学类型的肿瘤的病因和最佳治疗方法提供有用的起点。
——一对性格习性迥异的兄弟

