潞党参甾体类成分及其抗炎活性
张俊卿 李建宽王 妍吉姣姣高建平∗
(1.山西医科大学药学院,山西太原 030001;2.山西医科大学第一医院药学部,山西太原 030001)
党参为桔梗科植物党参Codonopsis pilosula(Franch.)Nannf.、素花党参Codonopsis pilosulaNannf.var.moesta(Nannf.)L.T.Shen 或川党参Codonopsis tangshenOliv.的干燥根,具有健脾益肺、养血生津的功效,在我国传统医学中作为补益类中药被广泛使用[1]。在现代临床中,党参常被应用于心血管系统[2]、消化系统[3]及呼吸系统疾病[4]等。炎症反应是机体的一种以防御为主的基本病理过程,与各系统疾病的发生发展密切相关[5-7]。炎症作为众多疾病的共性机制,开展相关研究或将为疾病的预防、诊断及治疗提供新策略。针对党参的抗炎活性研究发现,其石油醚萃取部位抗炎效果显著[8];甲醇提取物可显著抑制炎性介质NO 水平和 iNOS 的表达[9];轮叶党参lancemaside A 通过抑制IKK/NF-κB 通路发挥抗炎作用[10],但党参活性物质基础尚不明确。本实验从潞党参中分离得到4 个甾体类化合物,通过建立体外LPS 诱导的RAW264.7 细胞炎症模型对其抗炎活性进行评价,以期为其有效物质的进一步开发提供参考。
1 材料
1.1 试剂与药物 潞党参购于山西省长治市平顺县,经山西医科大学药学院高建平教授鉴定为桔梗科植物党参Codonopsis pilosula(Franch.)Nannf.的干燥根,样品保存于山西医科大学药学院中药教研室(编号20170901)。小鼠单核巨噬细胞白血病细胞(RAW264.7)购于武汉普诺赛生命科技有限公司(货号CL-0190)。
DMEM 高糖培养基(美国赛默飞世尔Gibco 公司,批号 8119281);胎牛血清(澳大利亚AusGeneX 公司,批号FBSSA00818-1);L8880 型LPS(批号1128W031,北京索莱宝科技有限公司);青霉素链霉素混合液(批号20190320,北京索莱宝科技有限公司);细胞计数CCK-8 试剂盒(批号N20821,北京全式金公司);NO 试剂盒(E-BC-K035-M)、IL-6 试剂盒(E-EL-M0044c)、TNF-α 试剂盒(E-EL-M0049),均购于武汉Elab-Science 公司。柱层析硅胶(200~300 目,青岛海洋化工厂);TLC 硅胶60 F254(德国Merck 公司)。甲醇、石油醚(60~90 ℃)、乙酸乙酯、正丁醇、二氯甲烷均为分析纯。
1.2 仪器 Avance Ⅲ型400 MHz 窄腔液体核磁共振仪(德国布鲁克公司);GCMS-QP2010 质谱仪(日本岛津公司);KDM 型调温电热套(山东鄄城华鲁电热仪器有限公司);RE-52AA 型旋转蒸发器(上海亚荣生化仪器厂);A-1000s 型真空水流抽气机(上海爱朗仪器有限公司);DLSB-5/20 型低温冷却液循环泵(郑州长城科工贸有限公司);TH-Ⅱ型数控薄层显色加热器(上海科哲生化有限公司);HX-01PW 型薄层喷雾器(武汉恒信仪器有限公司);Goodsee-Ⅰ薄层色谱摄影仪(上海科哲生化有限公司);DZF-6020MBE 型真空干燥箱(上海博讯实业有限公司);HF90 型CO2培养箱(Heal Force 力康生物医疗有限公司);SW-CJ-2F型洁净工作台(上海博迅医疗生物仪器公司);DMi8/DFC45OC 型倒置荧光显微镜(德国Leica 公司);AMR-100 型全自动酶标分析仪(杭州奥盛仪器有限公司);SC-2546 型低速离心机(安徽中科中佳科学仪器有限公司)。
2 方法
2.1 提取与分离 取干燥潞党参25 kg,粉碎,甲醇回流提取3 次(分别回流2、1.5、1 h),合并提取液并减压浓缩,浸膏用水混悬后依次用石油醚、乙酸乙酯、正丁醇各萃取3 次,回收溶剂后得石油醚部位0.498 kg、乙酸乙酯部位0.066 kg、正丁醇部位0.356 kg。石油醚部位经硅胶柱,石油醚-乙酸乙酯(70∶1、60∶1、50∶1、30∶1、20∶1、10∶1、9∶1、8∶2),二氯甲烷-甲醇(40∶1、25∶1、10∶1、9∶1、8∶2、7∶3、6∶4)梯度洗脱,用薄层色谱(TLC)检测合并相似馏分,减压回收溶剂后得到馏分段Fr.1~Fr.20。Fr.8(5.0 g)经硅胶柱,以石油醚-乙酸乙酯(60∶1~10∶1)梯度洗脱,分离得到5 个馏分Fr.8.1~Fr.8.5。其中,Fr.8.4(1.0 g)经反复硅胶柱色谱分离得到菠甾酮类化合物(1~2,330 mg);Fr.12(7.0 g)以石油醚-乙酸乙酯(8∶2~6∶4)梯度洗脱,得到6 个馏分Fr.12.1~Fr.12.6,Fr.12.4 进行硅胶柱分离,石油醚-乙酸乙酯(8∶2)洗脱,得到菠甾醇类化合物(3~4,880 mg)。
2.2 细胞培养 小鼠巨噬细胞株RAW264.7 采用含有10% 胎牛血清、1% 青霉素(1×105U/mL)、链霉素(1×105μg/L)的DMEM 高糖培养基培养,条件为37 ℃、5%CO2,待细胞融合达到70%~80%后进行细胞传代。实验所用细胞均处于对数生长期,状态良好。
2.3 甾体化合物溶液制备及分组 菠甾酮化合物(1~2)和菠甾醇化合物(3~4)均用二甲基亚砜(DMSO)完全溶解制备成质量浓度为0.5 mg/mL母液,再用完全培养基分别稀释为3 个质量浓度组(1、2、4 μg/mL),使DMSO 最大工作液质量浓度在5 μg/mL 以下。
2.4 细胞炎症模型建立 将对数生长期的RAW264.7 细胞以1×105/mL 的浓度接种于96 孔板,于37 ℃,5%CO2条件下培养24 h,弃去孔内培养基,分别加入含有不同质量浓度LPS 的培养基,并设置空白组和对照组,每组6 个复孔。继续培养24 h 后,采用CCK-8 法测定不同质量浓度LPS 对细胞活力的影响,Griess 法检测其诱导细胞产生炎症介质NO 水平,从而确定后续细胞炎症模型中质量浓度。
2.5 甾体化合物对细胞活力的影响 将处于对数生长期的RAW264.7 细胞用刮刀刮下,加完全培养基制备单细胞悬液,浓度调整至约5×104/mL,按每孔100 μL 将细胞接种于96 孔细胞板中,置37 ℃、5% CO2培养箱中培养24 h。弃去旧培养基,加入用培养基稀释的各浓度甾体化合物,每孔100 μL,空白组和对照组也分别加入等量的培养基,每组设6 个复孔,继续置于培养箱中培养24 h。利用CCK-8 法测定细胞活力,在每孔中加入10 μL CCK 试剂,在培养箱中继续培养2 h,用酶标仪测定450 nm 下每孔的吸光度值并计算细胞存活率。
2.6 甾体化合物对LPS 诱导的RAW264.7 释放NO水平的影响 分别取处于对数生长期且状态良好的RAW264.7 细胞,调整细胞浓度为1×105/mL,接种于96孔板,每孔100 μL,置37 ℃、5% CO2培养箱中培养。24 h 后,弃去旧培养液,设置对照组、LPS 模型组、甾体化合物+LPS 组(加入含各质量浓度化合物的培养基120 μL 预保护4 h,吸出含药培养液,换为含LPS 的培养基120 μL)。每孔终体积均为120 μL,每组设3 个复孔,各处理组均在相同时间点加入LPS,继续培养24 h 后,每孔取其细胞上清液100 μL,依照NO 试剂盒说明书的方法,在酶标仪550 nm 处测定OD值,并计算NO 水平。抑制率=(1 -NO 浓度药物组/NO 浓度模型组)×100%。
2.7 甾体化合物对LPS 诱导的RAW264.7 分泌炎性因子的影响 取处于对数生长期且状态良好的RAW264.7 细胞,调整细胞浓度为1×105/mL,接种于24 孔板,每孔500 μL,置于37 ℃、5%CO2培养箱中培养。24 h 后,弃去旧培养液,设置空白对照组、LPS 模型组、甾体化合物+LPS 组(加入含各质量浓度化合物的培养基500 μL 预保护4 h,吸出含药培养液,换为含LPS 的培养基500 μL)。每组设3 个复孔,各处理组均在相同时间点加入LPS,继续培养24 h 后,收集各组每孔细胞上清液,稀释适当倍数后,取100 μL,用IL-6 和TNF-α Elisa 试剂盒按照说明书的方法检测炎性因子的含有量。
3 结果
3.1 结构鉴定
化合物1:白色结晶,EI-MSm/z:410,分子式C29H46O。1H-NMR(400 MHz,CDCl3)δ:5.17(m,1H,H-7),5.12(dd,J=15.0,8.6 Hz,1H,H-22),5.02(dd,J=15.2,8.6 Hz,1H,H-23),2.41(td,J=14.5,5.9 Hz,4H,CH2-2,CH2-4),1.00(s,3H,CH3-19),0.92(d,J=6.4 Hz,3H,CH3-21),0.84(d,J=5.2 Hz,3H,CH3-26),0.79(t,J=6.1 Hz,3H,CH3-29),0.78(d,J=5.1 Hz,3H,CH3-27),0.55(s,3H,CH3-18);13C-NMR(100 MHz,CDCl3)δ:211.8(C-3),139.5(C-8),138.0(C-22),129.5(C-23),117.0(C-7),55.8(C-17),55.0(C-14),51.2(C-24),48.8(C-9),44.2(C-4),43.3(C-13),42.8(C-5),40.8(C-20),39.3(C-12),38.7(C-1),38.1(C-2),34.4(C-10),31.8(C-25),30.0(C-6),28.5(C-16),25.4(C-28),23.0(C-15),21.7(C-11),21.3(C-27),21.1(C-21),19.0(C-26),12.4(C-19),12.2(C-29),12.1(C-18)。以上数据与文献[11-12]一致,故鉴定为α-菠甾酮。
化合物2:白色结晶,EI-MSm/z:412,分子式C29H48O。1H-NMR(400 MHz,CDCl3)δ:5.17(m,1H,H-7),2.41(td,J=14.5,5.9 Hz,4H,CH2-2,CH2-4),1.00(s,3H,CH3-19),0.56(s,3H,CH3-18);13C-NMR(100 MHz,CDCl3)δ:211.8(C-3),139.4(C-8),116.9(C-7),56.0(C-14),54.9(C-17),48.8(C-9),45.8(C-24),44.2(C-4),43.2(C-13),42.8(C-5),39.4(C-12),38.7(C-1),38.1(C-2),36.5(C-20),34.4(C-10),33.8(C-22),30.0(C-6),29.1(C-25),27.9(C-16),26.1(C-23),23.0(C-28),22.9(C-15),21.7(C-11),19.8(C-26),19.0(C-27),18.9(C-21),12.4(C-19),11.9(C-29),11.8(C-18)。以上数据与文献[13]一致,故鉴定为22,23-二氢菠菜甾酮。
化合物3:无色针状结晶,EI-MSm/z:412,分子式C29H48O。1H-NMR(400 MHz,CDCl3)δ:5.14(m,1H,H-7),5.14(dd,J=15.0,8.0 Hz,1H,H-22),5.01(dd,J=15.8,8.0 Hz,1H,H-23),3.57(m,1H,H-3),1.01(d,J=6.6 Hz,3H,CH3-21),0.91(d,J=6.3 Hz,3H,C-26),0.84(t,J=6 Hz,3H,CH3-29),0.83(s,3H,CH3-19),0.78(d,J=5 Hz,3H,C-27),0.53(s,3H,CH3-18);13C-NMR(100 MHz,CDCl3)δ:139.6(C-8),138.2(C-22),129.4(C-23),117.4(C-7),71.0(C-3),55.9(C-17),55.1(C-14),51.2(C-24),49.4(C-9),43.3(C-13),40.8(C-20),40.2(C-5),39.4(C-12),37.9(C-4),37.1(C-1),34.2(C-10),31.8(C-25),31.4(C-2),29.6(C-6),28.5(C-16),25.4(C-28),23.0(C-15),21.5(C-11),21.4(C-21),21.1(C-26),19.0(C-27),13.0(C-19),12.2(C-29),12.0(C-18)。以上数据与文献[14]一致,故鉴定为α-菠甾醇。
化合物4:无色针状结晶,EI-MSm/z:414,分子式C29H50O。1H-NMR(400 MHz,CDCl3)δ:5.14(m,1H,H-7),3.57(m,1H,H-3),1.01(d,J=6.6 Hz,3H,CH3-21),0.91(d,J=6.3 Hz,3H,C-26),0.84(t,J=6 Hz,3H,CH3-29),0.83(s,3H,CH3-19),0.78(d,J=5 Hz,3H,C-27),0.53(s,3H,CH3-18);13CNMR(100 MHz,CDCl3)δ:139.5(C-8),117.4(C-7),71.0(C-3),56.1(C-17),55.0(C-14),49.4(C-9),45.8(C-24),43.2(C-13),40.2(C-5),39.5(C-12),37.9(C-4),37.1(C-1),36.6(C-20),34.2(C-10),33.9(C-22),31.4(C-2),29.1(C-6),29.1(C-25),27.9(C-16),26.1(C-23),23.0(C-28),22.9(C-15),21.5(C-11),19.8(C-26),19.0(C-27),18.9(C-21),13.0(C-19),11.9(C-29),11.8(C-18)。以上数据与文献[15]一致,故鉴定为22,23-二氢菠菜甾醇。
3.2 RAW264.7 细胞炎症模型建立 不同质量浓度的LPS 可不同程度地引起细胞增殖,并浓度依赖性地诱导炎症介质NO 产生,结果见图1。10 ng/mL LPS 组与对照组比较,其细胞增殖程度差异无统计学意义(P>0.05),但NO 水平增加(P<0.01),故选择其作为后续细胞实验的炎症模型。
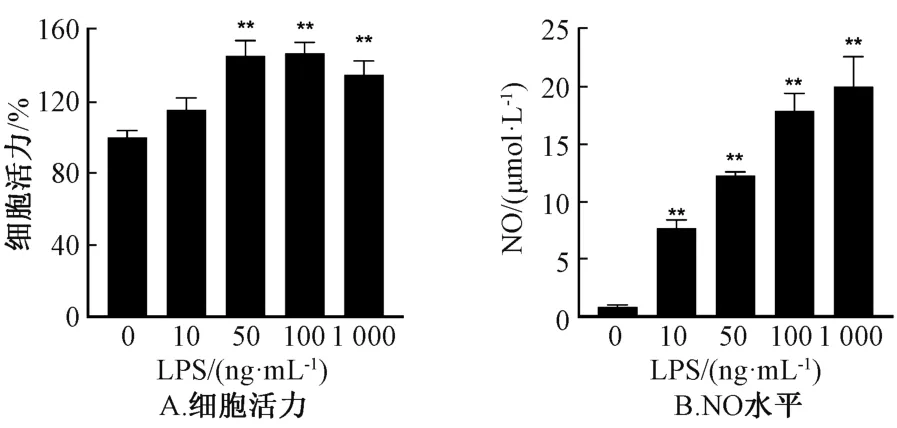
图1 不同质量浓度LPS 对细胞活力、NO 水平的影响Fig.1 Effects of different concentrations of LPS on cell viability and level of NO
3.3 甾体化合物对RAW 264.7 细胞活力的影响采用CCK-8 法检测细胞经甾体化合物处理后的细胞活力。结果显示,菠甾酮化合物(1~2)在质量浓度为5 μg/mL 时细胞活力稍有下降,但并无统计学差异(P>0.05);菠甾醇化合物(3~4)在质量浓度5 μg/mL 以下时均未对细胞活力造成影响。因此,后续细胞实验中甾体化合物质量浓度均在5 μg/mL以下,见图2。
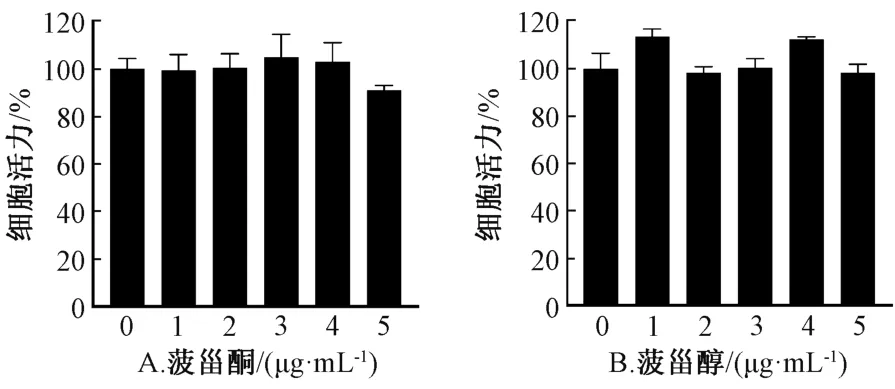
图2 菠甾酮、菠甾醇对RAW264.7 细胞活力的影响Fig.2 Effects of spinasteron and spinasterol on the viability of RAW264.7 cells
3.4 甾体化合物对LPS 诱导RAW 264.7 细胞释放NO 水平的影响 与对照组比较,10 ng/mL LPS 可诱导RAW264.7 细胞上清中NO 水平增加(P<0.01);药物预处理组与模型组比较,药物组均能显著抑制细胞上清中的NO 水平。菠甾酮在1、2、4 μg/mL 质量浓度下对LPS 刺激条件下产生的NO抑制率分别为22.69%、37.23%、46.87%,菠甾醇在1、2、4 μg/mL 质量浓度下对LPS 刺激条件下产生的NO 抑制率分别为11.17%、18.00%、20.31%,见图3A。菠甾酮能显著降低细胞炎症模型中NO 水平,并呈剂量依赖性,而菠甾醇对NO水平的抑制活性不呈剂量依赖性。
3.5 甾体化合物对LPS 诱导RAW 264.7 细胞分泌IL-6 及TNF-α 的影响 与对照组比较,LPS 组IL-6、TNF-α 水平均显著增加。甾体化合物预处理4 h后,与LPS 组比较,菠甾酮在1、2、4 μg/mL质量浓度下IL-6 水平抑制率分别为43.59%、62.23%、88.37%,TNF-α 抑制率分别为34.79%、50.61%、82.48%;菠甾醇在1、2、4 μg/mL质量浓度下对IL-6 水平的抑制率分别为36.82%、49.28%、83.10%,对TNF-α 水平的抑制率为19.43%、44.64%、72.79%,见图3B~3C。由此可见,菠甾酮和菠甾醇均可显著抑制LPS 诱导RAW264.7 细胞炎性因子IL-6、TNF-α 的分泌,并呈浓度依赖关系,而且相同质量浓度下前者活性更强。

图3 甾体化合物对NO、IL-6、TNF-α 水平的影响Fig.3 Effect of steroids on levels of NO,IL-6 and TNF-α
4 讨论
甾体类是自然界中广泛存在的一种成分,均具有环戊烷骈多氢菲的甾体母核。甾体类化合物分类较多,其中植物来源的甾醇因其具有广泛的药理活性被高度关注,近年大量研究表明植物甾醇具有降血脂[16]、保护胃黏膜[17]、抗肿瘤[18]、抗炎[19]等作用。对于植物甾醇的抗炎活性,报道较多的是β-谷甾醇[20]、岩藻甾醇[21]、α-菠甾醇[22-23]以及麦角甾醇[24],而对于其他结构类型的植物甾醇研究相对较少。本研究分离得到4 个甾体类化合物中仅α-菠甾醇有相关抗炎活性的文献报道[22-23]。4 个化合物在化学结构上具有一定的相似性,α-菠甾醇与α-菠甾酮仅在C-3 位上的取代不同(分别为—OH取代和=O 取代),另外2 个甾体化合物则分别为α-菠甾醇及α-菠甾酮的C-17 侧链中的不饱和双键被氢化。本研究通过建立体外细胞炎症模型,比较了菠甾酮和菠甾醇的抗炎活性,发现菠甾酮的各项体外抗炎活性指标(NO、IL-6、TNF-α)均优于菠甾醇,提示C-3 位上的不同取代基可能会对甾体化合物的抗炎活性产生一定影响。与菠甾酮比较,菠甾醇对NO 水平的抑制活性不成浓度依赖性关系,推测炎性介质NO 的产生可能受甾体结构中C-3 位取代基的影响更大。据文献报道[25],LPS 通过激活MAPK 和NF-κB 信号途径刺激诱导型NO 合成酶(iNOS)的合成而催化产生过量NO 参与机体炎症反应,这提示具有不同取代基的甾体化合物可能是对分泌NO 过程中的某些途径产生不同的影响,从而造成NO 水平的差异。这种甾体结构上的差异与发挥抗炎活性的相关性研究尚需在今后进一步探讨。

