两种施肥处理下不同有机质含量农田黑土微生物群落结构PLFA分析
陈一民,隋跃宇,刘晓冰,侯 萌,张兴义
(中国科学院 东北地理与农业生态研究所 黑土区农业生态重点实验室,黑龙江 哈尔滨 150081)
0 引 言
土壤微生物是土壤有机质的重要分解者,也是驱动农田生态系统中养分循环的主要贡献者[1]。土壤有机质是陆地生态系统中最大的碳库[2],其含量、活性组分和结构都会对土壤微生物群落产生较大的影响[3-5]。我国东北黑土区有机质含量变化范围较大,约6.5~128.9 g·kg-1[6],有机质含量的差异是影响黑土区土壤微生物群落的主要因素之一;同时随着有机质含量的变化,土壤有机质组分特征[7-8]也会发生较大的变异,这将对土壤微生物群落结构和组成产生直接的影响。
施肥是最重要的农业措施之一,近年来由于化肥投入量过大,已经导致了严重的黑土退化,以及土壤生态环境持续恶化[9]。但是,化肥对土壤微生物群落组成的影响目前尚无一致的报道,有研究认为化肥会显著改变微生物群落结构[10-12],但也有报道中提及长期施用化肥后土壤微生物群落趋于稳定,对施用化肥的响应变弱[13-14]。因此,研究有机质含量和施肥对黑土微生物群落结构的综合影响十分必要。
气候条件、种植及管理模式等也是影响土壤微生物群落结构的重要因素,但区域尺度研究很难将有机含量对土壤微生物群落的影响从诸多因素中分离开来[4-5];同时,传统肥料试验一般只关注施肥对特定土壤中微生物群落的影响[9],这些弊端极大限制了我们认识有机质含量和施肥在决定土壤微生物群落结构中的重要作用。因此,本研究利用空间移位方法,将不同有机质含量的农田黑土置于相同气候条件下,采用相同的种植模式和田间管理措施来消除气候等因子的差异,系统地研究了有机质含量和施肥对农田黑土微生物群落结构的影响,旨在深化对有机质含量-施肥-土壤微生物群落结构之间关系的认识。
1 材料与方法
1.1 研究区域概况
试验地位于东北典型黑土带中部的中国科学院海伦农业生态实验站(N47°27′,E126°56′),气候类型为温带大陆季风气候,年平均气温1.5 ℃,年降水量500~600 mm,冬季寒冷干燥,夏季高温多雨。年有效积温约2 400 ℃,年均日照时数约2 700 h,无霜期约120 d,地下水埋深在10~20 m之间。
1.2 试验设计
试验始于2004年,在黑土区采集有机质含量16.6 g·kg-1(SOM1.7)、32.2 g·kg-1(SOM3)、50.6 g·kg-1(SOM5)、58.6 g·kg-1(SOM6)和108.9 g·kg-1(SOM11)5个有机质含量的农田黑土,通过空间移位的方法运至中国科学院海伦农业生态实验站,按原层次分别置入各个的微区中。微区规格为1.4 m长×1.2 m宽×1 m深。微区间用砖墙隔开,高出地表20cm,内侧贴防水布防止不同微区间相互影响。试验设施肥(NPK)和不施肥(CK)两个处理,每个处理3次重复。每年5月初种植玉米,施肥处理中基肥施肥量为N 90 kg·hm-2,P2O575 kg·hm-2,K2O 60 kg·hm-2;在玉米大喇叭口期追施肥量为 N 60 kg·hm-2[15]。
1.3 土壤样品采集与预处理
土壤样品于2016年10月8日玉米收获后采集。用土钻采沿“S”型在各个小区内均匀采集0~20 cm 土样,取5-7个点混成一个样。混合的土样装入封口聚乙烯袋,置于保鲜盒中带回实验室,进行处理。取回的土样在-80℃条件下冰箱保存,于测定磷脂脂肪酸前采用冷冻干燥机冻干。
1.4 土壤磷脂脂肪酸的提取与分析
土壤磷脂脂肪酸的提取参照Frostegard的方法进行[16]。称取冷冻干燥的3.00g土壤样品于离心管中,使用氯仿-甲醇-柠檬酸单相提取剂(体积比为1∶2∶0.8)提取两次后进行洗脱,之后加入KOH甲醇溶液进行甲脂化,甲脂化完成后用正己烷萃取磷脂脂肪酸甲脂,并用氮气吹干。将得到的脂肪酸甲脂样品溶于60 μL的正己烷,通过带有MIDI峰识别软件气相色谱测定。
如表1所示,根据不同的磷脂脂肪酸标记,对样品中微生物丰度进行统计。
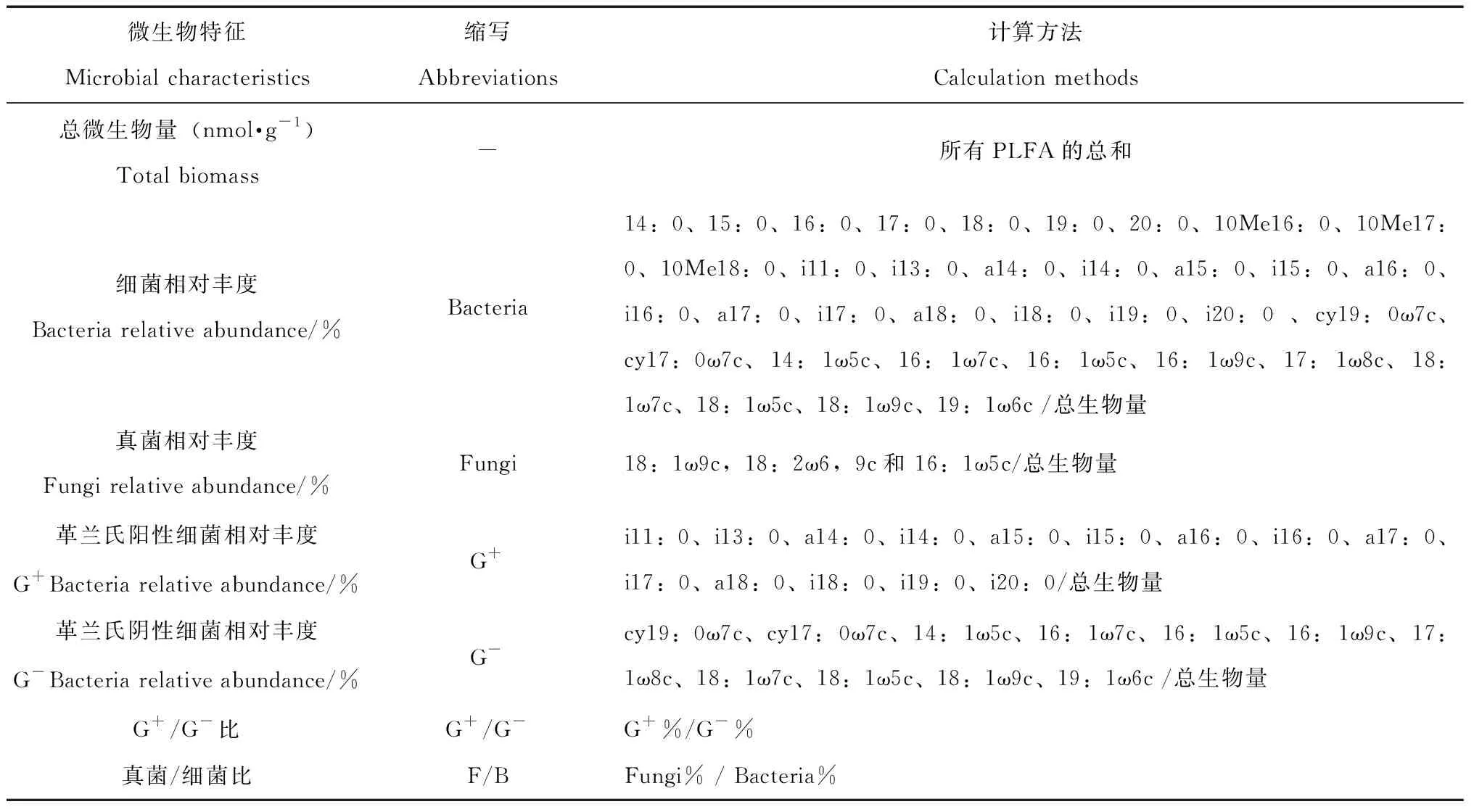
表1 微生物磷脂脂肪酸标记Table 1 PLFA biomarkers for microbes
1.5 数据处理与分析
PLFA含量、PLFA相对丰度等采用SPSS20.0(IBM SPSS Inc.)进行平均值和标准差的计算。采用双因素方差分析检测不同施肥处理和不同有机质含量之间的差异,采用Turkey′s HSD方法在α=0.05水平上进行多重比较。PLFA的NMDS分析采用R软件(version 3.4.3)的“vegan”包进行分析,采用Sigmaplot 12.5进行绘图。
2 结果与分析
2.1 不同有机质含量农田黑土土壤微生物群落生物量
在5个有机质含量农田黑土,整体来看随土壤有机质含量的增加,总微生物量呈增加趋势(图1)。在施肥处理中SOM1.7、SOM3、SOM5、SOM6和SOM11土壤总生物量显著高于不施肥处理土壤总微生物量,增加幅度为9%~77%(P<0.05)。细菌生物量的变化趋势与总生物量类似(图2),整体来看细菌生物量随有机质含量升高而增多,除SOM5外,施肥均能显著提高农田黑土土壤细菌的生物量,提高幅度为16%~113%(P<0.05)。革兰氏阳性细菌、革兰氏阴性细菌生物量对土壤有机质和施肥的响应与细菌总生物量一致(图2)。就真菌而言,其生物量也随有机质含量增加而增加,但是施肥仅显著增加了SOM3中的真菌生物量,对其他有机质含量农田黑土土壤真菌生物量的影响不显著(图2)。
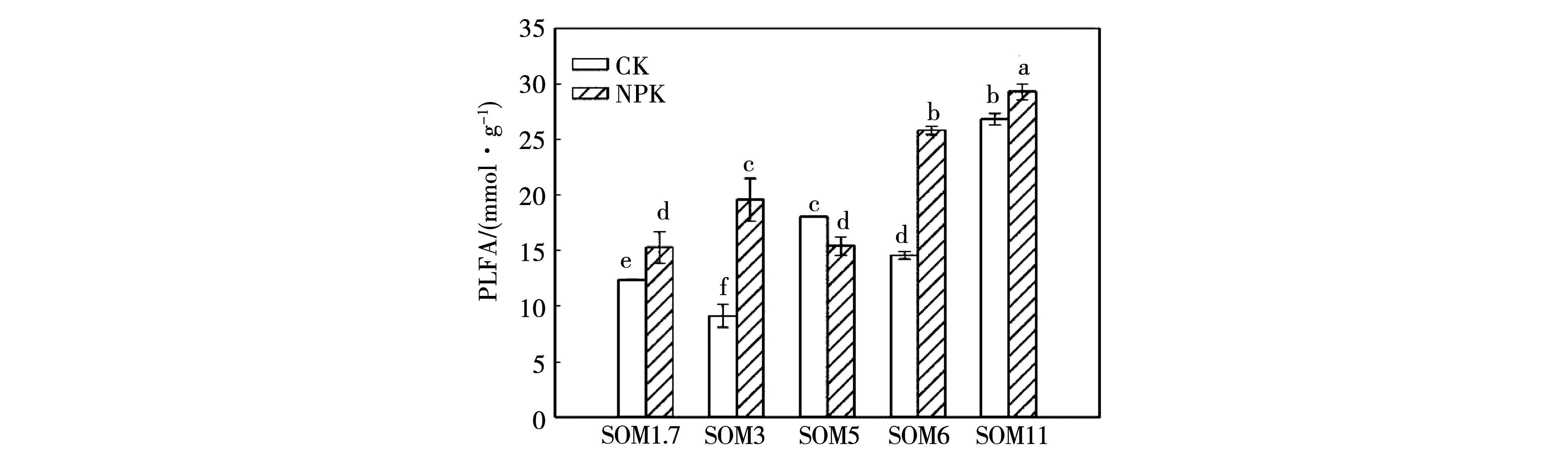
注:不同字母代表两种施肥条件下五个有机质间在0.05水平上差异达到显著。下同。Note: Different letters indicate significant differences between treatments at 0.05 level.The same is as below.图1 不同有机质含量农田黑土土壤磷脂脂肪酸总量Fig.1 Total PLFAs in Mollisols with different organic matter contents
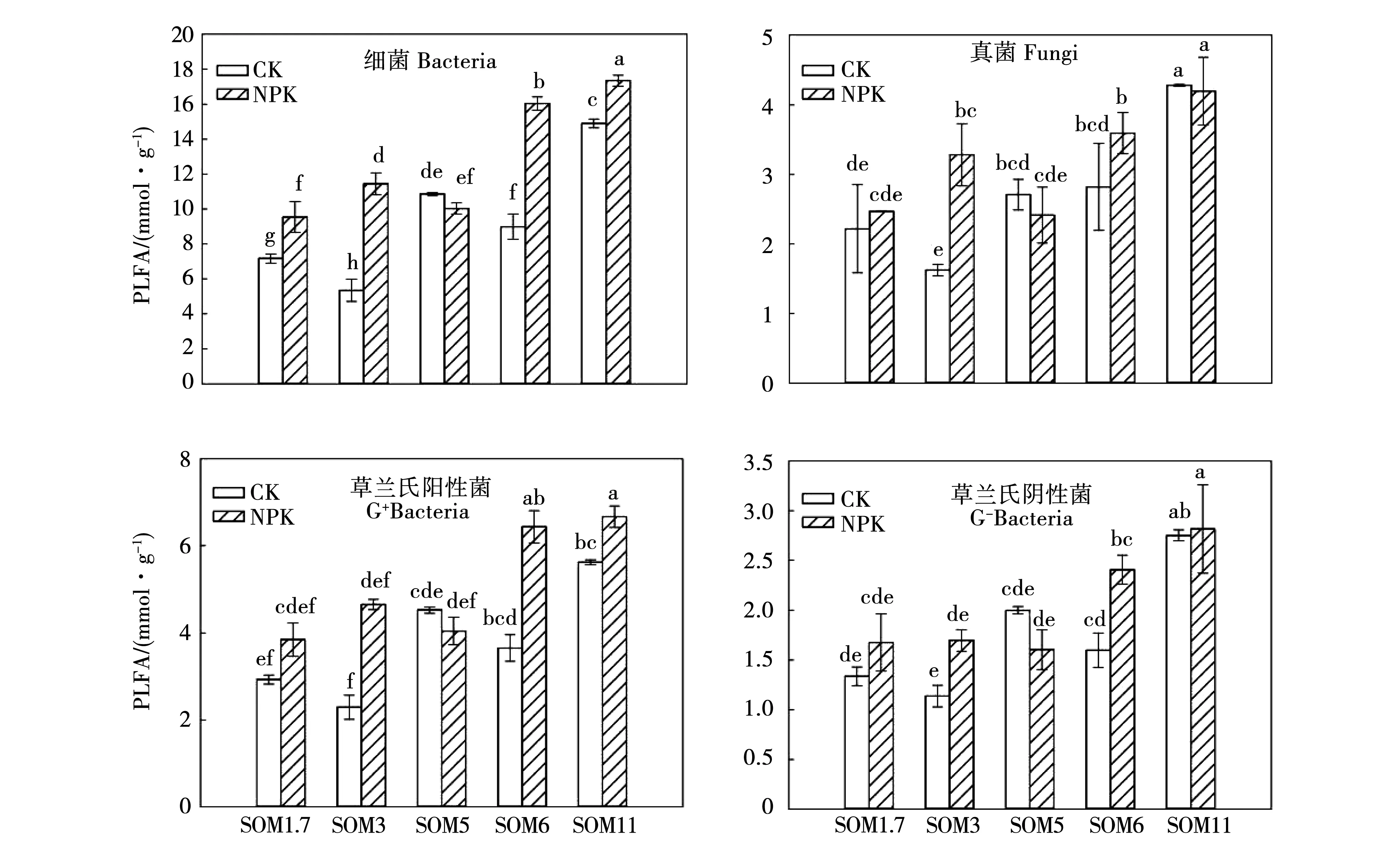
图2 不同有机质含量农田黑土细菌、真菌、革兰氏阳性细菌和革兰氏阴性细菌磷脂脂肪酸标志物含量Fig.2 Bacterial,fungal,gram-positive bacterial and gram-negative bacterial PLFAs in Mollisols with different organic matter contents
2.2 不同有机质含量农田黑土土壤微生物相对丰度
就相对丰度而言,其变化规律与生物量的变化规律不同(表2)。在两种施肥处理中,5个有机质含量农田黑土间真菌相对丰度无显著差异,但整体来看,施肥处理中各有机质含量农田黑土土壤真菌的相对丰度要略低于不施肥处理。细菌相对丰度先随有机质含量增加而增加,在SOM5或SOM6中达到最高,之后在SOM11中发生明显的下降;施肥能够增加各有机质含量农田黑土土壤细菌的相对丰度。在SOM1.7、SOM3、SOM5、SOM6和SOM11中,两种施肥处理中革兰氏阳性细菌的相对丰度无明显差异,整体来看,施肥后革兰氏阳性细菌的相对丰度略有提升。革兰氏阴性细菌的相对丰度在不施肥处理中SOM3中最高,在施肥处理SOM3中最低,但在相同施肥处理下的5个有机质含量农田黑土差异不大;整体来看,施肥后革兰氏阴性细菌的相对丰度略有下降。真菌/细菌比在本研究中无显著差异,但整体上施肥后真菌/细菌比值略有降低,这主要是由于施肥后真菌相对丰度有所下降,但细菌相对丰度有所升高所引起的。在同一施肥处理中,G+/G-比值在5个有机质含量农田黑土无显著差异;但是施肥处理中G+/G-比值略高于不施肥处理,这主要是由于施肥增加G+相对丰度但却降低G-相对丰度所引起的。
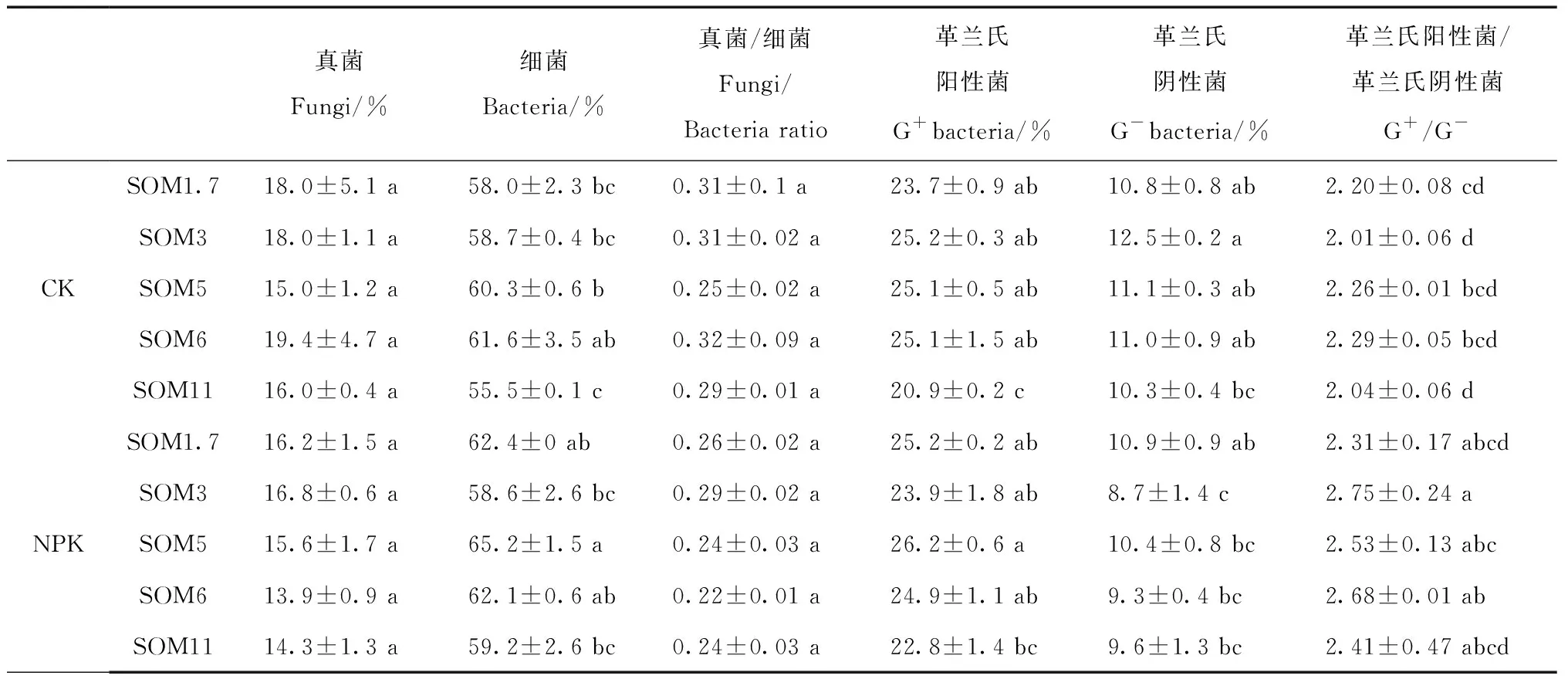
表2 不同有机质含量农田黑土土壤微生物相对丰度Table 2 Relative abundance of microbes in Mollisols with different organic matter contents
2.3 不同有机质含量农田黑土土壤微生物群落结构分析
通过对PLFA进行NMDS分析发现,农田黑土土壤有机质含量和施肥均会影响土壤微生物群落组成(图3)。在NMDS图谱中,相同施肥条件下每个有机质含量的农田黑土3次重复都聚在一起,说明本研究中微生物群落结构样品重复性较好。如图3中椭圆所示,基于Bray-curtis距离,从NMDS图谱发现沿NMDS1方向不施肥处理与施肥处理中微生物群落结构的明显分开。在不施肥处理中,各有机质含量农田黑土间微生物群落结构明显与其他分开;但在施肥处理中除5个有机质含量农田黑土土壤微生物群落结构很难分开,这说明施肥会削弱土壤有机质含量对土壤微生物群落结构的影响。由NMDS图谱也能发现,随着有机质含量的升高,不施肥处理与施肥处理中微生物群落结构的相似性也增强,这说明有机质含量升高会帮助微生物群落在外界干扰条件下保持一定的稳定性。
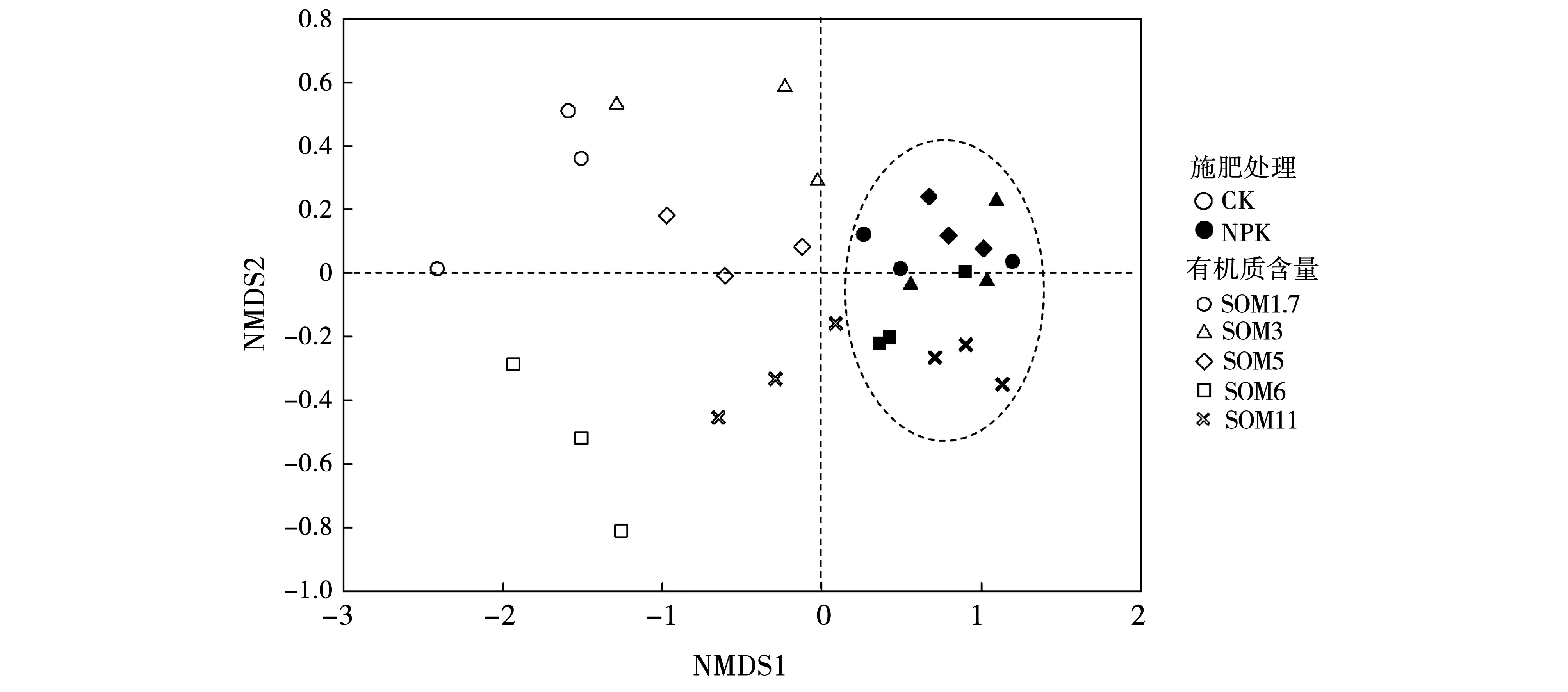
图3 NMDS分析图谱Fig.3 NMDS analysis
3 讨 论
本研究中,有机质含量和施肥对PLFA总量、细菌PLFA量、真菌PLFA量、G+PLFA量、G-PLFA量和微生物群落组成均产生了较大的影响。随着有机质含量的升高,土壤微生物可利用碳源量增加,这可能是导致土壤PLFA总量、细菌PLFA量和真菌PLFA量增加的直接原因[17-18]。施肥也能引起土壤PLFA总量、细菌PLFA量和真菌PLFA量显著增加,这与之前的研究结果相同[3,19],这主要是由于施肥后为微生物的生长繁殖提供养分,尤其是氮素,直接促进土壤微生物的生长[20]。但也有研究指出,长期施用化肥会使土壤酸化、板结,通气性降低,改变了土壤物理性状,抑制了土壤微生物的生命活动,同时由于无外源有机碳源补充,随着作物生长对土壤碳素的大量消耗,使得土壤有机碳含量逐渐减少,迫使土壤微生物将其体内固持的碳素释放出来以供作物利用,进而显著降低了土壤微生物量[21]。施肥对土壤微生物量的影响主要是由于土壤类型不同所造成的,黑土有机质含量高,盐基离子丰富,缓冲能力较强,施用化肥所带来的的负面效应可被缓冲,在养分源充足的情况下,微生物迅速繁殖。综上,可通过调节黑土有机质含量和适量施肥来改变微生物量,促进黑土养分转化,提升黑土质量。
就微生物群落结构而言,本研究中5个有机质含量农田中细菌相对丰度、真菌相对丰度、真菌/细菌比及G+/G-比在相同施肥处理中几乎无变化。这主要是是由于细菌、真菌、G+细菌、G-细菌及总微生物量均随土壤有机质含量的增加而增加,这种同步增加的趋势导致真菌、细菌、G+细菌和G-细菌的相对丰度变化不大,进而造成真菌/细菌比值、G+/G-细菌比值变化也不大。已有研究表明,施用化肥后微生物群组的相对丰度可能会增加[22],可能会减少[10],也有可能会保持不变[17]。但是,选择哪种分类水平来表征土壤微生物群落变化一直是十分重要的问题[23-24]。由于PLFA技术中分类能力有限,很难确定具体某种微生物的丰度变化。因此,将来需要更详尽的分类水平来研究施肥对微生物相对丰度的影响。
NMDS分析发现,有机质含量与施肥是影响农田黑土微生物群落组成的重要因素。土壤有机质含量是决定土壤细菌多样性的首要因素[5],并且是真菌空间分布格局的主导因素[4],因为土壤中绝大多数的微生物,依赖于分解土壤有机质来获取能量[22]。已有很多研究证实施用化肥会引起土壤微生物群落组成[10,12]]。本研究中,长期施用化肥能显著改变微生物群落组成,这是由于微生物群落组成对N、P和K肥料的施用敏感所造成的[25];此外,微生物对肥料的敏感性可能也是造成本研究中施肥处理下有机质含量对微生物群落结构的影响受到削弱的原因。
空间移位方法是消除气候条件、种植、管理模式及施肥差异等因素的有效研究方法。短期空间移位后,土壤类型是影响微生物群落结构的主要因子,土壤微生物群落对环境条件的改变具有一定的抵抗力[26];随着时间的推移,空间移位后土壤微生物群落与原始位点土壤微生物群落朝不同方向发生演替[27],但土壤类型仍是决定土壤微生物群落结构的最重要因素[28]。本研究是在空间移位12年后开展的,5个黑土本身性质对微生物群落仍具有十分显著的影响,这也进一步说明了土壤类型在决定微生物群落中的重要作用。本研究中未进行原位样点与移位后土壤微生物群落结构差异的分析,以后的研究中应着重进行移位后与原位样点间微生物群落结构差异的分析,在排除土壤类型的影响后明确气候条件对微生物群落的影响。
4 结 论
(1)有机质含量升高和施肥会显著提高农田黑土总微生物量、细菌生物量、真菌生物量、革兰氏阳性细菌生物量和革兰氏阴性细菌生物量;
(2)有机质含量对农田黑土真菌/细菌比值和革兰氏阳性细菌/革兰氏阴性细菌比无显著影响,但施肥后革兰氏阳性细菌/革兰氏阴性细菌比略有升高,真菌/细菌比值无显著变化。
(3)有机质含量和施肥是影响农田黑土微生物群落结构的重要因素,并且施肥可能会在一定程度上掩盖有机质对微生物群落的影响。

