基于生物信息学验证CCR5参与类风湿关节炎发生发展的遗传学和组织学证据
王友强,兰由玉,李世勇
(西南医科大学:1附属中医医院检验科;2附属医院风湿免疫科,四川泸州 646000)
类风湿关节炎(rheumatoid arthritis,RA)是系统性自身免疫性疾病,以关节及其周围组织受累为主,多种致病因素参与了RA 的发病,随着疾病的进展,可导致患者关节畸形及其生活质量的严重下降[1-2]。CC 趋化因子受体5(C-C chemokine receptor 5,CCR5)是一种G 蛋白偶联受体,可通过调节白细胞的趋化活性在免疫和炎症反应中发挥重要作用[3-4],但关于CCR5 在RA 中的具体作用机制还有待进一步的研究。随着高通量生物医学实验方法的广泛应用,使深入研究疾病的分子机制成为现实,如生物信息学网络分析可帮助发现RA 诊治的潜在靶点[5-7]。本研究拟利用生物信息学分析GEO中RA相关的基因芯片数据,筛选RA 差异基因,并从中探寻CCR5在RA患者的表达情况及其在RA中可能的作用,以此验证CCR5参与RA发病的遗传学证据;再通过实验验证CCR5在RA大鼠异常表达的组织学证据,从而为后续进一步的探究CCR5 的作用机制研究奠定基础。
1 资料与方法
1.1 一般资料
1.1.1 数据来源及在线分析工具如下:
GEO:https://www.ncbi.nlm.nih.gov/geo/;
GEO2R:https://www.ncbi.nlm.nih.gov/geo/geo2r/;
limma包:http://master.bioconductor.org/packages/release/bioc/html/limma.html;
jvenn:http://jvenn.toulouse.inra.fr/app/example.html。
1.1.2 实验动物
SPF 级Wistar 雄性大鼠20 只,体重(171 ± 8)g,购买于西南医科大学实验动物中心,实验通过了西南医科大学实验动物伦理委员会批准。
1.1.3 主要试验试剂及仪器
弗氏完全佐剂(complete Freund's adjuvant,CFA)(美国,Sigma公司)、Trizol Reagent(日本,Taka⁃ra 公司)、逆转录试剂盒(美国,Promega 公司)、转膜液(上海碧云天生物技术有限公司)、CCR5 抗体(英国,Abcam公司)、二抗(兔抗羊IgG)(英国,Abcam公司)、PCR 试剂盒(日本,Takara 公司)、ABI7500 定量PCR 仪(美国,ABI 公司)、WB 显像仪(美国,BIO-RAD公司)。
1.2 方法
1.2.1 生物信息学筛选RA差异基因
在GEO数据库中以“rheumatoid arthritis”为关键词检索RA 的基因芯片,GSE 97779、GSE 77298、GSE 10500、GSE 55457 和GSE 1919 这5 个数据集被用于差异基因筛选,数据集的样本、注释平台等详细信息见表1。GEO2R 和limma 包对数据信息进行分析,以P.Value <0.05 和|Log Fold Change|>2 的基因被确定为差异表达基因,jvenn 是web 环境的开源组件,可以对含有不同元素的集合进行比较并绘制Venn图,这里用jvenn比较5个基因芯片的差异基因。

表1 类风湿性关节炎数据集信息
1.2.2 RA大鼠模型构建
将选购的SPF级Wistar雄鼠20只,体重(171±8)g,饲养1周后再随机分配为Control和RA 两组,每组各10只。RA组的10只Wistar雄鼠用于构建RA大鼠CIA模型。具体方法为:将Ⅱ型胶原蛋白充分溶解于浓度为0.1 mmol/L 的醋酸溶液中,然后再将相同剂量的弗氏完全佐剂(complete freund’s adjuvant,CFA)充分与上述混合液一起混匀,最后放置在冰浴中待其完全乳化;用注射器在Wistar 雄鼠尾根部多处注射,同样的方法再于1 周后重复操作一次;con⁃trol组的Wistar雄鼠在同样的时间、同样的部位仅注射Ⅱ型胶原蛋白0.2 mg。采用关节炎症指数(Arthri⁃tis index,AI)评分法评估RA 大鼠模型是否构建成功,AI大于或等于4分提示造模成功,四肢评分标准见表2,每隔5 d观察一次。

表2 AI评分标准
1.2.3 HE染色
每组大鼠断颈处死,逐渐剥离出膝关节滑膜组织后,经过固定、透明制作成石蜡切片。每组取5 张切片,先后经过脱蜡、乙醇梯度脱水及蒸馏水清洗后,用苏木精上色5 min,水流冲刷3 s,再先后用盐酸、水流分别冲刷清洗3 s,然后用伊红染料室温下着色2 min,去除染色液后分色2~3 s,经清洗、返蓝后,伊红再次上色1 min。将上述处理过的切片再先后予以梯度脱水、透明化、封片处理后镜检。镜下观察切片,胞核表现为蓝色,胞质则为红色。
1.2.4 免疫组化检测CCR5 在大鼠滑膜组织的表达情况
每组取5 张切片,二甲苯脱蜡,乙醇脱水,室温下,3%的H2O2溶液浸泡切片10 min后,用蒸馏水洗涤切片,每次5 min,共3次。再将切片放在含有枸橼酸盐Buffer(pH=6.0,0.01 nmol/L)的容器中充分浸泡,然后进行抗原修复。常温下,切片用正常羊血清(PBS 稀释至浓度为10%)封闭15~20 min,去除血清后再滴入一抗溶液(羊抗鼠的CCR5抗体),4 ℃过夜。PBS 清洗后滴入PBS 稀释的生物素标记的二抗(兔抗羊IgG),常温30 min。PBS 洗涤后加入链霉素卵蛋白工作液,常温搁置30 min。PBS 洗涤5 min×4次,DAB 显色处理后,用水冲洗,然后苏木素再次染色,乙醇梯度脱水,透明化处理,封片后光镜下观察。
1.2.5 CCR5 mRNA及蛋白水平的检测
各组滑膜组织用Trizol 法提取总RNA,并按照逆转录试剂盒说明书将RNA 逆转录为cDNA,再以GAPDH 为内参基因,将cDNA 进行PCR 扩增,反应条件:94 ℃预变性10 min,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸60 s,30 个循环,引物序列见表2。滑膜组织加入蛋白裂解液提取蛋白,再利用10%SDS分离胶与浓缩胶电泳分离、转膜,滴加稀释的一抗兔抗鼠CCR5,4 ℃孵育过夜;加入二抗37 ℃振荡孵育l h后用化学发光仪检测。

表2 引物基因序列
1.3 统计学方法
用SPSS 21.0 分析所得数据,定量数据以均值±标准差()表示,两个样本均数比较采用t 检验,以P <0.05表示差异有统计学意义。
2 结果
2.1 生物信息学筛选RA 差异基因以及CCR5 在RA患者的表达情况
GEO 数据库中RA 芯片GSE 97779、GSE 77298、GSE 10500、GSE 55457和GSE 1919筛选差异表达基因,筛选条件为P.Value <0.05 和|LogFoldChange| >2。在GSE 1919中,CCR5在RA组中的量是control组的5.74倍(22.52),说明RA患者CCR5的表达量明显高于正常人(P <0.05),如图1A;绘制GSE 77298 前70个差异基因的表达热图(图1B)提示CCR5 在RA 中的表达比control 组高;另外在GSE 97779、GSE 10500 和GSE 55457 芯片中,CCR5 的表达情况分别如图1C-1E所示,CCR5在RA患者中异常高表达。最后选取每种芯片前400 个基因进行比较,绘制Venn图(图1F)发现有1个交集基因-CCR5,说明CCR5在5个芯片均差异表达,可能是影响RA的一个重要因子。
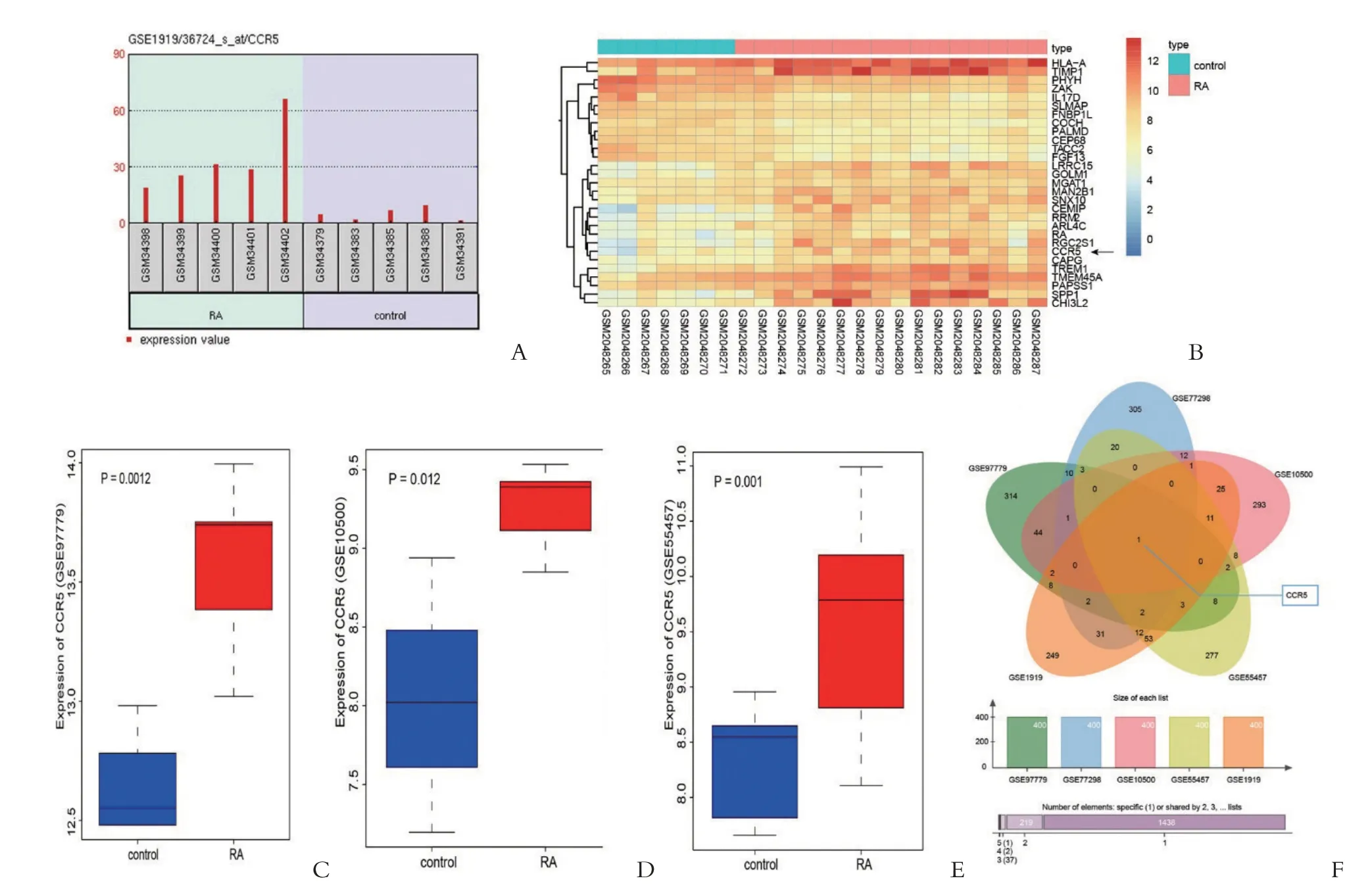
图1 生物信息学筛选结果及CCR5相对表达量的比较
2.2 RA大鼠模型鉴定
在给大鼠注射弗氏完全佐剂(CFA)8 h 后,RA组大鼠在注射一侧足趾部位出现红肿等关节炎症的表现,24 h 出现足踝部肿胀。10 d 后RA 模型大鼠表现出多关节炎,具体表现为前肢或对侧肢体,甚至耳部和尾部均有前面所述的炎症反应的表现。皮毛缺少光泽,体重减轻,精神稍萎靡,随着时间的延长,少数还可见脱皮、溃疡等。10 d后RA组大鼠AI明显升高,且随时间增加逐渐上升(P <0.05),至25 d 时AI(7.12±1.13)较10 d(1.21±0.73)、15 d(4.87±1.21)时进一步增高(P <0.05),见图2。而对照组大鼠无关节炎症等表现。由此可见RA大鼠模型构建成功。
2.3 RA大鼠滑膜组织病理形态变化
HE染色显示,与control组对比,RA组关节内滑膜增生,部分滑膜剥脱缺失,关节间隙稍增宽,骨及软骨轻微破坏,并向关节腔内突出,有较多炎性细胞浸润,软组织明显肿胀,可见新生血管翳形成,由此进一步提示RA大鼠模型构建是成功的。

图2 RA组大鼠关节炎指数(AI)
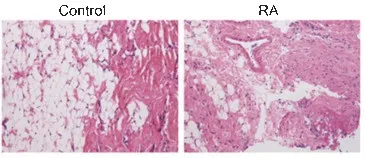
图3 RA大鼠滑膜组织病理形态比较
2.4 免疫组化测定CCR5在大鼠滑膜组织的表达情况
为证实CCR5 在RA 大鼠滑膜组织中的表达情况,如图3所示,本研究利用免疫组化染色方法可以更直观的了解CCR5 在大鼠滑膜细胞的表达情况,与对照组相比,RA 组CCR5 阳性率明显增加(P <0.001),说明CCR5在RA中表达增加,与生物信息学结果一致。

图4 免疫组化染色及CCR5阳性率比较
2.5 CCR5 mRNA和蛋白水平的表达情况
利用qRT-PCR 和Western Blot 方法进一步了解CCR5 mRNA和蛋白水平在RA大鼠滑膜组织中的表达情况,如图4 所示,与对照组对比,RA 组CCR5 mRNA 和蛋白水平明显升高(P <0.05),由此可知,生物信息学分析结果与实验结果一致,进一步表明RA大鼠CCR5表达水平是明显升高。

图5 各组滑膜组织CCR5 mRNA和蛋白水平的表达情况及比较
3 讨论
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性进行性自身免疫性疾病,与多种遗传、表观遗传学和环境因素有关,这些因素可影响关节,从而导致软骨和骨骼损伤,最终出现关节畸形和残疾[8-9]。尽管RA的病机尚不清楚,但有研究显示其慢性关节发炎归因于滑膜细胞的严重增殖、滑膜炎以及免疫细胞的浸润等[10-11],并且滑膜细胞在RA 的炎症和增殖过程中具有重要作用[12-13]。
CCR5,即CC-趋化因子受体5,是G蛋白偶联受体(GPCR),属于趋化因子受体家族,其主要功能是通过调节白细胞的活化和定向迁移来调控免疫炎症反应[14]。有研究[15-16]发现RA患者CCR5的表达是增加的,这与生信分析结果一致。有研究者利用生物信息学发现,CCR5、CCR7、CXCR4、CCL5和CCR4等关键基因参与了RA的疾病进展,其中趋化因子信号通路是介导成纤维样滑膜细胞(FLS)迁移、侵袭和释放趋化性的关键途径,是RA主要的信号通路之一[6],并且还发现CCL5及其相关基因可能是RA治疗策略的潜在生物标志物[17]。
本研究从GEO中筛出RA芯片数据集GSE 97779、GSE 77298、GSE 10500、GSE 55457 和GSE 1919,分别用GEO2R 和limma 包筛选RA 差异基因发现有较多差异基因,有待进一步确定关键基因。但Venn 图的结果发现有1 个交集基因中有且仅有一个基因——CCR5,说明CCR5 是5 个芯片中唯一共有的差异基因,提示其可能是影响RA 的一个关键基因。生物信息学分析还提示,CCR5 在RA 患者中的表达明显比对照组高,说明CCR5 在RA 患者中是高表达的,可能参与了RA的发病,由此可见,利用生物信息学方法验证CCR5 参与RA 发生发展的遗传学证据是可行的,同时为发现RA的分子机制和诊治目标提供线索和方向[18-19]。
为进一步验证CCR5在RA大鼠的表达情况,研究通过RT-PCR、Western Blot 以及免疫组化检测发现,CCR5在RA大鼠滑膜组织中高表达,这与生物信息学分析结果一致,同时也为后续利用RA大鼠模型研究CCR5具体的作用机制奠定了基础。
4 结论
本研究发现CCR5 在RA 患者中呈异常高表达水平,且参与了RA 发病,进一步的实验验证发现CCR5 在RA 大鼠滑膜组织也是高表达的,这为下一步利用RA 大鼠模型研究CCR5 的具体作用机制奠定了基础,同时也说明我们可以利用生物信息学发现RA的关键基因,并结合实验方法验证CCR5参与RA发生发展的遗传学和组织学证据,从而为后续的机制研究奠定基础,但CCR5在RA中的具体作用机制还有待进一步研究。

