超声及CT技术诊断甲状腺结节钙化与病理诊断的对照研究
上海交通大学附属第六人民医院南院(上海市奉贤区中心医院)超声科(上海 201499)
王 超*
甲状腺结节为临床高发病,部分可发生恶变。临床上仅少数甲状腺癌存在质地硬、生长迅速、伴颈部淋巴结转移等典型症状,确诊较为容易,多数缺乏典型临床表现,需通过有效的影像学检查进行鉴别[1]。研究表明,钙化是甲状腺结节的重要影像学特征,良性甲状腺结节中仅15%~35%出现钙化,而恶性甲状腺结节中出现钙化的几率高达50%~80%,可作为鉴别良恶性病灶的主要依据之一[2-3]。本研究以137例甲状腺结节拟采取手术的患者作为研究对象,比较超声及CT技术诊断甲状腺结节钙化的临床价值。
1 资料与方法
1.1 临床资料我院2016年11月至2018年11月共137例甲状腺结节拟采取手术的患者,其中男性55例,女性82例;年龄21~85岁,平均年龄(45.10±8.67)岁。
纳入标准:患者因颈部不适、肿块或体检发现甲状腺结节,经手术或穿刺活检证实甲状腺结节性病变;年龄>18岁;同意接受超声与CT检查;签署知情同意书。
排除标准:伴精神疾病者;存在沟通障碍者;无法配合检查者。
1.2 方法所有患者均于术前2周内行超声、CT检查,2种检查间隔小于1周。
1.2.1 超声检查 采用GE LOGIQ S8型彩色多普勒超声,探头频率6~13MHz,患者仰卧位,颈下垫枕,将探头置于甲状腺区进行多切面探查,观察甲状腺实质内病灶大小、形态、内部回声、衰减与钙化情况,病灶周边血流信号分布,探查颈部及锁骨上肿大淋巴结。测量收缩期峰值流速、舒张末期最低流速、阻力指数。
1.2.2 CT检查 采用西门子Somatom Emotion 6层螺旋CT机,取仰卧位,由声带水平平扫至颈根部或可延伸至上纵隔,扫描条件:130kV,0.5s/圈,0.75mm准直,螺距1.5~1.8,采集时间12~16s,FOV50.0cm。肘前静脉团注欧乃派克行增强扫描,注药速度3.0~4.0mL/s,剂量80~100mL。由2位经验丰富的专科医师独立阅片,给出诊断结果,不一致时协商确定。
1.3 统计学方法采用SPSS 19.0处理数据,计量资料用(±s)表示,比较采取t检验;计数资料采取χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 病理结果137例患者中共发现149枚甲状腺结节,其中101例(73.72%,共108枚)为恶性结节、36例(26.28%,共41枚)为良性结节。恶性结节以乳头状癌及乳头状微癌为主,此外还包括髓样癌、滤泡性癌等;良性结节以结节性甲状腺肿为主,此外还包括桥本甲状腺炎、腺瘤等。108枚恶性结节的直径为0.3~3.7cm,平均直径(1.22±0.16)cm;41枚良性结节的直径在0.2~2.9cm,平均直径(1.17±0.19)cm。恶性结节与良性结节直径的差异无统计学意义(t=1.547,P=0.124>0.05)。
2.2 典型影像学表现(1)甲状腺癌:超声图像的边界模糊,形态不规则,边缘呈“分叶”或“锯齿”状,内部可见不规则低回声,通常可见散在微钙化灶;CT平扫呈类圆形低密度灶,边缘欠清晰,可见点状微钙化,增强横轴位扫描的结节强度低于正常组织,界限模糊、边缘中断。(2)结节性甲状腺肿:超声图像的边界清晰、形态规则,内部回声不均匀增粗,部分可见粗大钙化;CT呈圆形低密度灶,边缘清晰,可见斑片状钙化。
2.3 超声、CT诊断结果分析由表1可知,149枚甲状腺结节中,超声共诊断出43枚良性结节与106枚恶性结节,CT诊断出47枚良性结节与102枚恶性结节。
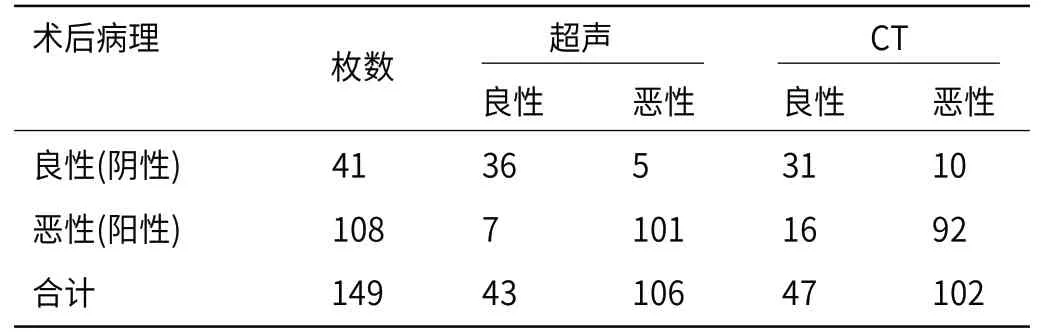
表1 超声与CT诊断结果与术后病理的对照[例]
2.4 超声与CT诊断甲状腺结节的效能比较由表2可知,超声诊断甲状腺结节的敏感度与符合率均显著高于CT(P<0.05)。

表2 超声与CT诊断甲状腺结节的效能比较[(n)%]
2.5 钙化检出率将钙化分为微钙化(≤2mm)和粗钙化(>2mm)。由表3可知,超声的恶性结节粗钙化与微钙化检出率及良性结节粗钙化检出率均显著高于CT(P<0.05)。
2.6 影像学分析患者男,48岁,甲状腺癌患者。超声平扫可见甲状腺右叶见一低回声结节,形态不规则,边界欠清晰,内部回声不均,可见点状强回声钙化(图1A),且结节呈垂直位生长,纵横比>1(图1B)。CDFI可见结节内见丰富血流信号(图1C)。CT扫描可见颈部低密度肿块,内部密度不均,边界不清,形态欠规整,气管受压,CT增强后可见肿块明显强化(图1D)。

表3 不同病变患者中超声与CT的钙化检出率比较[(n)%]
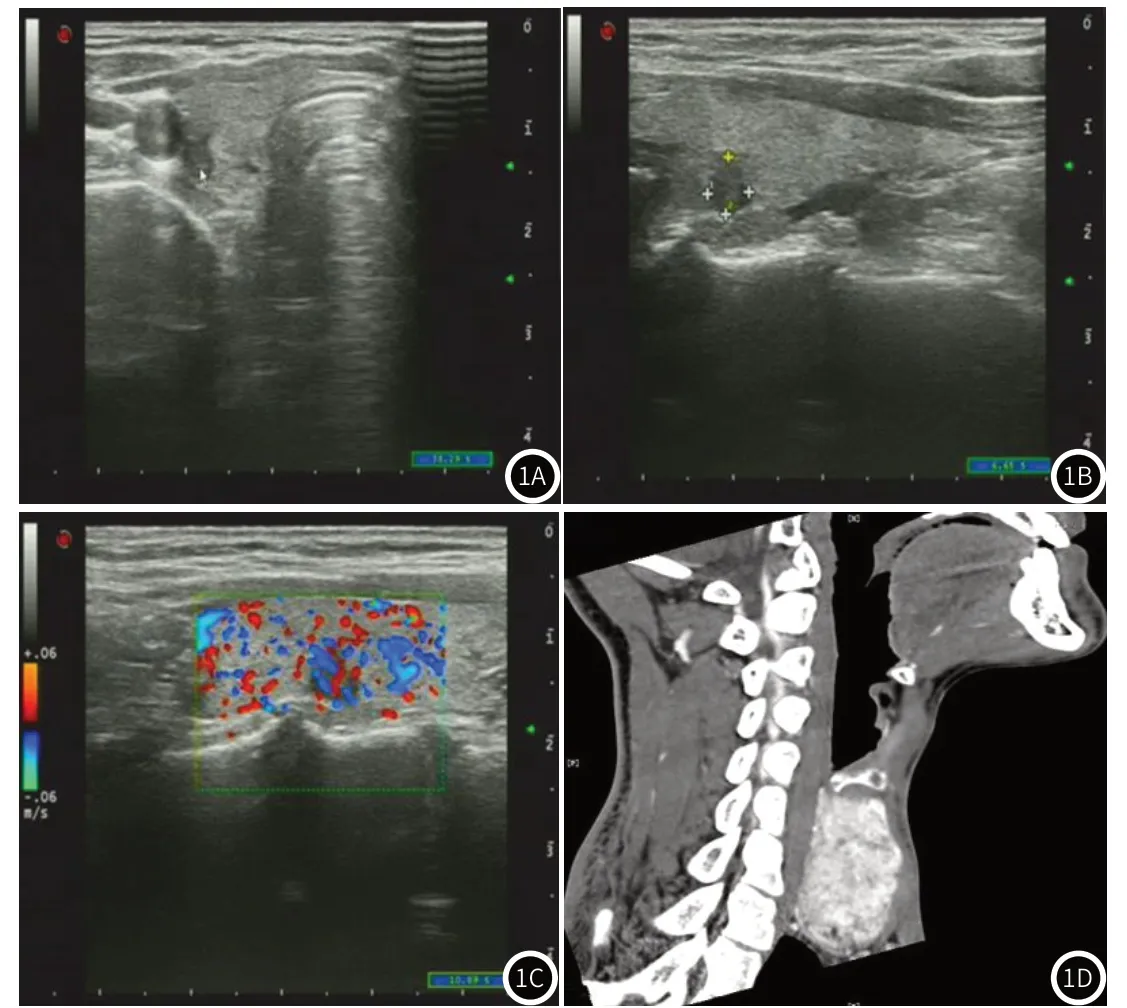
图1 患者超声与CT影像图。图1A-1B为超声图;图1C为超声CDFI;图1D为CT图。
3 讨 论
甲状腺疾病多发病隐匿,尽早发现病灶并进行鉴别对于患者治疗具有重要指导意义。本研究将超声与CT在鉴别甲状腺结节良恶性的结果进行对比,发现超声诊断甲状腺结节的敏感度与符合率均较CT相对更高,对甲状腺结节的鉴别价值更大。
多层螺旋CT可获得较高的多方位和三维重建图像质量,有利于观察甲状腺结节的大小、位置及其与周围组织关系,在甲状腺疾病的诊断中应用广泛[4]。有研究指出,螺旋CT增强扫描时对比剂的应用可能会对疾病造成一定影响,诊断结果也会受窗宽、窗位及合并其他甲状腺疾病的影响而造成漏诊或误诊[5-6]。超声具有比CT更高的空间分辨率与软组织分辨率,更有利于对钙化的观察,这是超声获得更高的敏感度与符合率的重要原因。
钙化指钙盐沉积在病灶部位,不同检测方法的甲状腺结节钙化的检出率差异较大[7]。良性结节发生钙化的原因与结节出现纤维组织增生,影响甲状腺滤泡血运,造成甲状腺出血、坏死,血肿吸收后结节发生囊性变而形成结节壁钙化[8]。恶性结节发生钙化的原因与肿瘤细胞生长快、组织过度增生造成钙盐沉积有关,也可能与肿瘤本身会分泌黏多糖、糖蛋白等致钙化物质有关[9-10]。故良性结节通常生长缓慢,钙化发生率较恶性结节大幅下降。有学者认为,超声与CT对钙化的检出能力可能与钙化成分有关[11]。钙化可分为缺乏营养性钙化与砂砾体钙化,前者多继发于组织坏死或变性,在良性与恶性结节中均可出现;后者为嗜碱性磷酸钙结构,切面呈“洋葱样”,多见于恶性结节,在结节性甲状腺肿、桥本甲状腺炎中也可出现。超声的定位和立体空间显像准确,有利于显示钙化灶解剖结构,故可获得较高的粗钙化与微钙化检出率。CT难以发现直径小于1mm的钙化,故微钙化检出率相对更低[12]。文献报道,微钙化对甲状腺结节的鉴别诊断特异性达83%~90%[13]。本研究中,超声对恶性结节微钙化的检出率达19.44%,显著高于CT(9.26%),验证了微钙化对于甲状腺结节鉴别诊断的价值。而在良性结节中,超声与CT的微钙化检出率无统计学意义,考虑与微钙化灶较少有关。报道认为,虽然甲状腺良恶性结节均可能出现钙化,但钙化灶形状、大小、分布不同[14]。良性结节的钙化多粗大,分布相对集中,呈弧状或小斑片状;恶性结节钙化多为砂粒状,散在或局限性分布,也可作为鉴别良恶性结节的参考信息。有报道指出,钙化环厚度、内部回声、周围回声声晕有助于鉴别环状钙化的良恶性[15]。但笔者认为,钙化环厚度的测量可能受到设备、操作者经验、结节深度等因素影响而出现差异,且内部回声与钙化环壁厚薄相关,故无法反映环内真实成分,所以本研究未对钙化环厚度、内部回声、周围声晕等征象进行分析。
综上,超声诊断甲状腺结节钙化的检出率及其对甲状腺结节良恶性的鉴别具有更高价值,可作为甲状腺结节诊断的首选方法。

