基于数字PCR技术的Y染色体微缺失检测方法开发
袁通阔,张红国,尹焕才,刘睿智,殷 建
(1.上海大学生命科学学院,中国 上海 200444;2.中国科学院苏州生物医学工程技术研究所,中国 苏州 215163;3.吉林大学白求恩第一医院,中国 长春 130021)
由于环境恶化、晚婚晚育以及工作压力的日益增大,我国男性不育症的比例不断上升[1]。据《2015—2017年中国不孕不育医院行业现状研究分析及市场前景预测报告》显示,我国男性不育症患者数量已达1 200万,这些患者亟需病因分析及针对性治疗。Y染色体微缺失是15%以上男性不育症的主要来源,其引发的原发性无精子和少精子症不仅难以治愈,且可随辅助生殖技术传递给下一代,进而引发新的不育症,因而受到研究者及临床医生的日益关注[2]。
Y染色体微缺失主要指染色体长臂上的无精子因子(azoospermia factor,AZF)区域的缺失[3]。AZF区可分为3个区域,即AZFa,AZFb及AZFc区[4],每个区域都包含几个调控精子形成的关键基因,这些基因的缺失或突变均可能导致少精或无精[5,6]。其中,AZFa区域的缺失几率较低,但其丧失将导致绝对无精子症,因此AZFa区域缺失的患者不建议做单精子胞浆内注射手术(intracytoplasmic sperm injection,ICSI)[7]。AZFb区域缺失的患者表现为生精阻滞,精子生成被阻滞在精母细胞阶段,导致没有精子生成,患者即使进行睾丸穿刺也不能获得精子,因此对于该类患者不建议做 ICSI[8]。AZFc区缺失较为常见,是精子形成障碍的重要原因之一[9-11]。AZFc区域缺失的患者尚存精子生成能力,因此可以通过辅助生育手段进行治疗,这一治疗会将AZFc区域缺失遗传给男性后代[12]。可见,Y染色体微缺失检测对男性在生殖遗传学方面的临床治疗、提高辅助生殖的疗效和安全性以及开展胚胎植入前的遗传学诊断均具有重要意义[13]。
经过长期探索,欧洲男科协会(European Academy of Andrology,EAA)和欧洲分子遗传质量协作网(European Molecular Genetics Quality Network,EMQN)联合发布了Y染色体微缺失的检测指南[14]。指南建议,临床医生可通过对AZFa,AZFb和AZFc 3个区域的sY84,sY86,sY127,sY134,sY254和sY255共6个序列标签位点(sequence tagged site,STS)进行多重PCR凝胶电泳或者荧光定量PCR(qPCR)检测,进而诊断3个区域微缺失的状况。2015 年我国男性生殖遗传学检查专家达成共识,建议对非梗阻性无精子症以及严重的少精子症患者进行Y染色体微缺失检测[15],并延用了欧洲男科协会指南中的方法[16-18]。但这些方法仍存在问题,其中凝胶电泳检测灵敏度不足且易受干扰;qPCR准确度较高,但其结果依赖于阈值范围内的主观判断,因此当临床样本中DNA质量较差及条件非优化的情况下,可能出现假阴性,这一缺陷在DNA病毒及其他检测中极为常见[19]。与此同时,Y染色体微缺失仅为约15%的男性不育症来源,对于多数患者而言,其病因依然未知[20]。随着男性不育症遗传因素研究的深入,miRNA[21]、游离DNA[22]、DNA甲基化[23]及融合突变[24]等均被发现与男性不育症相关,但尚未建立统一的标准和检测方法。除此之外,这些新的因素往往丰度较低,不易检测,因此更需要灵敏且准确度高的检测方法。
数字PCR(digital PCR, dPCR)技术是在20世纪末,由Vogelstein等人提出的一种高灵敏度的核酸检测方法[25]。其通过将一个PCR反应分配到多个微小的反应微滴当中,使每个微滴中包含一个或多个拷贝的DNA模板,从而实现单分子条件下的PCR扩增。扩增结束后,通过计算阳性与阴性的微滴个数比例进行统计学分析[26]。与其他分子检测技术相比,dPCR具有灵敏度高、特异性强、样本需量低以及成本与qPCR相似的优势[27]。然而,该技术是否能够用于Y染色体微缺失和其他辅助生殖相关的检测尚有待于验证。
有鉴于此,本文拟以dPCR技术为基础,开发Y染色体微缺失的新型检测方法并进行优化。通过与医院已知缺失类型的临床样本进行对比,验证dPCR方法的灵敏度与准确性,据此考察dPCR技术在生殖健康领域的应用可行性,并为下一步新型临床检测方案的开发奠定基础。
1 材料与方法
1.1 主要试剂
Y染色体微缺失检测试剂盒(PCR荧光探针法;PG07001Y4,透景生命科技股份有限公司);TB Green-qPCR试剂盒(RR820A,TaKaRa公司);QX200 dPCR EvaGreen染料法预混液(186-4033)和QX200 染料法微滴生成油(186-4006)购自BIO-RAD公司;去离子水(A500197-0500)、6×载样缓冲液(B540084)及DNA分子标准Maker S(B610003)购自生工生物工程(上海)股份有限公司。
1.2 DNA检测
已知Y染色体微缺失类型的DNA标准品由透景公司提供,并已通过透景试剂盒验证其缺失类型。DNA浓度采用Nanodrop 2000(Thermo Fisher Scientific公司,美国)进行检测(表1),之后将样本稀释至10 mg·L-1,于-80 ℃保存备用。
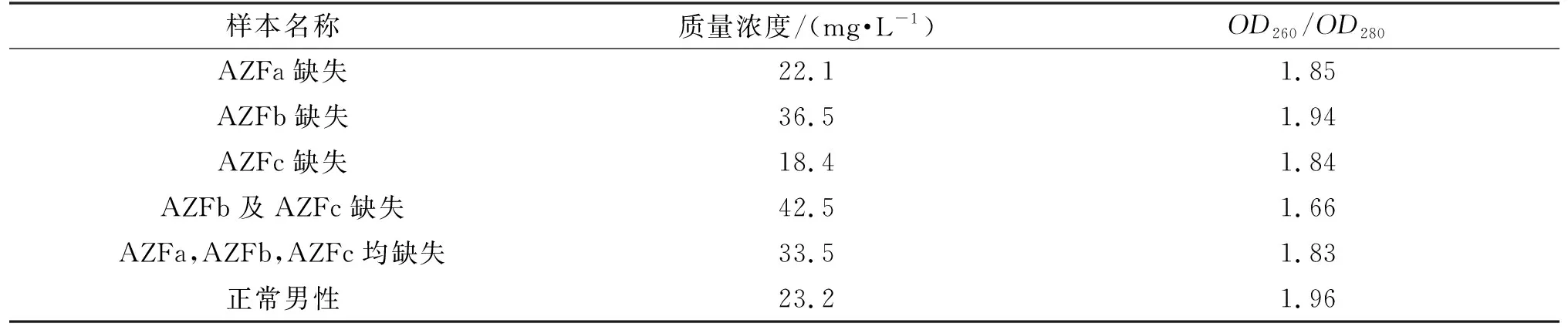
表1 6例样本浓度及其260 nm吸光度(optical density,OD260)/OD280值
1.3 引物选择及验证
1.3.1 引物选择 所采用引物见表2,获自欧洲男科协会发布的Y染色体微缺失检测指南。
1.3.2 引物验证 采用TB Green-qPCR试剂盒对正常男性DNA样本和AZF全缺失的男性DNA样本进行检测,验证引物有效性。首先,配置PCR反应体系,包括TB Green 预混液(2×)10 μL、PCR 正向引物(10 μmol·L-1)和PCR 反向引物(10 μmol·L-1)各0.8 μL、ROX 染料(50×)0.4 μL、DNA模板2 μL及双蒸水6 μL。之后置于ABI 7500 PCR仪(Applied Biosystems 公司,美国)中进行扩增和PCR检测。其程序设置为:95 ℃ 30 s;95 ℃ 5 s;60 ℃ 34 s(32个循环)。

表2 引物序列表
1.4 试剂盒性能测试
1.4.1 检测限对比 由于市售透景试剂盒的推荐样本质量浓度为10 mg·L-1,笔者将正常男性与AZF全缺失病人DNA样本用去离子水梯度稀释至10,1,0.1,0.01 mg·L-1,分别采用透景试剂盒及dPCR试剂盒进行检测,确定其各自的检测限。透景试剂盒PCR操作流程如1.3.2。dPCR反应体系为:QX200 dPCR EvaGreen染料法预混液 10 μL;正向引物(10 μmol·L-1) 0.4 μL;反向引物(10 μmol·L-1) 0.4 μL;DNA模板 2 μL;加去离子水补齐至20 μL。反应体系震荡混匀后加入到微滴生成板中间,每孔20 μL,加入过程中避免气泡产生。微滴生成板底部孔中加入70 μL微滴生成油后,用微滴生成仪(QX200,BIO-RAD公司,美国)生成微滴,缓慢取出微滴至PCR反应管中,在PCR扩增仪(Mastercycler nexus,Eppendorf公司,美国)中扩增,程序如下:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 1 min(32个循环),4 ℃ 5 min;90 ℃ 5 min;4 ℃保温。扩增结束后使用微滴读数仪(QX200,BIO-RAD公司,美国)进行检测。
1.4.2 准确性检测 对模板为0.1 mg·L-1的不同缺失类型临床样本(经透景试剂盒验证,具体结果不列出),应用dPCR试剂盒进行检测,流程同1.4.1。
1.5 引物二聚体检测
由于在应用dPCR进行检测的过程中,sY84及sY255样本出现了假阳性,为此对扩增后的产物进行1%琼脂糖凝胶电泳检测。具体过程为:取5 μL 反应产物与1 μL 6×载样缓冲液混匀后上样,120 V电压下电泳25 min。之后,采用凝胶成像系统(Universal Hood Ⅱ,BIO-RAD公司,美国)拍照。
1.6 退火温度优化
为减少二聚体的生成,针对sY84和sY255位点,测定不同退火温度对反应体系的影响,在同一实验条件下,分别采用56,58,60,62 ℃的退火温度进行PCR扩增,其余操作及循环步骤同1.4.1。
1.7 临床样本的检测
为进一步确定dPCR检测方法的准确性,对吉林大学白求恩第一医院生殖中心提供的已知缺失类型和正常男性的临床样本27例进行检测,检测方法同1.4.1。
1.8 统计学方法
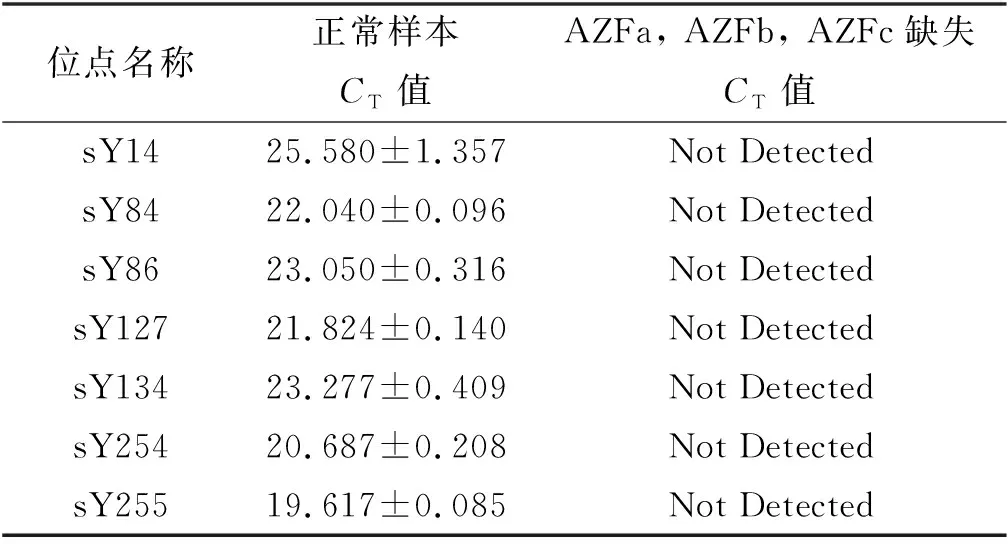
表3 qPCR试剂盒检测结果
本文中的结果均为3次不同批次样品结果的平均值(n=3),采用SPSS 14.0软件进行数据处理。采用方差分析法比较每组间的结果,LSD法进一步对比。P<0.05为差异有统计学意义。
2 结果
2.1 引物验证
应用Y染色体微缺失的检测指南推荐引物,对正常男性DNA样本和AZFa, AZFb及AZFc全缺失的男性DNA样本进行检测。结果显示,正常男性的DNA样本可正常检测到6个位点的基因表达,而全缺失的DNA样本无法检测到任何基因表达(表3),表明引物可用。
2.2 qPCR检测限的测定
采用透景试剂盒,笔者对梯度浓度的正常男性DNA样本进行检测。如图1所示,随着样本DNA浓度的下降,目的基因的CT值增加。当模板DNA质量浓度降至0.1 mg·L-1以下时,没有明显的荧光曲线变化。因此可知,qPCR检测下限为1 mg·L-1。
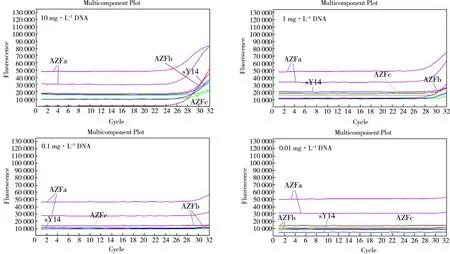
图1 qPCR检测正常男性DNA样本结果
2.3 dPCR检测限测定
同样浓度的正常男性DNA样本采用dPCR试剂盒进行检测,结果表明,质量浓度为0.01 mg·L-1时,sY14和sY134位点没有检测到阳性值(如图2所示),即dPCR检测Y染色体微缺失的最低样本浓度为0.1 mg·L-1。可见,dPCR较qPCR 具有更高的灵敏度。
2.4 假阳性检测结果
在应用同样的引物及数字PCR技术进行全缺失样本(样本DNA为0.1 mg·L-1)检测时,sY84和sY255位点出现了假阳性(如图3)。对扩增后的全缺失样本产物进行琼脂糖凝胶电泳检测,结果显示,条带大小均为50 bp左右(如图4)。鉴于条带较宽及微弱,且溶解曲线峰出现于80 ℃前,推测其可能为引物二聚体,并由于太小而易于在高温下降解[28]。
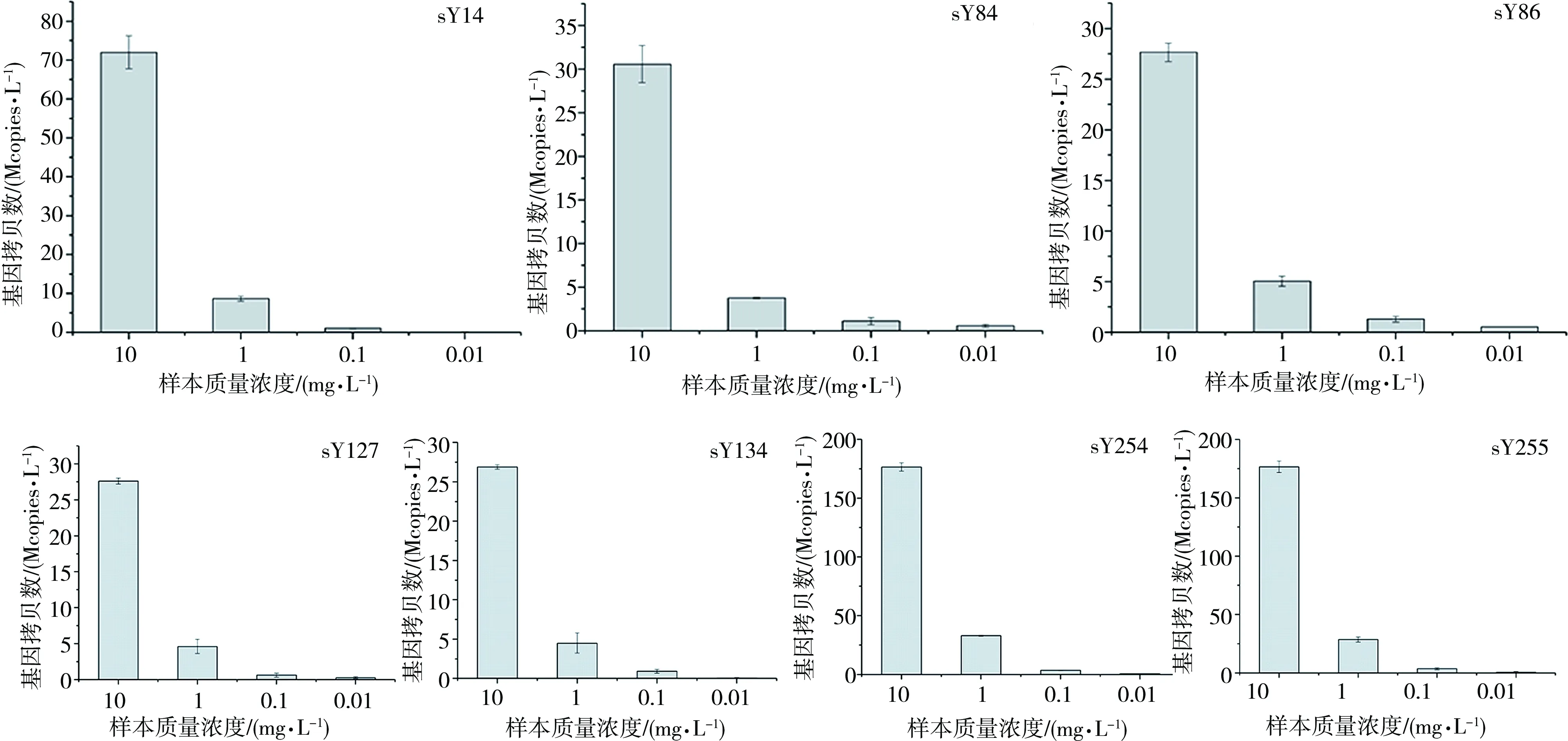
图2 sY14,sY84,sY86,sY127, sY134, sY254及sY255位点的梯度检测结果Fig. 2 Detection of sY14, sY84, sY86, sY127, sY134, sY254 and sY255 locus with gradient concentrations
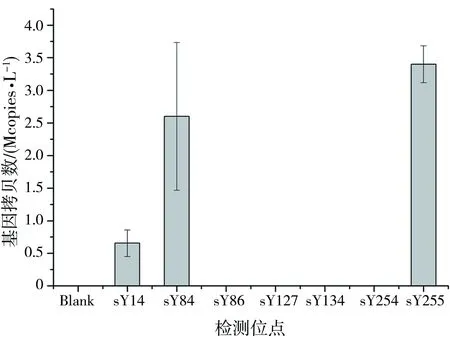
图3 dPCR检测AZF全缺失男性DNA样本的结果 Fig. 3 dPCR results of DNA samples from males with completely lost AZF
2.5 退火温度优化
为消除引物二聚体的影响,针对sY84和sY255引物进行退火温度优化。结果显示sY84引物的最佳退火温度为58 ℃;sY255引物的最佳退火温度为62 ℃(如图5)。在该温度下检测可有效消除假阳性结果。
2.6 不同缺失类型临床样本测试
应用不同缺失类型及正常男性的临床样本进行dPCR检测,结果如图6所示,检测结果与医院提供的qPCR检测结果一致。笔者又对吉林大学白求恩第一医院生殖中心的27例已经确认缺失类型的临床样本进行测试,结果如表4,检测结果与已知样本缺失一致,证明方法开发成功。
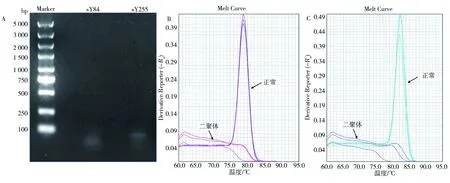
图4 全缺失样本经扩增后的琼脂糖凝胶电泳图(A)及扩增过程中的熔解曲线的正常溶解曲线和二聚体溶解曲线对比(B: sY84;C: sY255)Fig. 4 Agarose gel electrophoresis detection of samples with completely-deleted AZF zone after amplification and the melting curve during amplification
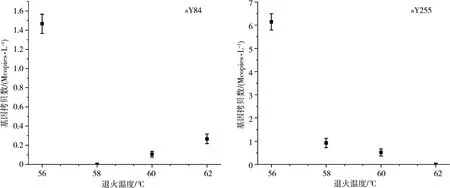
图5 sY84和sY255位点的退火温度优化结果Fig. 5 Results of annealing temperature optimization at sY84 and sY255 site
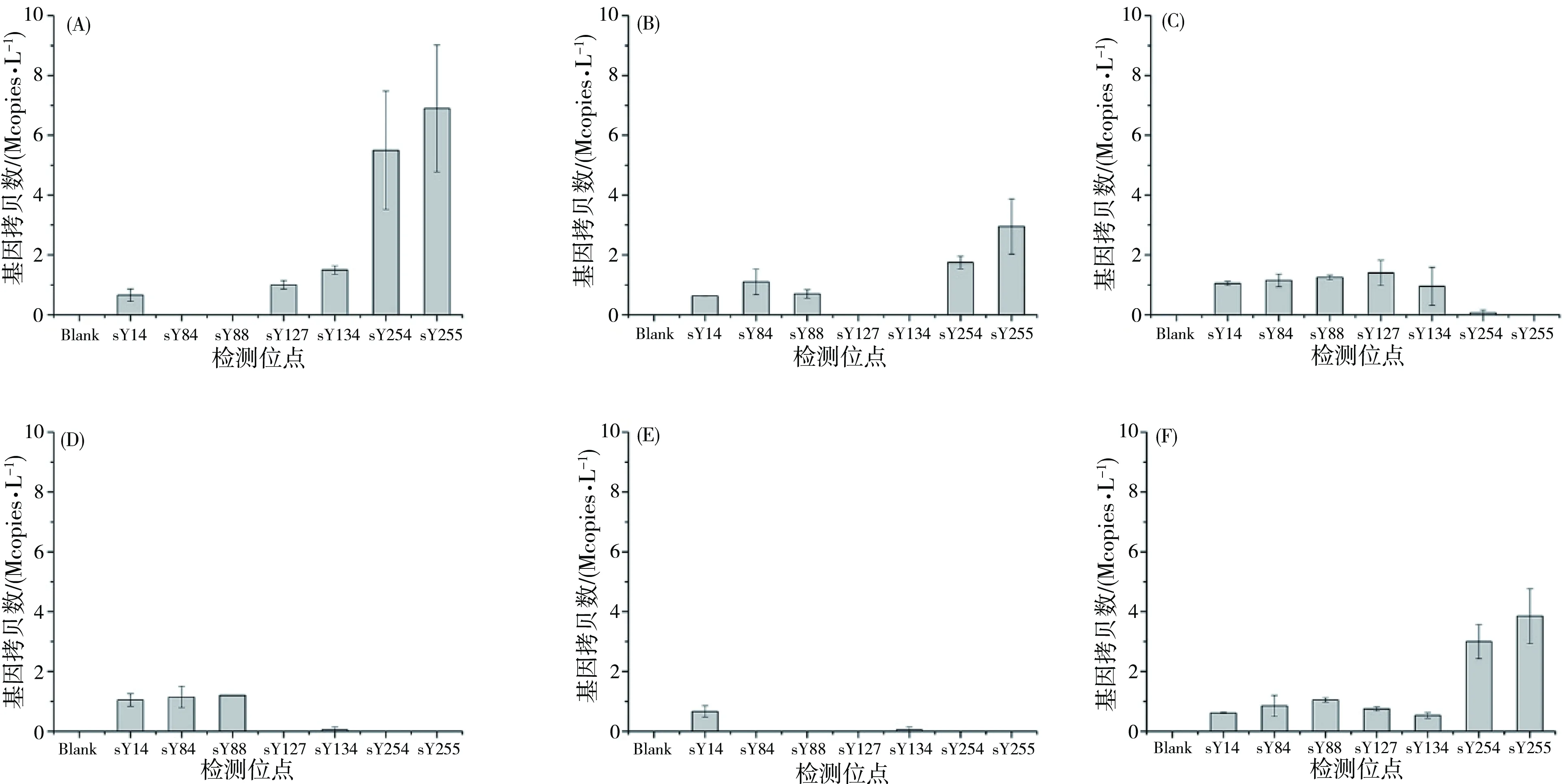
图6 dPCR检测结果:AZFa位点缺失(A);AZFb位点缺失(B);AZFc位点缺失(C);AZFb和AZFc位点缺失(D);AZFa, AZFb及AZFc位点全缺失(E);正常男性样本(F)Fig. 6 Results of dPCR detection: AZFa site missing(A); AZFb site missing(B); AZFc site missing(C); Both AZFb and AZFc site missing(D); AZFa, AZFb and AZFc site completely missing(E); Normal male sample(F)
2.7 低丰度临床样本检测
在检测过程中,笔者发现一例AZFc区域原始拷贝数远低于AZFa和AZFb的DNA样本,这可能是由于DNA提取质量较差。分别采用dPCR技术与透景试剂盒对其进行检测,检测结果如图7所示,AZFc区域的CT值已接近试剂盒给出的阈值(32),因而给病情诊断带来了不便。相对而言,dPCR精确地给出了该区域的原始拷贝数,可很好地用于判断Y染色体是否缺失。
3 讨论
当今社会,随着生殖疾病的日趋严重及人民群众对生殖健康关注度的上升,临床上对于生殖健康领域的遗传因素分析及检测技术开发日益增强。dPCR作为一种绝对定量、灵敏度高且成本较低的检测技术,已被广泛用于科学研究中[29-31],但其在临床上,特别是生殖健康及辅助生殖领域中的应用仍较为少见。有鉴于此,本文以男性不育症检测中常用的Y染色体微缺失为检测目标,验证dPCR技术在相关领域中应用的可行性。
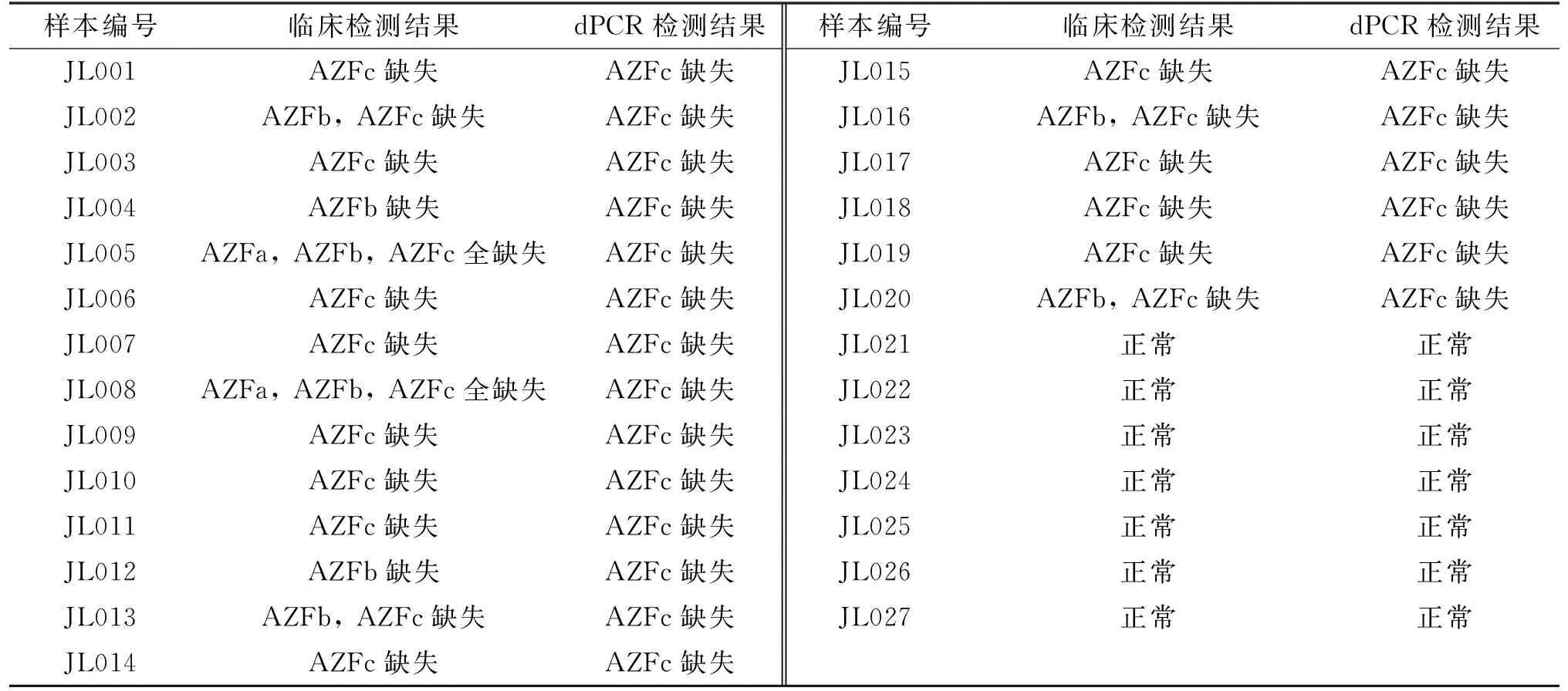
表4 临床样本检测结果
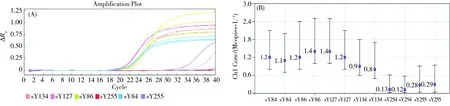
图7 AZFc原始拷贝数较低样本的qPCR(A)及dPCR(B)检测结果Fig. 7 qPCR (A) and dPCR (B) results of a sample with low copy numbers of AZFc
本实验结果表明,dPCR技术可用于Y染色体微缺失检测,准确度与qPCR相当,且其灵敏度最低可达到0.1 mg·L-1,为qPCR的1/10,这一结果与文献报道一致,表明dPCR在低丰度样本检测中的可行性[32]。Y染色体微缺失的检测方法经长期探索已较为成熟,并依赖于qPCR技术及PCR电泳技术,但这两种方法的结果分析主观性较强。当临床样本质量较差、受到污染或PCR条件非最优时,可能出现漏检情况(如图7)。在此情况下,dPCR因其检测灵敏度高、分析过程自动化程度高、荧光信号结果判定简单,减少了因人工操作产生的误差和交叉污染,具有良好的应用前景[33]。但本文实验结果也表明,数字PCR技术的高灵敏性也可能导致微小误差的放大,因此不能直接沿用qPCR条件,仍需进行具体分析及优化。
进一步地,约30%的男性不育症患者是由遗传因素造成的,但Y染色体缺失仅为这些遗传因素中的一部分,这意味着大多数患者都无法获得明确的诊断,因而导致药物无效及反复治疗。有鉴于此,研究者针对可能与男性不育症相关的遗传信息进行研究,并发现为数众多的遗传因素,包括DNA甲基化、外周血游离DNA、miRNA以及嵌合型突变等多种因素均可能与男性不育症相关。但这些因素往往丰度较低,且易于受到污染,因此到目前为止,尚未有除Y染色体微缺失之外的检测指标进入临床。这一方面说明临床上的理论研究仍不足;另一方面也说明有待于开发更灵敏及准确的检测方法。基因测序及基因芯片等技术已被用于新靶点筛选及检测,并被证明其准确性与灵敏度高于现有的qPCR技术[34,35],然而由于成本较高,不适于临床检测。有鉴于此,具有与上述方法灵敏度相当但成本显著降低的dPCR技术具有更大的应用前景。
随着男性不育症问题的加剧,对其进行遗传学检测从而揭示病因及确定疗法成为个性化治疗的必需。因此,基于dPCR技术,开发新的检测位点与方法,并建立与临床病症的相关性,将成为辅助生殖领域的重要支撑技术。

