集成MRI技术对早产儿脑成熟评估研究
赵彩雯,赵鑫,刘彦超,邢庆娜,张小安
近年来,早产儿严重脑白质损伤发生率明显减少。然而,早产儿大脑不成熟,极易受到围产期高危因素影响,这些损伤可能与日后认知、语言、社会交流等落后有关[1-3]。因此早期识别高风险患儿及时干预至关重要。已知早产儿在纠正足月龄时MRI表现与长期神经发育结果有关[4-5]。常规MRI 序列定性评估大脑发育,其信号强度不能用于与正常参考值比较或后续研究[6]。集成MRI技术不仅能提供常规影像学诊断所需要的图像,还可以提供定量值用于早期发现异常成熟和疾病状况[7-9]。有研究提供了从新生儿到青少年T1、T2、质子密度(proton desity,PD)年龄特异的区域参考值[8]。但关于早产儿的相关研究较少。本研究旨在探讨集成MRI技术所获取的纠正足月龄时弛豫值对早产儿脑成熟评估的可行性和应用价值。
1 资料与方法
1.1 研究对象
选取2020 年5 月到2021 年3 月在郑州大学第三附属医院成功完成常规MRI 和MAGiC 检查的新生儿,包括早产儿31 例,足月儿40 例。纳入标准[10]为:(1)临床标准:①无缺氧缺血性脑病、先天感染、先天代谢性疾病、颅脑畸形;②在后期随访中未出现明显神经系统症状和体征;(2)影像标准:①新生儿脑常规MRI检查没有异常;②无明显运动伪影。31例早产儿出生时胎龄为(29+1~36+6) (34.5±2.2)周,体质量为(1.2~3.7) (2.3±0.6) kg;40 例足月儿出生胎龄为(37+0~41+1) (38.6±1.1)周,出生体质量为(2.5~5.2) (3.4±0.6) kg;两组核磁检查时纠正胎龄(postmenstrual age,PMA)为37~45 周,两组新生儿PMA、性别、5 min Apgar评分及双胎占比差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准(批准文号:2021-075-01),监护人均已签署知情同意书。
1.2 MR图像采集
为减少头动以顺利完成检查,在扫描前15~30 min 口服水合氯醛或灌肠(20~30 mg/kg)镇静。新生儿入睡后包裹在襁褓中放置在MRI扫描床上,检查过程中,注意听力保护及保暖。采用GE SIGNA Pioneer 3.0 T MRI 扫描仪,扫描野包括整个大脑。常规轴位T1WI、T2WI、矢状位T1WI和弥散加权成像扫描,MAGiC 扫描序列:TR 4266 ms,TE 19.4/97.1 ms,接收带宽25 Hz/像素,FOV=20 cm×20 cm;矩阵=288×224,层数22,层厚4 mm,层间距1 mm,总扫描时间为4 min 16 s。
1.3 定量值测量
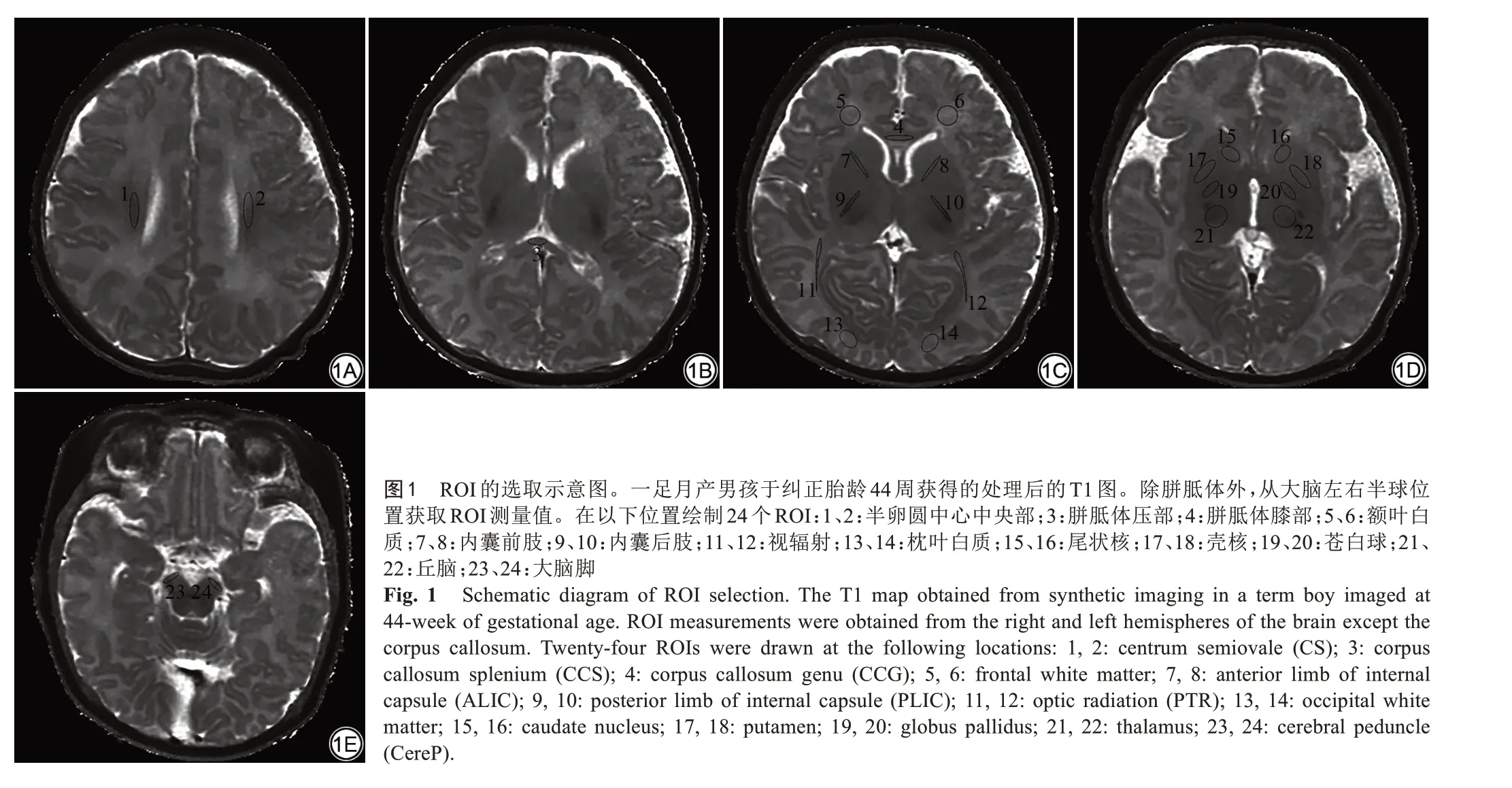
将扫描数据导入后处理软件SyMRI 8.0(SyntheticMR,Linköping,Sweden)自动计算得到T1、T2、PD图,并在ITK-SNAP软件(3.8.0,Windows自助安装包,64位)测量。手动勾画ROI如图1:①白质:内囊后肢(posterior limb of internal capsule,PLIC);内囊前肢(anterior limb of internal capsule,ALIC);大脑脚(cerebral peduncle,CereP);半卵圆中心中央部(centrum semiovale,CS);胼胝体压部(splenium of the corpus callosum,SCC);胼胝体膝部(genu of the corpus callosum,GCC);视辐射(optic radiation,PTR);枕叶白质;额叶白质;②深部灰质:丘脑、苍白球、壳核、尾状核。ROI 均放置在双侧大脑对称部位的解剖位置中心,其大小根据不同解剖位置调整(10±2) mm2,每个位置测量3 次取平均值,以上工作由两名影像科医生协商完成。
1.4 统计学分析
采用SPSS 26.0 及GraphPad Prism 8.0 对数据进行统计学分析。计量资料采用平均值±标准差表示。早产儿与足月儿T1、T2 值组间差异采用两独立样本Mann-WhitneyU检验,按照公式“相对变化量=100%×(早产儿定量值-足月儿定量值)/足月儿定量值”,计算T1、T2弛豫值相对变化量。控制出生孕周,运用偏相关分析分别计算早产儿与足月儿T1、T2、PD值与MR 扫描时PMA 相关性。以P<0.05 为差异有统计学意义。P<0.001 表示差异有非常显著统计学意义。
2 结果
2.1 不同区域的T1、T2、PD值
早产儿及足月儿各白质区及深部灰质T1、T2、PD值不同。内囊及胼胝体(PLIC、SCC) T1、T2 值后部分别明显短于前部(ALIC、GCC),位于中央位置的投射纤维(PLIC、CS、CereP)及连合纤维(GCC、SCC)比周围白质显示更短的T1、T2 值(P均<0.05)。生后早期深部灰质核团T1、T2值相对白质短,丘脑和苍白球较靠前外侧的壳核和尾状核T1、T2 值更短(P均<0.05),见表1及图2、3。

表1 早产儿各ROⅠT1、T2、PD值与PMA偏相关系数(n=31)Tab.1 Partial correlation coefficients between relaxation values and PMA for all selected ROⅠs in the preterm infants(n=31)

图2 早产儿和足月儿各ROⅠ的T1值比较。注:*:P<0.05,两组比较差异有统计学意义;**:P<0.001,两组比较差异有非常显著统计学意义Fig. 2 Comparison of T1 values between preterm infants and term infants in all ROⅠs.Note:*:P<0.05;**:P<0.001.
2.2 T1、T2、PD值与PMA相关性
早产儿大多数白质区域和深部灰质核团T1、T2弛豫时间随PMA增加下降。早产儿白质区域,PLIC的T1、T2 值与PMA 相关性最强(r=-0.695,r=-0.807,P均<0.001);早产儿深部灰质,丘脑T1、T2 值与PMA相关性最强(r=-0.712,r=-0.795,P均<0.001)。足月儿存在相似发育趋势,但与早产儿相比,同一区域相关系数减低。足月儿白质区域,PLIC T1、T2 值与PMA 相关性最强(r=-0.547,r=-0.742,P均<0.001);足月儿深部灰质,丘脑T1、T2 值与PMA 相关性最好(r=-0.256,r=-0.719,P均<0.001),见表2、3。
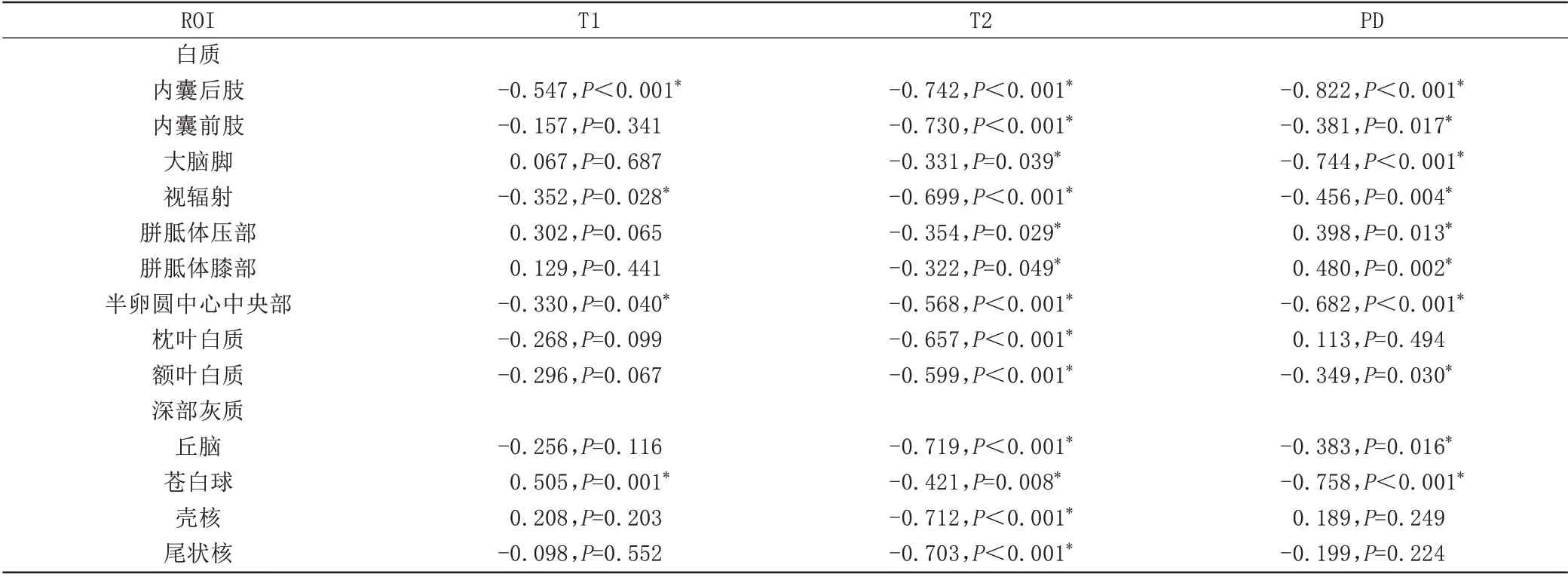
表2 足月儿各ROⅠT1、T2、PD值与PMA偏相关系数(n=40)Tab.2 Partial correlation coefficients between relaxation values and PMA for all selected ROⅠs in the term infants(n=40)
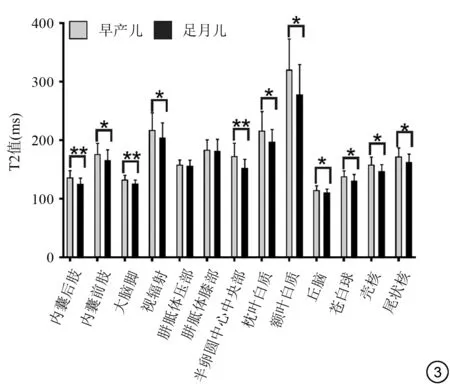
图3 早产儿和足月儿各ROⅠ的T2值比较。注:*:P<0.05,两组比较差异有统计学意义;**:P<0.001,两组比较差异有非常显著统计学意义Fig.3 Comparison of T2 values between preterm infants and term infants in all ROⅠs.Note:*:P<0.05;**:P<0.001.

表3 早产儿和足月儿各ROⅠT1、T2值比较Tab.3 Comparison of relaxation values between the preterm and term groups
2.3 T1、T2值组间比较
白质区域,早产儿PLIC、ALIC、CST、PTR CS、额叶白质及枕叶白质T1、T2弛豫时间较足月儿延长(P均<0.05)。深部灰质区域,丘脑、苍白球、壳核、尾状核T1、T2弛豫值均长于足月儿(P均<0.05)。早产儿与足月儿T1、T2 相对变化量在PLIC (T1△=11.82%,T2△=8.26%,P均<0.001) 及CS (T1△=11.57%,T2 △=13.29%,P均<0.001)最显著,见表1。
3 讨论
本研究应用集成MRI技术对纠正足月龄早产儿和足月儿弛豫参数分析,比较脑内不同部位T1、T2、PD值及与年龄相关性,比较早产儿和足月儿弛豫值差异。结果发现集成MRI技术T1、T2弛豫值可识别区域大脑发育的时-空轨迹,显示早产儿与足月儿早期脑发育的细微差异,是评估早产儿脑成熟度的有价值指标。
3.1 不同脑区成熟度差异
本研究发现分别在内囊、胼胝体和脑叶,T1、T2弛豫时间从后向前逐渐延长,位于中央的PLIC、CS及靠下的CereP 比周围白质显示更短的T1、T2 值。大脑成熟基本规律为从后到前、自下而上、由中央到四周[11,12]。本研究结果与大脑成熟空间规律一致。同时本研究发现位于端脑中央的PLIC 的T1、T2 值最低,处于此时期最高发育水平。既往DTI 研究发现,各向异性分数值在SCC最高,并不是髓鞘发育更加成熟的PLIC[13]。而本研究中PLIC 的T1、T2 值最低,更加符合实际白质发育规律。深部灰质核团T1、T2 值较白质普遍低,反映其在新生儿期较白质更成熟,其中位于中央的丘脑和苍白球的T1、T2值更低。
3.2 不同脑区发育速度差异
关于极早产新生儿的研究发现,纠正足月龄时大脑成熟与T1 和T2 弛豫时间的线性下降有关[14,15]。本研究也发现早产儿大多数白质区域T1、T2值与PMA呈明显负相关;足月儿存在相似发育趋势,但与早产儿相比,同一区域相关系数减低,这可能表明:早产儿由于早期暴露于宫外环境加速了早期脑发育[16]。PLIC T1、T2 值与PMA 的相关性最强,这表明纠正足月龄时期PLIC 正经历快速发育,可通过弛豫值变化加以量化。T1、T2 值缩短与髓鞘成熟及脑内水分减少有关,然而两者时间进程不同,可以区分出两种不同机制:水分子区室化变化及蛋白质和脂质含量增加[17-18]。T1缩短在“预髓鞘化”阶段已经发生,T2缩短与髓鞘的化学成熟相关,在大脑成熟的高级阶段更明显[19]。与T1、T2 值相比,PD 对新生儿脑成熟的显示不太明确。本研究中早产儿PD 值只在发育相对成熟的PLIC、CS及大脑脚发现了相关性,推测与T1、T2 相比,PD 缩短发生的可能更晚、更慢[20]。深部灰质核团中丘脑T1、T2值与PMA相关性最强,推测弛豫时间缩短可能较少地反映了髓鞘化的进程,而与神经细胞发育、突触及树突快速增殖和顺磁性物质如铁的积累有关[21]。
3.3 早产儿与足月儿脑成熟差异
本研究发现早产儿PLIC、ALIC、CereP、PTR、CS、额枕叶白质T1、T2 弛豫时间较足月儿延长,差异在PLIC 和CS 最明显。之前的DTI 研究也发现纠正足月龄时可在早产儿大脑中检测到髓鞘形成延迟[13,22]。近期有研究表明SyMRI 检测早产儿髓鞘形成延迟优于常规序列[23]。差异最显著的PLIC和CS在足月时期已经有部分髓鞘形成,推测这些早期和快速形成的髓鞘在生后早期最容易受到损伤,而对这些形成成熟髓鞘的少突胶质细胞前体的破坏和随后的成熟障碍可能在真正的髓鞘形成时才变得更加明显。Vanderhasselt 等[14]的近期研究也发现患有严重生后疾病的新生儿局部组织弛豫时间延长,在PLIC 和CS最显著,且其预测高危状态的准确性最高。
本研究局限性在于:(1)由于目前只有少数研究评估了SyMRI脑分割算法在新生儿的适用性,本研究未纳入脑体积分割结果及髓鞘分数,后期会深入研究;(2)样本量较小,在后续研究中将进一步扩大样本量,提高可信度;(3)弛豫定量分析存在其局限性,后期会同时运用其他技术手段(如扩散峰度成像),组合比较这些参数,了解各参数的敏感机制,细化研究脑发育。(4)另一个关键后续步骤是研究在纠正足月时存在的早产儿大脑微观结构差异是否与长期神经发育结果有关。
综上所述,集成磁共振成像技术获取的T1、T2弛豫值与髓鞘发育程度密切相关,可以识别区域大脑发育的时-空轨迹,并显示早产儿与足月儿早期脑发育的细微差异,是评估脑成熟度的有价值指标,可以考虑作为定量影像标记物早期发现异常脑成熟和疾病状况,指导早期干预以减少神经发育障碍。
作者利益冲突声明:全体作者均声明无利益冲突。

