不同大孔树脂苦荞黄酮富集品中4种主要黄酮的定量检测
李姝 ,王松涛,吴萌萌,邵华武,赵建,焦威*
1. 中国科学院成都生物研究所(成都 610041);2. 泸州品创科技有限公司(泸州 646000);3. 四川大学生命科学学院资源微生物学及生物技术教育部重点实验室(成都 610064)
苦荞麦俗称苦荞(Fagopyrum tataricum(L.)Gaertn.),学名鞑靼荞麦,属双子叶蓼科荞麦属[1]。苦荞在我国种植历史悠久,其味苦、性平寒,具有活气血、续精神、实肠胃等功效,是少有的亦食亦药粮食作物[2]。我国是苦荞的发源地,也是苦荞的主产国之一,苦荞在我国的山西、内蒙古、陕西、江西、云南、贵州、四川等地均有分布,特别是在西南地区有大面积种植[3]。近年来已有研究表明,黄酮类物质是苦荞中最重要的生物活性物质,其具有降三高、抑菌、抗炎、抗氧化、抗癌、缓解动脉粥样硬化、预防老年痴呆等多种生理功能[4-10]。
苦荞中的活性黄酮类化合物主要包含芦丁、槲皮素和山柰酚等[11-12]。苦荞种子不同部位黄酮类化合物含量差异较大,其中以苦荞麸皮中黄酮类化合物的含量最高,是苦荞类食品加工中具有利用价值的副产物[13-14]。王军[15]研究发现采用乙醇热回流法、微波辅助法、超声波辅助法分别提取苦荞麸皮总黄酮,得率均在5%~6%之间。由于仅采用溶剂提取法获得的提取物中黄酮含量较低,效率较差,为获得较高含量的苦荞麸皮黄酮富集品,进一步纯化加工显得尤为重要。鉴于食品安全生产对于溶剂、方法的限制,黄酮类物质的精制方法主要包括沉淀法、逆流色谱法、层析法、大孔树脂法等。其中,大孔树脂法以其价格低廉、吸附容量大、可反复使用、可应用于食品、药品生产等优点成为实验室以及规模化生产中最常用有效的纯化方法[16]。而HPLC法以其分离效果好、分析时间短、样品量少等特点成为最适用于黄酮类物质检测的方法[17]。目前,利用HPLC法同时测定经不同大孔树脂富集的苦荞麸皮精提物中多种黄酮成分的文献尚未见报道。
此次试验拟通过3种大孔树脂纯化获得苦荞麸皮黄酮富集品,并采用HPLC建立同时测定苦荞麸皮富集品中4种黄酮类物质的分析方法,用于黄酮类成分的含量测定,以期为苦荞提取物的食品生产利用及质量控制提供参考。
1 材料与方法
1.1 仪器与材料
LC-16型高效液相色谱仪(日本岛津公司);SHZ-DIII循环水式多用真空泵(巩义市科华仪器设备有限公司);YRE-301旋转蒸发器(巩义市予华仪器有限责任公司);HZK-FA210万分之一电子分析天平(福州华志科学仪器有限公司);DF-101S集热式恒温加热磁力搅拌器(郑州汇成科工贸有限公司);PCWJ-10超纯水系统(成都品成科技有限公司);净品级ADS-7、AB-8、D101型大孔吸附树脂(天津浩聚树脂科技有限公司)。
乙醇(纯度≥95%,食品级,成都市科隆化学品有限公司);甲醇(色谱纯)、乙腈(色谱纯)、磷酸(色谱纯),Knowles;芦丁(纯度≥99%)、烟花苷(纯度≥98%)、槲皮素(纯度≥99%)、山柰酚标准品(纯度≥98%),成都普思生物科技股份有限公司;苦荞麸皮原料(四川环太生物科技股份有限公司)。
1.2 色谱分析条件
采用Intersustain C18(4.6 mm×250 mm,5 μm)色谱柱,以乙腈和0.2%磷酸水溶液分别作为流动相A和B。梯度洗脱程序:0~25 min,15%~25% A;25~35 min,25%~50% A;35~45 min,50%~90% A;45~55 min,90% A。进样量20 μL,流速1.0 mL/min,柱温35 ℃,检测波长360 nm。
1.3 混合标准品溶液的制备
分别精密称取10 mg芦丁、2 mg烟花苷、5 mg槲皮素和1 mg山柰酚,用甲醇充分溶解后分别定容于10 mL容量瓶中,制成质量浓度分别1,0.2,0.5和0.1 mg/mL的标准样品母液。分别准确量取4,1,3和1 mL上述标准样品母液于10 mL容量瓶中,加入甲醇定容,备用。
1.4 大孔树脂富集苦荞麸皮黄酮
取适量苦荞麸皮,以料液比1∶10(g/mL),加入70%乙醇,在60 ℃下热回流提取3 h,提取3次,合并3次提取液,减压浓缩至干,得苦荞麸皮黄酮粗品。
取上述苦荞麸皮黄酮粗品,加水制备成1 mg/mL的上样液,以90%乙醇、2 BV/h的洗脱速度,采用ADS-7、AB-8、D101型大孔吸附树脂分别对苦荞麸皮黄酮粗品进行洗脱纯化,收集6 BV洗脱液,减压浓缩至干,得到不同大孔树脂富集的苦荞麸皮黄酮富集品。
1.5 待测样品溶液的制备
分别精密称取10 mg不同大孔树脂富集的苦荞麸皮黄酮富集品,用甲醇充分溶解,定容于10 mL容量瓶中,经0.22 μm微孔滤膜过滤,备用。
2 结果与讨论
2.1 标准品和待测样品色谱图
取各标准品混合液,分别在200~500 nm范围内进行紫外-可见光光谱扫描,分析4种黄酮类物质的最大吸收光谱。4种黄酮类物质在256和360 nm左右有最大吸收峰,同时考虑到标准品在256 nm处基线不稳定,而在360 nm处基线稳定,因此选择360 nm作为黄酮类化合物的检测波长(图1)。按1.2小节条件,分别精密吸取20 μL混合标准品、ADS-7、AB-8、D101型大孔树脂富集的苦荞麸皮黄酮富集品溶液进样,结果显示,以乙腈-0.2%磷酸水溶液作为流动相进行梯度洗脱,可以很好地将目标峰分开,各相邻色谱峰之间的理论塔板数均大于30 000,分离度均大于1.5(图2)。
2.2 检测方法学考察
2.2.1 线性关系
将混合标准品溶液加入甲醇稀释,分别配制成5个质量浓度水平。按1.2小节条件进样,以相应标准品的质量浓度为横坐标(X),色谱峰面积为纵坐标(Y),绘制标准曲线,分别得到芦丁、烟花苷、槲皮素、山柰酚的回归方程、相关系数和线性范围,结果见表1和图3。
结果显示,芦丁、烟花苷、槲皮素和山柰酚分别在25~400,1.25~20,9.375~150和0.625~10 μg/mL的浓度范围内与峰面积线性关系良好,线性相关系数均在0.999 6及以上。

图1 标准品紫外吸收图
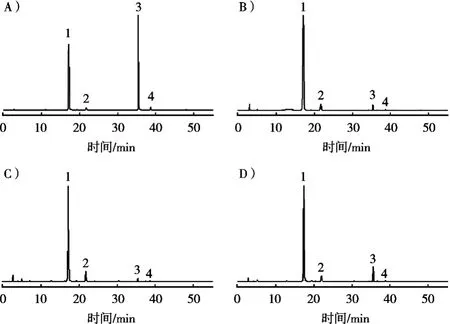
图2 混合标准品(A)和ADS-7(B)、AB-8(C)、D101(D)富集的待测样品色谱图
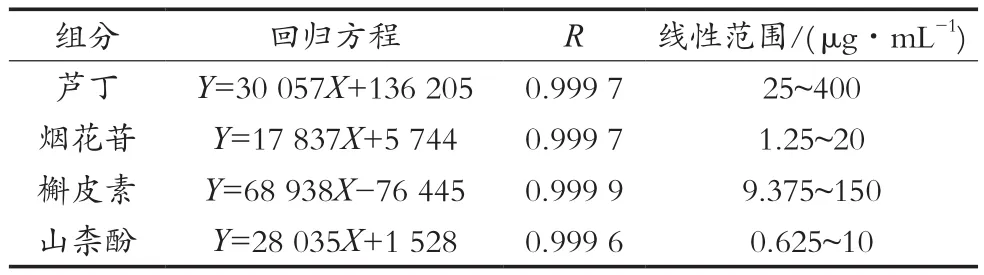
表1 4种黄酮类成分的线性关系
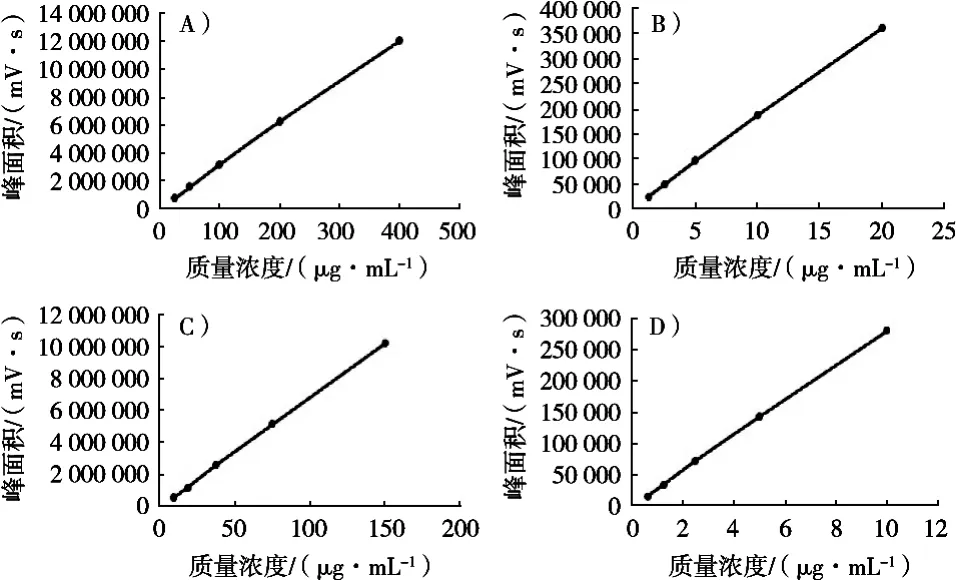
图3 4种黄酮类成分的标准曲线
2.2.2 精密度试验
取20 μL混合标准品溶液,按1.2小节重复进样6次,记录各黄酮成分的峰面积。结果显示,芦丁、烟花苷、槲皮素和山柰酚峰面积的δRSD分别为1.3%,1.7%,1.7%和0.9%,表明仪器精密度较好。
2.2.3 稳定性试验
将制备的同一份样品溶液,分别于配制后的0,2,4,8,12,24和48 h进样20 μL,记录各组分的峰面积。结果显示,芦丁、烟花苷、槲皮素和山柰酚峰面积的δRSD分别为2.4%,2.8%,1.6%和2.8%,表明待测样品溶液中4种黄酮类物质在48 h内稳定。
2.2.4 重复性试验
取5份适量苦荞麸皮黄酮富集品,按1.5小节方法制备待测样品溶液。精密吸取20 μL待测样品溶液,按1.2小节依次进样,结果显示,芦丁、烟花苷、槲皮素和山柰酚含量的δRSD分别为3.5%,3.3%,3.3%和3.2%,表明方法重复性良好。
2.2.5 加样回收率试验
取已知含量的苦荞麸皮黄酮富集品,分别加入一定量的芦丁、烟花苷、槲皮素和山柰酚储备液,其加入的量约相当于样品量的100%,每份样品重复6次。按1.2小节条件进样,结果显示,芦丁、烟花苷、槲皮素和山柰酚的平均回收率分别为99.48%,100.86%,100.93%和102.27%,符合分析要求。δRSD分别为3.2%,3.2%,3.0%和1.7%,结果见表2。
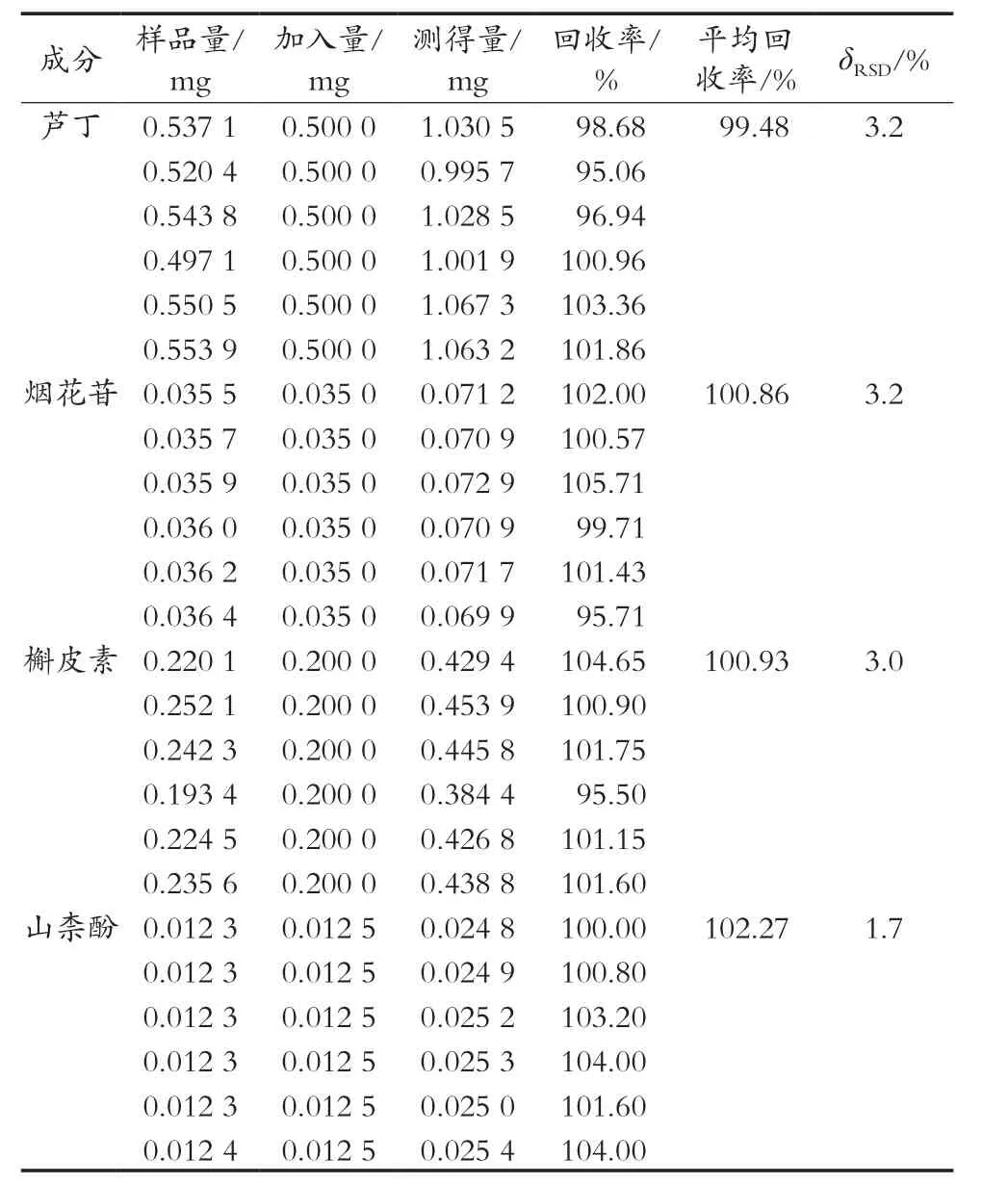
表2 加样回收率试验结果
2.3 不同大孔树脂富集样品检测结果
分别取不同大孔树脂富集的苦荞麸皮黄酮富集品,制备待测样品溶液,按1.2小节条件进样,并分析4种黄酮类化合物的含量,结果如表3所示。不同大孔树脂富集的苦荞麸皮黄酮富集品中芦丁、烟花苷、槲皮素和山柰酚4种黄酮类化合物的总含量由高到低为ADS-7型大孔树脂>AB-8型大孔树脂>D101型大孔树脂。

表3 不同大孔树脂富集的苦荞麸皮黄酮富集品检测结果
3 结论
此次试验建立了高效液相色谱同时检测不同大孔树脂富集的苦荞麸皮黄酮样品中芦丁、烟花苷、槲皮素和山柰酚4种黄酮类成分的含量检测方法,结果发现,ADS-7型大孔树脂富集的苦荞麸皮中4种黄酮的总含量相较AB-8和D101型大孔树脂更高,且该方法操作简单、准确性高、重复性好,可作为不同大孔树脂富集苦荞麸皮黄酮类物质的检测方法。该方法为相关产品开发的质量控制和进一步研究提供了参考。

